Первичная открытоугольная глаукома ? Часть 1

Содержание:
Описание
Первичная ОУГ — наиболее часто встречающаяся форма глаукоматозною процесса. Мужчины заболевают чаще, чем женщины. По данным нашего стационара, у 72% больных, госпитализированных с диагнозом первичной глаукомы, установлена ее открытоугольная форма. Среди последних 63 % составляли мужчины и 37 % женщины. Заболевание, как правило, возникает после 40 лет, и его частота увеличивается с возрастом в геометрической прогрессии. Так, по данным J. Wright (1966), пораженность глаукомой в возрасте 40—49 лет составляет 0,1%, увеличиваясь до 2,8% к 60—69 годам и 14,3% в возрастной группе 80 лет и старше. В редких случаях первичная ОУГ возникает в юношеском и молодом возрасте [Teikari J. М., O’Donnel J., 1989].↑ Патогенез
Патогенез глаукомы независимо от ее разновидности включает два механизма, разделенных в пространстве и отчасти во времени. Один из них действует в переднем отделе глаза и приводит в конечном итоге к повышению ВГД. Другой механизм, локализующийся в заднем отделе глазного яблока, служит причиной атрофии зрительного нерва.
Существуют противоречивые представления о взаимосвязи этих патофизиологических механизмов и последовательности их развития. По нашему мнению, глаукоматозный процесс начинается в переднем отделе глаза, а изменения в зрительном нерве являются следствием действия на него повышенного ВГД. Таким образом, передний патофизиологический механизм предшествует заднему. При этом повышенное ВГД служит последним звеном в патогенетической цепи переднего механизма и первым, пусковым звеном заднего механизма. Вместе с тем иногда возможно и первичное поражение ДЗН, вызванное, по-видимому, гемодинамическими нарушениями.
↑ Особенности циркуляции водянистой влаги
Изучение гидродинамики глаза показывает, что уровень ВГД определяется тремя факторами:
- скоростью продукции водянистой влаги,
- легкостью ее оттока из глаза
- и давлением в эписклеральных венах.
В многочисленных исследованиях с использованием различных методов установлено, что первичная ОУГ характеризуется постепенным ухудшением оттока водянистой влаги из глаза. По нашим данным, основанным на результатах тонографического исследования 635 глаз, средняя величина коэффициента легкости оттока в начальной стадии заболевания составляла всего 45% от среднего значения этого показателя в 140 здоровых глазах у лиц того же возраста, в развитой и далеко зашедшей стадиях — 25%, в терминальной стадии — 15%. Следовательно, между клинической стадией заболевания и легкостью оттока существует определенная зависимость. ОУГ начинается тогда, когда легкость оттока уменьшается в 2 раза, и достигает финальной стадии при ухудшении оттока в 7 раз.
↑ Локализация сопротивления оттоку
Повышенное сопротивление оттоку при глаукоме может отмечаться в УПК, претрабекулярной зоне, трабекулярной диафрагме, склеральном синусе и его выпускниках (наружных коллекторных каналах). Поскольку угол передней камеры в глазах с ОУГ всегда открыт, то повышенное сопротивление оттоку отмечается или в претрабекулярной зоне, или в дренажной системе глаза, т. е. в трабекулярной диафрагме, склеральном синусе или наружных коллекторных каналах. Поражение каждой из перечисленных выше структур может быть причиной повышения офтальмотонуса при глаукоме [Краснов М. М., 1974]. Вместе с тем в последние года появились доказательства решающей роли блокады склерального синуса в большинстве случаев первичной ОУГ.
Склеральный отдел. Расчеты, основанные на законе Пуазейля для ламинарного тока жидкости, показали, что склеральные сосуды ответственны лишь за незначительную часть сопротивления оттоку водянистой влаги в здоровом глазу. При полном закрытии половины коллекторных каналов ВГД в среднем нормальном глазу повысится всего на 0,08 мм рт. ст., а при уменьшении диаметра всех выпускников в 2 раза — на 1,6 мм рт. ст. Для того чтобы офтальмотонус увеличился на 10 мм рт. ст., пропускная способность коллекторных канальцев должна уменьшиться в 135 раз, что явно не соответствует результатам гистологических исследований глаукоматозных глаз [Нестеров А. П., 1968].
Иссечение склеры над шлеммовым каналом вместе с коллекторными каналами, интра- и эписклеральными сосудами не вызывает существенных изменений ни величины ВГД, ни коэффициента легкости оттока в глазах с ОУГ при условии, что просвет шлеммова канала не вскрывают [Хасанова Н. X. и др., 1968]. Следовательно, основная часть сопротивлению оттоку локализуется не в склеральном отделе дренажной системы глаза.
Претрабекулярная блокада. Некоторые авторы считают, что повышенное сопротивление оттоку в глазах с ОУГ отчасти связано с претрабекулярной блокадой, вызванной диагенезом УПК [Jerndal Т., 1969; Lichter P. R., Shaffer R.N., 1970]. Гребенчатая связка, отростки радужки и особенно остатки эндотелиальной мембраны Баркана могут создавать препятствие для оттока водянистой влаги. По мнению Т. Jerndal и соавт. (1978), во многих случаях ОУГ представляет собой врожденную глаукому с задержанным началом. Хотя такие случаи, возможно, действительно имеют место, особенно при возникновении ОУГ в молодом возрасте, их не следует рассматривать как типичные. Большинство исследователей, изучавших УПК и дренажную систему в глазах с ОУГ в клинических или лабораторных условиях, не обнаруживали их дисгенеза. Известно также, что гониотомия, с успехом используемая для устранения претрабекулярной блокады при врожденной глаукоме, не эффективна при первичной ОУГ. С позиций претрабекулярной блокады нельзя объяснить гипотензивный эффект миотиков и синусотомии при ОУГ. По нашему мнению, нерезко выраженные явления дисгенеза УПК наряду с другими анатомическими особенностями только предрасполагают к возникновению функциональной блокады склерального синуса при определенных условиях.
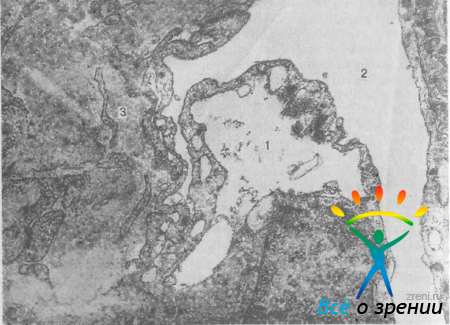
Трабекулярный отдел. Широкое распространение получило мнение, что основная часть сопротивления оттоку при первичной ОУГ локализуется в трабекулярной сети [Tripathi R. С., 1972; Rohen J., 1983]. Указывается на уменьшение вакуолизации эндотелия шлеммова канала, отложение гомогенного материала, относящегося, по-видимому, к гликозаминогликанам, в юкстаканаликулярной ткани (рис. 41),
Рис. 41. Начальная ОУГ. Клетка эндотелия шлеммова канала имеет нормальную структуру и хорошо выраженную гигантскую вакуоль (1), выступающую в просвет канала (2). Под клеткой видны отложения аморфного материала (3). Ув. 42 000.
[banner_centerrs] {banner_centerrs} [/banner_centerrs]
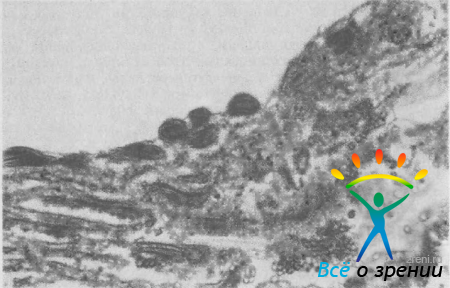
утолщение и гиалинизацию трабекулярных пластин, сужение интертрабекулярных щелей, дегенеративные изменения коллагеновых структур и клеточных элементов в глаукоматозных глазах (рис. 42).
Рис. 42. Утолщение, распад, гиалинизация части трабекулярных пластин, отложение пигментных гранул в глазу с первичной развитой ОУГ. Ув. 1010.
Однако все эти изменения, кроме очаговых отложений гомогенного материала в начальной стадии ОУГ, выражены крайне слабо [Нестеров А. П., Батманов Ю. Е., 1974; Fine В. et al., 1981].
Как известно, ОУГ развивается преимущественно у лиц пожилого и старческого возраста. При гистологических и электронно-микроскопических исследованиях здоровых глаз в этом возрасте отмечены аналогичные изменения в трабекулярной сети, включая отложения гомогенного материала, но менее выраженные, чем при глаукоме [Rohen J., 1983]. Следует, однако, иметь в виду, что глаукоматозные глаза крайне редко исследовались в самом начале болезни, так как для исследования использовали биоптаты, полученные во время антиглаукоматозных операций.
В этом отношении представляют интерес наблюдения Е. Lutjen-Drecoll и Е. Н. Ваrаnу (1974). Они выполняли трабекулэктомию у обезьян и через несколько месяцев проводили гистологические и электронно-микроскопические исследования оперированных глаз. Во всех случаях были обнаружены грубые изменения в трабекулярной сети, аналогичные тем, которые характерны для глаукоматозных глаз. Авторы объясняют эти изменения гипоперфузией трабекулярного аппарата, так как значительное количество водянистой влаги оттекало через фистулу в субконъюнктивальное пространство. Можно предположить, что и обнаруживаемые в глазах с ОУГ сначала умеренные, а затем грубые изменения в трабекулярной сети в значительной степени вызваны ее гипоперфузией.
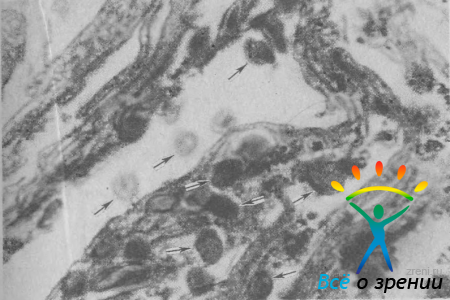
Особый интерес представляют наблюдения за прохождением эритроцитов через трабекулярную диафрагму [Нестеров А. П., Батманов Ю. Е., 1974]. В 17 из 21 глаза с начальной ОУГ элементы крови, попавшие в переднюю камеру во время операции, свободно проходили через трабекулярную сеть и юкстаканаликулярную ткань, хотя последняя содержала значительные очаговые отложения гомогенного материала. Эритроциты собирались под эндотелием внутренней стенки склерального синуса, их можно было видеть в гигантских вакуолях, а на некоторых срезах и в просвете синуса (рис. 43).
Рис. 43. Начальная ОУГ. Эритроциты (стрелки) свободно проходят из передней камеры через все структуры трабекулярной диафрагмы. Трабекулярные пластины и межтрабекулярные щели не изменены. Ув. 1010.
Способность эритроцитов проходить через трабекулярную стенку шлеммова канала хорошо известна [Inomata Н. et al., 1972]. Сохранение этой способности в начальной стадии ОУГ свидетельствует об относительно небольших изменениях проницаемости трабекулярной диафрагмы. Такой же вывод можно сделать на основании результатов наблюдений за изменениями ВГД и легкости оттока после синусотомии. В глазах с начальной глаукомой после вскрытия наружной стенки синуса и обнажения его трабекулярной стенки нормализуются и ВГД, и отток [Нестеров А. П., 1968]. К аналогичному заключению пришел К. Iwata (1979), который изучал скорость вымывания крови из шлеммова канала водянистой влагой, поступающей в канал через трабекулу. В ранней стадии ОУГ эта скорость была такой же, как и в здоровых глазах, но в последующих стадиях болезни заметно снижалась.
В свете приведенных выше фактов представляется сомнительным предположение, что основная часть сопротивления оттоку в начальной стадии ОУГ локализуется в трабекулярном отделе дренажной системы глаза. Сложнее оценить роль этого отдела в патогенезе псевдоэксфолиативной и пигментной глаукомы. Несомненно, трабекулярная сеть при этих разновидностях заболевания страдает в значительно большей степени, чем при простой первичной ОУГ. Известно, однако, что глаукома развивается только у части больных с псевдоэксфолиациями и синдромом пигментной дисперсии. При этом отсутствует прямая зависимость между выраженностью этих синдромов и возникновением глаукомы. По-видимому, поражения трабекулярного отдела недостаточно для возникновения глаукомы и заболевание возникает только при включении в процесс другого патогенетического механизма. Таким механизмом может служить функциональная блокада склерального синуса. Об этом свидетельствует тот факт, что и синусотомия, и лазерная трабекулопластика, устраняя блокаду синуса, дают одинаковые результаты при любой разновидности первичной ОУГ, особенно в начальной стадии болезни.
Склеральный синус. Приведенные выше факты свидетельствуют о том, что трабекулярный и склеральный отделы дренажной системы глаза в начальной стадии первичной ОУГ функционируют удовлетворительно, а вся система в целом оказывает повышенное сопротивление оттоку водянистой влаги из глаза. Это противоречие объясняется тем, что в глаукоматозном глазу возникает частичная функциональная блокада склерального синуса, вызванная смещением кнаружи трабекулярной диафрагмы. Приведем некоторые дополнительные доказательства существования такой блокады в глазах с ОУГ.
- Сужение шлеммова канала и его частичный коллапс — частая находка при гистологическом исследовании дренажной области глаза у больных с ОУГ (рис. 44). Рис. 44. Коллапс шлеммова канала (стрелки) в глазу с первичной ОУГ. Ув. 200.
Дистрофические изменения в трабекулярной сети начинаются в зоне, прилежащей к синусу, и затем распространяются кнутри и отчасти кнаружи [Нестеров А. П. и др., 1974; Teng C. et al., 1960]. - Как трабекулотомия, так и синусотомия при ОУГ дают одинаковые положительные результаты. Этот парадоксальный, на первый взгляд, эффект двух разных операций объясняется тем, что вскрытие как наружной, так и внутренней стенки синуса устраняет его функциональную блокаду.
- Проба с заполнением кровью шлеммова канала дает неодинаковые результаты в здоровых и глаукоматозных глазах. В здоровых глазах кровь легко заходит в канал, который при гониоскопии имеет вид ровной и довольно широкой полосы. У больных с начальной ОУГ полоса крови узкая, часто видна только в отдельных сегментах, или имеет кружевной, пятнистый вид [Suson Е., Schultz R., 1969]. После выполнения лазерной трабекулопластики, приводящей к устранению функционального блока синуса, нормальное его заполнение кровью восстанавливается [Мамедов Н. Г. и др., 1985].
↑ Вторичные изменения дренажной зоны глаза
Закрытие части просвета склерального синуса приводит к активизации нескольких патофизиологических механизмов.
- Часть дренажной системы глаза (трабекулы и коллекторные канальцы), соответствующая блокированному участку, перестает Функционировать. В результате этого повышаются сопротивление оттоку и ВГД.
- Постоянная перфузия трабекулярной сети водянистой влагой обеспечивает вымывание из нее гликозаминогликанов, пигментных частиц и других продуктов тканевого распада. В зоне блокады процесс самоочищения трабекулярного фильтра прекращается.
- Водянистая влага является единственным источником питания трабекулярной сети и эндотелия шлеммова канала. Неперфузируемые блокированные отделы синуса и трабекулы находятся в состоянии постоянной гипоксии.
- На тех участках, где возникает блокада синуса, трабекула придавливается к наружной стенке шлеммова канала с силой, равной величине ВГД. Вторично сдавливаются и трабекулярные щели. Механическое повреждение эндотелия трабекулы и синуса приводит к отеку и дегенерации тканей дренажной области глаза, появлению спаек и облитерации шлеммова канала и трабекулярных щелей.
- Повышение ВГД и снижение проницаемости трабекулярной диафрагмы обусловливают расширение зоны функциональной блокады склерального синуса. В результате этого глаукоматозный процесс развивается по типу медленно прогрессирующего порочного круга.
↑ Этиология
Если признать, что центральным звеном в патогенезе первичной ОУГ является функциональная блокада (коллапс) склерального синуса, то все факторы, способствующие возникновению такой блокады, нужно рассматривать как этиологические.
Блокада синуса возникает в результате смещения трабекулы кнаружи в просвет шлеммова канала. Смещение диафрагмы (S), разделяющей две полости, зависит от градиента давлений в них (?Р) и ригидности диафрагмы (Et):
S = ?P/Et. (7.1)
Градиент давлений является функцией проницаемости трабекулы (Ct) и минутного объема жидкости, протекающей через трабекулярную сеть (F):
?Р = F/Ct. (7.2)
Принимая во внимание (7.1)
S = F/Et * Ct (7.3)
Смещение диафрагмы, необходимое для возникновения блокады, назовем критическим (Sc). Величина Sc зависит от высоты просвета шлеммова канала. Она варьирует индивидуально и в разных сегментах одного и того же глаза. Как правило, Sc больше в заднем и меньше в переднем отделе синуса.
Из уравнения (7.3) следует, что непосредственными причинами блокады шлеммова канала могут быть увеличение минутного объема водянистой влаги, уменьшение проницаемости трабекулы или ее ригидности. Первый из этих факторов вряд ли имеет существенное значение, так как секреция водянистой влаги в глаукоматозных глазах не повышена.
Гомеостатические механизмы устраняют блокаду, уменьшая и увеличивая Et и Ct. Многочисленные нервные окончания во внутренней стенке синуса, по-видимому, служат прессорецепторами, реагирующими на разность давлений в передней камере глаза и шлеммовом канале. Эта разность обычно невелика, но она резко возрастает в блокированных участках синуса, достигая величины офтальмотонуса. Уменьшение F достигается снижением скорости секреции водянистой влаги, а увеличение Et и Сt — повышением тонуса цилиарной мышцы. Определенную роль играют и мышцы радужки.
Таким образом, функциональная блокада шлеммова канала при открытоугольной глаукоме может быть обусловлена понижением проницаемости трабекулярного аппарата, недостаточной его ригидностью и неэффективностью механизма цилиарная мышца — склеральная шпора — трабекула.
Роль анатомических факторов. К настоящему времени накопились факты, свидетельствующие о существовании анатомической предрасположенности к блокаде шлеммова канала [Нестеров А. П., Батманов Ю. Е., 1971 ]. К анатомическим факторам относят слабое развитие склеральной шпоры и цилиарной мышцы, заднее прикрепление волокон этой мышцы к склере, переднее положение шлеммова канала и малый угол его наклона к передней камере. В глазах с такими анатомическими особенностями механизм цилиарная мышца — склеральная шпора — трабекула, который растягивает трабекулярную сеть и поддерживает в открытом состоянии шлеммов канал, малоэффективен.
Отмеченные выше анатомические особенности характерны для больных с открытоугольной глаукомой и относительно редко наблюдаются у здоровых людей. Это можно объяснить тем, что процесс, приводящий к возникновению коллапса синуса, как бы осуществляет искусственный отбор глаз с заданными признаками.
Остановимся еще на двух анатомических факторах, которые могут иметь значение в генезе ОУГ. Известно, что передняя часть синуса блокируется чаще, чем задняя. Это связано с меньшей толщиной трабекулы и отсутствием склеральной шпоры, а также тем, что просвет синуса здесь особенно узкий. В здоровых глазах коллекторные канальцы начинаются, как правило, из заднего отдела синуса [Rohen J., 1969]. У больных ОУГ выпускные канальцы часто берут начало в переднем отделе синуса. Это приводит к снижению давления в передней части шлеммова канала и облегчает возникновение блокады как синуса, так и его выпускников.
Другой фактор связан с анастомозами между венами цилиарного тела и интрасклеральным венозным сплетением, физиологическая роль которых заключается в поддержании давления в склеральном синусе, близком к ВГД. При характерном для ОУГ переднем положении синуса анастомозы удлиняются, что не может не отразиться на их эффективности.
Роль дистрофических изменений. Анатомическое предрасположение к коллапсу синуса существует в течение всей жизни, но ОУГ возникает в среднем, пожилом и старческом возрасте. При этом частота заболевания увеличивается с возрастом. Роль возраста в этиологии глаукомы можно объяснить дистрофическими изменениями в трабекулярном аппарате, радужке и цилиарном теле. В пожилом возрасте утолщается юкстаканаликулярный слой, в нем появляются отложения экстрацеллюлярного материала, суживаются межтрабекулярные щели и шлеммов канал, в трабекулярной сети откладываются пигментные гранулы, продукты тканевого распада, эксфолиативные частицы [Fine В. et al., 1981 ]. Возрастные изменения соединительной ткани, а следовательно, и трабекулярной диафрагмы заключаются также в снижении ее упругости и появлении дряблости.
Возрастные дистрофические изменения в переднем отделе сосудистой оболочки заключаются в фокальной или диффузной атрофии стромы и пигментного эпителия радужки и цилиарного тела, атрофических изменениях цилиарной мышцы. Вследствие изменений в трабекулярной диафрагме уменьшаются ее проницаемость и упругость. Таким образом, увеличивается градиент давлений (?Р) и уменьшается ригидность диафрагмы Etr в уравнении 7.1. Дистрофические изменения в увеальном тракте приводят к снижению эффективности механизмов, предохраняющих шлеммов канал от сдавления.
У больных начальной первичной ОУГ дистрофические изменения в переднем отделе глаза имеют обычный возрастной характер, но выражены в большей мере. Это можно объяснить тем же процессом отбора, о котором упоминалось выше. Механизм отбора заключается в том, что при прочих равных условиях глаукомный процесс возникает в глазах с относительно большими дистрофическими изменениями в переднем отделе увеального тракта и трабекуле.
Из этого следует, что одного анатомического предрасположения недостаточно для развития первичной открытоугольной глаукомы. Заболевание возникает только в том случае, когда в достаточной степени изменяется проницаемость внутренней стенки шлеммова канала и снижается активность гомеостатических механизмов.
Таким образом, этиология первичной открытоугольной глаукомы сводится к воздействию двух факторов: анатомического предрасположения к возникновению блокады шлеммова канала и дистрофических изменений в трабекуле и переднем отделе увеального тракта. Сосудистые, эндокринные и обменные нарушения оказывают влияние на возникновение глаукомы постольку, поскольку они изменяют выраженность и распространенность дистрофических изменений. Из этой концепции вытекает следующее:
- чем выраженнее дистрофические изменения в дренажной области глаза, тем меньшая степень анатомического предрасположения необходима для возникновения глаукомы, и наоборот;
- глаукома развивается раньше и протекает тяжелее в тех глазах, в которых анатомическое предрасположение и первичные дистрофические изменения выражены сильнее.
Следует отметить, что анатомическое предрасположение включает в себя не одну, а группу особенностей, которые комбинируются неодинаково в разных случаях. То же можно сказать о характере и причинах дистрофических изменений в глазу. Это и дало нам основание отнести открытоугольную глаукому к мультифакториальным заболеваниям с пороговым эффектом. Первичная ОУГ возникает в тех глазах, в которых совокупность неблагоприятных факторов превысит некоторый порог, необходимый для включения патофизиологических механизмов болезни.
Кортикостероиды и открытоугольная глаукома. Установлено, что глюкокортикоиды оказывают влияние на уровень ВГД и—гидродинамику глаза. Особенно показательны результаты кортикостероидного теста, который заключается в инстилляции в глаз сильных синтетических кортикостероидов (дексаметазон, бетаметазон) в течение 4—6 нед. Повышение ВГД начинается через несколько дней и может достигать 15 мм рт. ст. и более.
У больных первичной ОУГ реакции ВГД на кортикостероидный тест часто бывает повышенной. Этот факт признают все исследователи, хотя данные о частоте повышенного ответа ВГД у разных авторов различны. При других формах глаукоматозного процесса (первичная ЗУГ, вторичная глаукома) кортикостероидный тест бывает положительным значительно реже, чем при простой форме первичной ОУГ. По данным М. Armaly (1967), высокая чувствительность ВГД к кортикостероидам закреплена генетически. Однако исследования на близнецах, проведенные J. Francois (1978), не подтвердили наследственный характер реакции офтальмотонуса на кортикостероиды.
Механизм действия глюкокортикоидов на ВГД заключается в прогрессирующем ухудшении оттока водянистой влаги из глаза. Причины такого ухудшения не установлены. Представляется оправданной следующая гипотеза. Под влиянием глюкокортикоидов в трабекулах увеличивается содержание гликозаминогликанов, что, по-видимому, происходит из-за уменьшения выхода катаболических ферментов из лизосом гониоцитов [Francois J., 1984]. В результате этого проницаемость трабекулярной диафрагмы несколько снижается, а разность давлений в передней камере и склеральном синусе увеличивается. В анатомически предрасположенных глазах, особенно если проницаемость трабекул была снижена раньше, возникает функциональная блокада синуса, что и приводит к повышению ВГД. Если блокада уже существовала до введения кортикостероидов, то ее площадь расширяется. Если эта гипотеза верна, то с помощью кортикостероидного теста можно определять предрасположенность к коллапсу синуса.
Данные о состоянии глюкокортикоидного обмена у больных ОУГ противоречивы. Одни авторы обнаружили у них повышение уровня кортизола плазмы крови [Хасанова Н. X., Помощникова Н. И., 1971 ], другие не подтвердили этого [Podos S. et al., 1972]. Не нашли подтверждения и отдельные сообщения о нарушениях системной и Целлюлярной чувствительности к глюкокортикоидам у больных ОУГ.
Роль наследственности, других заболеваний и внешней среды. Многие авторы рассматривают первичную ОУГ как генетически обусловленное заболевание. Действительно, ОУГ часто носит семейный характер. Т. И. Ерошевский и Р. П. Шикунова обнаружили семейную ОУГ в 21% случаев. По данным других авторов, частота семейного заболевания варьирует от 5 до 50% [Shields В., 1987]. Описаны и доминантный, и рецессивный типы наследования, однако в большинстве случаев преобладает полигенная передача заболевания. Многие исследователи отмечают, что ОУГ чаще возникает у больных атеросклерозом, гипертонической болезнью, с гипотоническими кризами, диабетом, с синдромом Кушинга и у лиц снарушениями липидного, белкового и некоторых других видов метаболизма [Хасанова Н. X.. Помощникова Н. И., 1971; Михеева Е. Г., 1976; Кашинцева Л. Т., 1978]. Вместе с тем А. Я. Бунин и соавт. (1988) утверждают, что общие сосудистые заболевания и диабет встречаются у больных с глаукомой с той же частотой, что и в контрольной популяции. Интересно отметить, что продолжительность жизни больных глаукомой такая же, как и в общей популяции [Ахророва 3. Д., 1984 ].
Ряд авторов указывают на снижение тонуса внутриглазных сосудов и дефицит кровоснабжения глаза при ОУГ [Краснов М. М., 1963; Бунин А. Я., 1967; Кацнельсон Л. А., 1976; Козлов В. И., 1976; Васинский С. Н. и др., 1989]. По мнению С. Н. Федорова (1981), для ОУГ характерны изменения сосудов и нарушения кровообращения преимущественно в переднем отделе глаза.
Спорным является вопрос об иммунологических нарушениях общего и местного характера при глаукоме. В то время как одни исследователи обнаруживали такие изменения, свидетельствующие о существовании иммунологических механизмов развития ОУГ [Стукалов С. Е., 1975; Захарова И. А., 1985; Ульданов Г. A. и др., 1987], другие не нашли иммунологических сдвигов при этой форме глаукомы [Rodrigues М. et al., 1980; Radda Т. et al., 1982].
Первичная ОУГ значительно чаще сочетается с миопией, чем с другими видами рефракции глаза. У близоруких легкость оттока ниже, а ВГД выше их средних значений в эмметропических глазах. Большая частота ОУГ у миопов может быть связана с характерным для них передним положением шлеммова канала и слабостью цилиарной мышцы.
В настоящее время нет достоверных доказательств того, что особенности образа жизни, труда, питания, метеорологические и географические факторы влияют на частоту возникновения ОУГ. Профилактические осмотры населения свидетельствуют об одинаковой заболеваемости глаукомой сельского и городского населения. Уровень ВГД как в здоровых, так и в глаукоматозных глазах зимой несколько выше, чем летом. Однако заболеваемость глаукомой в северных районах не выше, чем в южных. Заболеваемость ОУГ в различных географических районах России, в других странах Европы и Северной Америке примерно одинаковая. Вместе с тем отмечены некоторые расовые различия в заболеваемости глаукомой и ее течении. Так, у негров ОУГ возникает чаще и в более молодом возрасте, чем у белых [Wilensky J. et al., 1978]; и у белых, и у негров ОУГ наблюдается значительно чаще, чем ЗУГ, однако для монголоидной расы характерно превалирование ЗУГ над ОУГ.
↑ Этиологические и патогенетические звенья
Этиологическая и патогенетическая цепь первичной ОУГ представляется нам в следующем виде:
- генетические звенья;
- изменения общего характера;
- первичные местные функциональные и дистрофические изменения;
- нарушения гидростатики и гидродинамики глаза;
- повышение внутриглазного давления;
- вторичные сосудистые расстройства, дистрофия и дегенерация тканей;
- глаукоматозная атрофия зрительного нерва.
С клинической точки зрения глаукома начинается только тогда, когда ВГД повышается, хотя бы периодически, до уровня, опасного для зрительного нерва. Это объясняется, с одной стороны, тем, что диагноз глаукомы не может быть точно установлен, если офтальмотонус сохраняется на нормальном уровне, с другой — тем, что заболевание неопасно для зрительных функций до тех пор, пока внутриглазное давление не повысится.
Не у каждого больного патогенетическая цепь развертывается от первого до последнего звена. Патологический процесс может временно остановиться или развиваться так медленно, что глаукома в клиническом смысле не успевает возникнуть в течение жизни. Вместе с тем у очень старых людей глаукома может не возникнуть вследствие нарушения секреторной функции цилиарного тела, несмотря на достаточное развитие патогенетических механизмов.
- Наследственность играет решающую роль в возникновении первичной глаукомы. Об этом и свидетельствуют результаты обследования ближайших родственников больных глаукомой, одинаковая распространенность глаукомы в странах с различным климатом и условиями жизни, в городской и сельской местности и в разных слоях населения. Несмотря на многочисленные исследования, определенного влияния факторов среды на заболеваемость глаукомой не установлено.
Генетические влияния, обусловливающие возникновение первичной глаукомы, носят, по-видимому, сложный характер и не сводятся к действию одного гена. Они определяют интенсивность возрастных изменений в организме, местную реакцию в глазу на возрастные сдвиги и анатомические особенности дренажной области глаза и ДЗН. - Изменения общего характера (сосудистые, эндокринные, обменные, иммунные) оказывают влияние на регуляцию внутриглазного давления, процессы гомеостаза, выраженность возрастных нарушений в различных структурах глаза, прежде всего в его дренажном аппарате, а также на толерантность зрительного нерва к повышенному внутриглазному давлению.
- Первичные дистрофические изменения — это те, которые предшествуют возникновению глаукомы и не связаны с действием на глаз повышенного внутриглазного давления. К ним относят возрастные и патологические (при общих заболеваниях, псевдоэксфолиациях и др.) изменения в трабекулярной диафрагме, приводящие к снижению ее проницаемости и упругости.
К местным функциональным нарушениям мы относим изменения гемодинамики, колебания в скорости образования водянистой влаги, ослабление тонуса цилиарной мышцы. Местные функциональные и трофические расстройства создают предпосылки для развития трабекулярного и каналикулярного блоков, нарушающих циркуляцию водянистой влаги в глазу. - Механические звенья в патогенезе первичной глаукомы начинаются с прогрессирующего нарушения гидростатического равновесия. На каком-то этапе это приводит к развитию функционального блока шлеммова канала и трабекулярной сети, в результате чего отток жидкости нарушается и внутриглазное давление повышается. Глаукома начинается только с этого момента. Существенную роль в ее возникновении играют генетически обусловленные особенности в строении глаза, облегчающие возникновение функционального блока.
- Высокое внутриглазное давление и нарушение взаимоотношений между тканями глаза (придавливание трабекулы к наружной стенке шлеммова канала) служат причинами вторичных циркуляторных и трофических расстройств. На первичный глаукоматозный процесс, вызванный функциональным блоком дренажной системы глаза, наслаивается по существу вторичная глаукома, связанная с деструктивными изменениями в дренажной зоне склеры.
- Развитие глаукоматозной атрофии зрительного нерва связано с повышением ВГД до некоторого порогового, индивидуально варьирующего уровня» отделяющего толерантное давление от патологического. Важной особенностью глаукоматозной атрофии ДЗН является медленное развитие процесса, обычно в течение нескольких лет. При этом атрофия ДЗН начинается не сразу после повышения давления до порогового уровня, а спустя длительный латентный период, исчисляемый месяцами и годами.
↑ Другие теории этиологии и патогенеза
С. Teng и соавт. (1960), основываясь на результатах гистологических исследований здоровых и глаукоматозных глаз, считают, что причиной нарушения оттока водянистой влаги из глаза при глаукоме служит первичная дегенерация трабекулярной ткани. Дегенерация возникает при прямом контакте коллагеновых волокон с водянистой влагой, возникающей в результате появления дефектов в защитном эндотелиальном слое. А. Л. Пригожина (1966) рассматривала глаукому как частное проявление общего сосудистого заболевания, а А. Я. Фрадкин (1970) — как результат ослабления деятельности коры полушарий головного мозга и патологии гипоталамической области. R. Tripathy (1972) основным звеном патогенеза ОУГ считает нарушение процесса макропиноцитоза в эндотелии внутренней стенки шлеммова канала, a J. Rohen (1986) — накопление мукополисахаридов в юкстаканаликулярном слое трабекулярной диафрагмы. С. Н. Федоров (1981) связывает ОУГ с гемодинамическими нарушениями преимущественно в переднем отделе глаза.
Фиброниктиновая гипотеза генеза ОУГ основана на увеличении содержания фиброниктина в экстрацеллюлярном матриксе юкстаканаликулярного слоя и внутренней стенки шлеммова канала у больных глаукомой [Бродская М. В. и др., 1988]. Полагают, что этот гликопротеин оказывает влияние на сопротивление оттоку водянистой влаги из глаза [Rodriges М. et al., 1980].
По мнению В. В. Волкова и соавт. (1985), сущность глаукомы заключается в дистрофии, а затем и атрофии ДЗН «от сдавления, а точнее продавливания его со стороны полости глаза вследствие изменения привычного соотношения между ВГД и внутричерепным давлением в сторону увеличения первого или уменьшения второго (вместо нормального 2:1 до 3:1 и более). Причиной такого сдвига чаще оказывается повышение ВГД за счет ухудшения гидродинамики глаза, реже — понижение ВЧД за счет нарушения общей гемодинамики организма и на этой основе — ухудшения гидродинамики в полости черепа».
С. Е. Krakau и соавт. (1983) полагают, что глаукома начинается с циркуляторных нарушений в ДЗН, которые приводят к его атрофии. Что касается повышения ВГД, то оно носит вторичный характер и не оказывает существенного влияния на течение болезни.
Новая концепция патогенеза открытоугольной глаукомы разрабатывается А. Я. Буниным (t984). Он считает, что в развитии дистрофических изменений дренажной системы глаза при глаукоме участвует процесс перекисного окисления липидов (ПОЛ). Субстратом перекисного окисления, вероятно, являются липиды клеточных мембран трабекулярного эндотелия и других мембранных структур, контактирующих с водянистой влагой.
Активацию ПОЛ в водянистой влаге и тканях трабекулярной системы при открытоугольной глаукоме подтверждают следующие данные. В липидных экстрактах из водянистой влаги и биопсийных фрагментов дренажной системы 39 глаз с открытоугольной глаукомой обнаружено существенное увеличение содержания первичных и конечных продуктов ПОЛ по сравнению с контролем [А. Я. Бунин и др., 1985]. В этих же структурах в глаукомных глазах А. Я. Бунин и соавт. (1992) обнаружили дефицит глутатиона, одной из функций которого является защита, тканей от продуктов перекисного окисления липидов.
А. Я. Бунин и В. Н. Ермакова (1987) полагают, что изменения микрососудов глаза и конъюнктивы у больных ОУГ могут быть обусловлены повреждающим влиянием водянистой влага, содержащей избыток продуктов ПОЛ.
Продолжение в следующей статье: Первичная открытоугольная глаукома ? Часть 2
----
Статья из книги: Глаукома. Нестеров А.П.



Комментариев 0