Результаты десяти лет применения комбинированного лечения меланомы хориоидеи стадии T2 брахитерапией и транспупиллярной термотерапией
Содержание:
Описание
↑ Результаты десяти лет применения комбинированного лечения меланомы хориоидеи стадии T2 брахитерапией и транспупиллярной термотерапией
Автор: А. А. Яровой, Д. А. Магарамов, Е. С. Булгакова
ФГУ «МНТК "Микрохирургия глаза" им. акад. С. Н. Федорова Росмедтехнологии», Москва
Изучены результаты комбинированного лечения больных с меланомой хориоидеи (MX) с применением брахитерапии Ru-106+Rh-106 (БТ) и транспупиллярпой термотерапии (ТТТ).
Проведено комбинированное лечение 70 пациентов (70 глаз) с MX с высотой опухоли от 2,5 до 10,8 мм (в среднем 6,5 + 0,24 мм). Срок наблюдения составил от 6 до 120 мес, медиана — 47 мес. ТТТ (810 нм) проводили через 24— 48 ч после подшивания офтальмоаппликатора (OA).
Полная или частичная регрессия MX получена у 69 (99%) больных: в среднем с 6,4 ± 0,24 до 2,4 ± 1,9 мм. Эффект отсутствовал в одном наблюдении. Энуклеация выполнена у одной больной по поводу вторичной глаукомы. Продолженный рост отмечен в одном наблюдении. Диссеминация MX с развитием метастазов в печень имела место в 3 наблюдениях. При анализе по методу Каплана—Майера 5-летний уровень сохранения глаза составил 99%, количество больных без метастазов — 94%, безрецидивная выживаемость — 91%, общая эффективность (количество пациентов без отрицательных результатов) — 89%.
Таким образом, при MX комбинированное лечение (БТ + ТТТ) в сравнении с БТ как монотерапией дает лучшие локальные результаты (в том числе возможность сохранения глаза) и не ухудшает выживаемость больных даже при лечении опухолей стадии Т2, т. е. высотой до 10,0 мм.
Проведено комбинированное лечение 70 пациентов (70 глаз) с MX с высотой опухоли от 2,5 до 10,8 мм (в среднем 6,5 + 0,24 мм). Срок наблюдения составил от 6 до 120 мес, медиана — 47 мес. ТТТ (810 нм) проводили через 24— 48 ч после подшивания офтальмоаппликатора (OA).
Полная или частичная регрессия MX получена у 69 (99%) больных: в среднем с 6,4 ± 0,24 до 2,4 ± 1,9 мм. Эффект отсутствовал в одном наблюдении. Энуклеация выполнена у одной больной по поводу вторичной глаукомы. Продолженный рост отмечен в одном наблюдении. Диссеминация MX с развитием метастазов в печень имела место в 3 наблюдениях. При анализе по методу Каплана—Майера 5-летний уровень сохранения глаза составил 99%, количество больных без метастазов — 94%, безрецидивная выживаемость — 91%, общая эффективность (количество пациентов без отрицательных результатов) — 89%.
Таким образом, при MX комбинированное лечение (БТ + ТТТ) в сравнении с БТ как монотерапией дает лучшие локальные результаты (в том числе возможность сохранения глаза) и не ухудшает выживаемость больных даже при лечении опухолей стадии Т2, т. е. высотой до 10,0 мм.
В настоящее время брахитерапия (БТ) является ведущим методом лечения меланомы хориоидеи (MX). Наиболее часто используемые радионуклиды — рутений-106 (Ru-106) и йод-125 (1-125). Если физические особенности гамма-излучения 1-125 позволяют эффективно облучать опухоли высотой 10,0 мм и более [25], то показаниями к БТ с Ru-106 по размерам MX (с учетом пробега электронов в биологической ткани до 5—6 мм) считают высоту опухоли не более 6,0 мм и протяженность до 15— 16 мм [2—4, 24].
Высказывается мнение о необходимости жесткого соблюдения указанных показаний к БТ как об априори наиболее безопасном для жизни больных варианте их ведения в связи с невозможностью полного облучения и разрушения таких MX [2—4]. Вместе с тем энуклеация, показанная при больших размерах MX, не является удовлетворительным методом лечения и не отвечает современным тенденциям лечения больных с MX. Известно, что удаление глаза не предотвращает метастазирование MX [1,5], однако ухудшает качество жизни больных [6]. Изучения различий выживаемости после органосохраняющего лечения и после энуклеации у больных с MX единичны и не подтверждают увеличения риска диссеминации при лечении с сохранением глаза [23, 25].
Ограничения возможностей БТ по высоте MX, значительная частота случаев частичной регрессии опухоли с сохранением риска продолженного роста и метастазирования остаточной опухоли обусловили попытки повышения эффективности БТ и расширения показаний к ней с применением адъювантных методов лечения, в частности транспупиллярной термотерапии (ТТТ), используемой чаще как метод монотерапии при малых MX [7, 8, 12, 14, 21, 28, 31].
[banner_centerrs] {banner_centerrs} [/banner_centerrs]
Работы, посвященные комбинированному лечению с применением БТ и ТТТ (БТ + ТТТ) [9, 13, 27], в сравнении с публикациями, посвященными БТ как монотерапии, немногочисленны, число представленных наблюдений в них невелико, неясны результаты комбинированного лечения, конкретные ее преимущества, недостатки и ограничения, особенно в сравнении с самостоятельной БТ. Кроме того, отсутствует единообразное понимание термина "комбинированное лечение".
Цель работы — изучить результаты комбинированного лечения больных с MX с применением БТ и одновременной ТТТ.
↑ Материал и методы
Проведено комбинированное лечение с использованием БТ + ТТТ у 70 пациентов (70 глаз) с MX: 33 (47%) мужчин и 37 (53%) женщин в возрасте от 25 до 76 лет (средний возраст 50,8 ± 11,4 года).
Высота опухолей — от 2,5 до 10,8 мм, средняя — 6,5 ± 0,24 мм. Опухолей с проминенцией 6,0 мм и менее было 30 (43%) — 1-я группа, более 6,0 мм — 40 (57%) — 2-я группа. Средняя высота MX в 1-й группе составляла 4,6 ± 0,2 мм, во 2-й — 7,9 ± 0,29 мм, протяженность MX в обеих группах от 6,8 до 18,9 мм (в среднем 13,0 + 2,5 мм), средний максимальный диаметр основания в 1-й группе — 12,3 ± 2,4 мм, во 2-й — 13,5 ± 2,5 мм. В 2 случаях максимальный диаметр основания опухолей ("длина") значительно превышал их "ширину", что потребовало проведения "двойного" подшивания (с перемещением) офтальмоаппликатора (OA).
В соответствии с классификацией TNM [10] распределение больных MX по стадиям было следующим: TlaNOMO — 1 (1%) больной, T2aN0M0 - 61 (88%), T3aN0M0 -8(11%).
У 10 пациентов опухоли локализовались в макулярной зоне, у 23 — парамакулярно, у 20 — экваториально, у 6 имелись цилиохориоидальные опухоли, у 11 — кжетапапиллярные (ЮП).
Острота зрения до лечения составляла от "движения руки" до 1,0: от 1,0 до 0,5 у 37 пациентов, от 0,5 до 0,1 у 15, 0,1 и ниже у 18.
До лечения метастазов не выявлено ни в одном случае. Срок наблюдения больных, получавших БТ + ТТТ, составил от 6 до 120 мес, медиана — 47 мес.
Эффективность лечения (в том числе и местную) оценивали на момент завершения исследования, но не ранее чем через 12 мес после окончания лечения. Больных с меньшим сроком наблюдения (за исключением отрицательных результатов) в исследование не включали.
БТ проводили с использованием комплекта OA с радионуклидом Ru-106 + Rh-106 производства ФГУ "ГНЦ Российской Федерации Физико-энергетический институт им. А. И. Лейпунского" (Обнинск). Средняя мощность поглощенной дозы бета-излучения на рабочей поверхности OA составляла от 705 до 2490 сГр/ч, поглощенная апикальная доза облучения — от 120 до 160 Гр, в среднем 136 Гр. При высоте опухоли более 6,0 мм расчет дозы производили таким образом, чтобы на глубине тканей 5,5—6,0 мм поглощенная доза облучения составляла 120— 130 Гр, но доза на склеру не превышала 2500 Гр; средняя доза облучения при расчете на склеру составила 1246 Гр.
Лазерную ТТТ (810 нм) в рамках комбинированного лечения проводили через 24—48 ч после подшивания OA — до развития заметных лучевых воспалительных изменений на глазном дне и поверхности глаза, могущих помешать или затруднить выполнение ТТТ. При невозможности полноценно выполнить ТТТ (из-за транссудативной отслойки сетчатки, геморрагий на поверхности MX, бугристой поверхности и т. д.) от проведения ТТТ отказывались и таких пациентов в исследование не включали. При цилиохориоидальной локализации MX ТТТ проводили на доступной воздействию поверхности опухоли. Мощность излучения составляла от 250 до 1000 мВт при диаметре пятна от 1 до 3 мм, количество аппликаций — от 4 до 17 (в среднем 13).
↑ Результаты и обсуждение
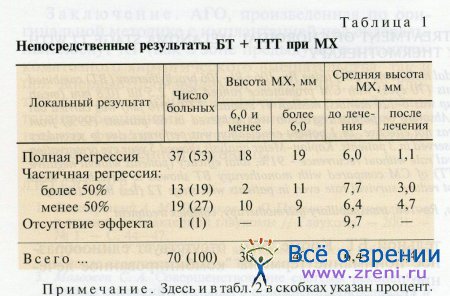
Положительный непосредственный результат БТ + ТТТ в виде полной или частичной регрессии опухоли в среднем с 6,4 ± 0,24 до 2,4 ±1,9 мм (на 63%) получен у 69 (99%) больных. В одном наблюдении отмечено отсутствие регрессии опухоли и в связи с отказом больной от энуклеации проведена дополнительная БТ.
Количество больных с непосредственными результатами, в том числе в группах с разной исходной высотой опухоли (6,0 мм и менее и более 6,0 мм), а также средняя высота опухоли представлены в табл. 1.
В группе пациентов с высотой MX до 6,0 мм (п = 30) высота опухоли уменьшилась в среднем с 4,6 ± 0,2 до 1,8 ± 1,7 мм (на 61%), в группе больных с опухолями высотой 6,1 мм и более (я = 40) — с 7,9 + 0,29 до 2,9 ± 1,95 мм (на 63%). Различий в темпах регрессии MX в указанных группах не выявлено.
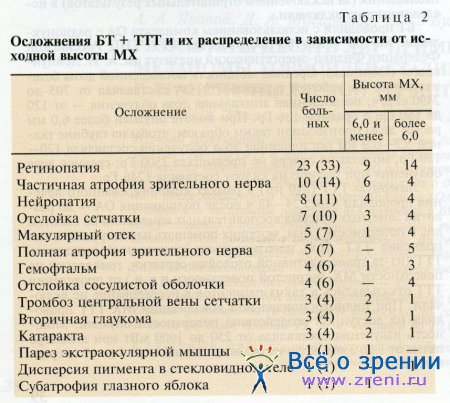
Поздние (за исключением отслойки сосудистой оболочки) осложнения БТ + ТТТ представлены в табл. 2.
При сравнении групп больных с осложнениями и без них по ряду показателей выявлено, что средняя высота MX у больных с осложнениями была достоверно больше, чем у больных без осложнений (табл. 3).
Закономерно при этом средняя поглощенная доза бета-излучения на склеру была больше при облучении больших опухолей: в 1-й группе при проминенции опухоли 6,0 мм и менее она составляла 1059 ± 178 Гр, во 2-й — более 6,0 мм - 2124 ± 205 Гр (р < 0,0002).
Энуклеация пораженного глаза выполнена у одной больной через 6 мес после БТ + ТТТ по поводу вторичной глаукомы (при MX с исходной высотой 9,3 мм и протяженностью 12,3 мм с частичной регрессией до 5,8 мм при гистологически полной деструкции опухоли). Продолженный рост через 30 мес после БТ + ТТТ отмечен у одной больной с регрессией MX с 6,3 до 5,3 мм (проведена повторная БТ).
Диссеминация MX с развитием метастазов в печень имела место в 3 наблюдениях: через 18, 30 и 32 мес после БТ + ТТТ. От причины, не связанной с MX (рак желудка), через 2,5 года после БТ + ТТТ погиб один больной.
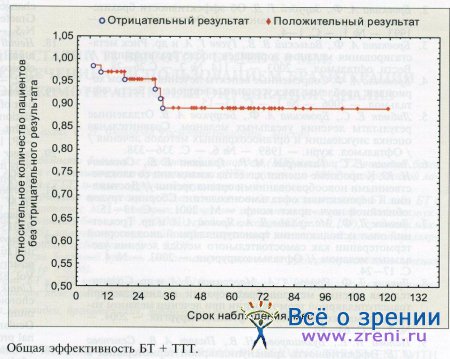
Таким образом, отрицательные результаты комбинированного лечения имели место в 6 наблюдениях. При анализе результатов по методу Капла-на—Майера (логранговый тест) 5-летние показатели эффективности БТ + ТТТ были следующими: уровень сохранения глаза как органа (собственно органосохраняющая эффективность) — 99%, количество больных без метастазов — 94%, безрецидивная выживаемость — 91%, общая выживаемость — 92%, общая эффективность (относительное количество пациентов без отрицательных результатов) — 89% (см. рисунок).
Средняя острота зрения после БТ + ТТТ снизилась с 0,48 до 0,14. Острота зрения ухудшилась у 47 (74%) больных, не изменилась у 13 (20%), повысилась у 4 (6%). Количество больных с остротой зрения от 1,0 до 0,5 уменьшилось на 41%, с остротой зрения 0,4—0,2 — на 5%, а количество больных с остротой зрения 0,1 и менее увеличилось на 46%.
Согласно имеющимся взглядам, показания к БТ с Ru-106 ограничиваются высотой опухоли до 5,5— 6,0 мм, реже до 7,0 мм [2—4, 24]. В связи с этим актуальным представлялось изучение эффективности органосохраняющего лечения больных с MX стадии Т2 (толщина MX от 2,5 до 10,0 мм, протяженность — от 10 до 16 мм [10]) комбинированным воздействием БТ и ТТТ. В исследование были включены также 8 пациентов с MX стадии ТЗ.
Полученные результаты на более значительном клиническом материале и при больших сроках наблюдения подтверждают опубликованные нами ранее данные [13] о том, что комбинирование БТ и ТТТ улучшает локальные результаты лечения MX в сравнении с результатами БТ как монотерапии. Об этом же свидетельствует и сравнительный анализ с данными литературы по эффективности БТ.
Так, БТ + ТТТ, по нашим данным, привела к полной или частичной регрессии MX в 99% наблюдений при средней высоте опухоли 6,5 мм. В исследовании А. Ф. Бровкиной и соавт. [3] полная регрессия MX после БТ получена у 61,6% больных при средней высоте опухоли 3,45 мм, а отсутствие эффекта имело место у 7,7% при высоте опухоли от 6,2 до 9,5 мм. По данным L. Heindl и соавт. [18], локальный контроль составил 93% при высоте MX не более 5,5 мм, по данным R. Hermann и соавт. [19] — 90% при средней высоте опухолей 3,85 мм. В исследовании В. Stoffelns и соавт. [30] при анализе 52 глаз с MX высотой не более 4,5 мм (в среднем 3,2 мм) и при высоких дозах облучения (150 Гр) локальный контроль достигнут в 92% наблюдений.
Количество и состав осложнений при комбинированном лечении БТ + ТТТ, а также функциональные результаты в целом согласуются с БТ по данным литературы, а дополнительное лазерное воздействие на опухоль при БТ + ТТТ не увеличивало количества осложнений.
Уровень сохранения глаза после БТ + ТТТ для 5-летнего срока наблюдения в нашем исследовании составил 98%. После БТ с Ru-106 энуклеации выполняют в 5,4—25,6% случаев, из них в 42,5— 84,3% по поводу продолженного роста [19, 24, 30]. В исследовании J1. С. Терентьевой и В. П. Фокина [11] из 21 больного с MX толщиной более 6,0 мм энуклеации выполнены у 2. А. Ф. Бровкина и соавт. [3] выявили, что неудовлетворительный эффект лечения или рецидив опухоли явились показанием для энуклеации у 28,2% больных. По данным В. Stoffelns и соавт. [30], после БТ MX высотой до 4,5 мм с диаметром основания до 12 мм (52 наблюдения) энуклеации произведены у 10% больных. Такой же уровень энуклеаций приводят R. Hermann и соавт. [19]. По данным P. Lommatzsch [24], энуклеации были необходимы у 64 (20,7%) из 309 больных. L. Bergman и соавт. [16] энуклеацию выполнили у 18% из 579 больных. Основные причины энуклеаций — рецидив опухоли, болящая глаукома, подозрение на экстрасклеральный рост.
Выживаемость, особенно специфическая, — один из важнейших критериев оценки органосо-храняющих методов лечения при MX. Многими, в том числе рандомизированными, исследованиями показано отсутствие статистически достоверных различий выживаемости больных с MX как после органосохраняющего лечения, так и после удаления пораженного глаза [15, 17, 29]. Например, при анализе меланомаспецифической и общей выживаемости у больных за период с 1955 по 2000 г. повышения данного показателя не отмечено, несмотря на широкое современное распространение органосохраняющих методов лечения [20].
В нашем исследовании, включавшем опухоли высотой до 10,8 мм, безрецидивная выживаемость составила 91%, что соответствует данным других авторов. После БТ с Ru-106 уровень метастазиро-вания достигает 20% при среднем сроке наблюдения 3—5 лет [2, 3, 19, 24]. При опухолях высотой более 6,0 мм выживаемость достоверно ниже, чем при проминенции опухоли до 6,0 мм [22]. Е. С. Либман и соавт. [5] приводят данные о 5-летней специфической выживаемости: после органосохраняющего лечения она составила 95%, после энуклеации — 89,6%. По данным F. Rouberol и соавт. [26], 5- и 10-летняя общая выживаемость после БТ составляет 82 и 72% соответственно, а по данным R. Hermann и соавт. [19], — 90 и 92%. L. Bergman и соавт. [16] сообщили об уровне общей выживаемости 83,3% к 5 годам и 71,5% к 10 годам после БТ, специфическая выживаемость составила 95,5 и 94% соответственно.
↑ Заключение
Таким образом, полученные результаты и сопоставление их с данными литературы об эффективности БТ как монотерапии (при высоте опухолей не более 5,0—6,0 мм) свидетельствуют о том, что при MX комбинированное лечение с использованием БТ и ТТТ дает лучшие локальные результаты (в том числе возможность сохранения глаза) и не ухудшает выживаемость больных даже при опухолях стадии Т2, т. е. высотой до 10,0 мм.
---
Статья из журнала: "Вестник Офтальмологии | Том 127. №1 2011"




Комментариев 0