Регуляция рН в зрительной клетке и ее роль в механизмах фототрансдукции (ЧАСТЬ ІІ)

Описание
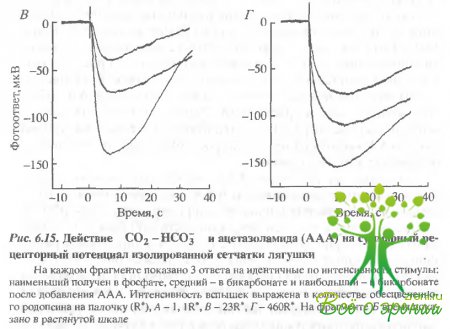
Бикарбонат и AAA увеличивают фотоответы. Влияние бикарбоната. Чтобы продемонстрировать влияние внутриклеточной концентрации бикарбоната на фотоответ зрительной клетки в растворе, содержащем вначале 12 мМ фосфатного буфера, 6 мМ фосфата замещалось на 6 мМ бикарбоната. Как показано выше, такая манипуляция должна приводить к возрастанию внутриклеточного рН, хотя экстраклеточный рН и буферная емкость по Н+ не изменялись. На рис. 6.15 приведены фотоответы зрительных клеток сетчатки лягушки.
Под обозначениями А, Е и Г приведены группы из трех ответов на стимулы одинаковой интенсивности: А — низкой, В - средней и Г— высокой. Наименьший ответ был зарегистрирован при перфузии фосфатом без бикарбоната. Как только перфузирующий раствор заменяли на раствор Рингера, содержащий бикарбонат, ответ начинал расти. Средний ответ под каждым обозначением был зарегистрирован примерно через 15 мин после замены перфузирующего раствора. OTRCT, близкий к насыщающему СО- возрастал на 40%. Однако ответы, зарегистрированные при низкой интенсивности (А), возрастали относительно больше, что указывало на увеличение относительной чувствительности фоторецепторов.
Влияние AAA Добавление 0,5 мМ AAA в перфузат в присутствии карбоната приводило к ускорению и увеличению ответа как на слабые, так и на яркие вспышки. На рис. 6.15 наибольший ответ во всех четырех случаях был получен в присутствии AAA. Добавление AAA увеличивало максимальную амплитуду в данном случае в 1,4 раза (в различных экспериментах от 1,1 до 2,0), а фоточувствительность - в 1,6 раза (в различных экспериментах 0.8-3,6). Существенно отметить, что увеличение всегда зависело от интервала между заменой фосфата на бикарбонат и последующим добавлением ААА.
Увеличение ответов не обусловлено глиальными токами. Как известно, существенный вклад в суммарные рецепторные фотоответы, регистрируемые в сетчатке, вносят радиальные токи нефоторецепторного происхождения. Можно было бы предположить, что увеличение фотоответов, полученное в присутствии бикарбоната и ААА, на самом деле отражают не рост фототока палочки, а скорее увеличение вторичных токов (в основном глиального происхождения).
Чтобы выявить эту возможность, фазы нарастания насыщающих ответов (см. рис. 6.15, Б) показаны в растянутых временных шкалах. Поскольку синаптическая передача блокирована, то нерецепторные токи, вызванные ионными токами, сопровождающими фоторецепторный ответ, могут давать вклад в фотоответ только после существенной задержки. Однако амплитуды трех ответов возрастают одинаково как в ранней фазе, так и в пике ответа (рис. 6.15, Б и Г). Можно отметить, что в начальный момент возрастание даже больше.
Кинетика фотоответов ускоряется в присутствии AAA Известно, что как фотоответы палочек на очень слабые вспышки, так и кинетика их нарастания на сильные вспышки, линейно зависят от интенсивности стимула. Если бы кинетика фотоответов не изменялась в присутствии бикарбоната и AAA, то семейство ответов на рис. 6.15 отражало бы увеличение абсолютной чувствительности палочек. На самом деле амплитуда фоте ответов в присутствии AAA в шесть раз больше, чем в фосфатном буфере, а ответ на сильные вспышки возрастает в 10 раз. Это означает, что как бикарбонат, так и AAA вызывают не только рост амплитуды фотоответа, но и приводят к его ускорению.
Зависимость действия AAA от бикарбонатного режима. Сходное влияние бикарбоната и AAA позволяет полагать, что механизм их воздействия одинаков (например, модуляция рН). Это подтверждается и тем, что эффективность действия AAA зависела от предыстории эксперимента. Если AAA добавляли в раствор Рингера, который с самого начала не содержал бикарбоната, эффекты были меньше или вообще отсутствовали (4 эксперимента в фосфатном буфере и три - в HEPES). Если же AAA добавляли в раствор Рингера, содержащий бикарбонат, некоторое увеличение амплитуды фотоответа наблюдалось во всех случаях, но величина этого эффекта была тем меньше, чем больше времени проходило между добавлением в раствор бикарбоната и AAA. Если сетчатка перфузировалась в содержащем бикарбонат растворе Рингера более 6 мин, то изменения, вызываемые AAA, были малы.
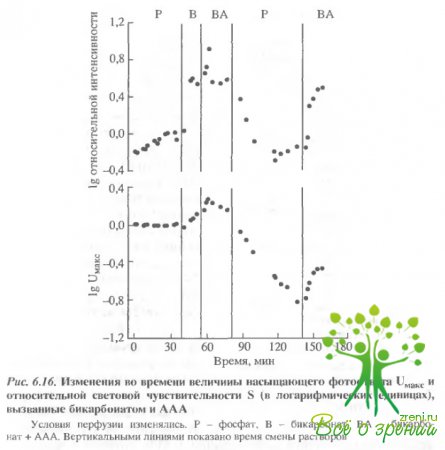
Наиболее примечательным явилось то, что и увеличение концентрации бикарбоната, и добавление ААА действовало, по- видимому, по одинаковому механизму. Во всяком случае, уровень "насыщения эффекта" достигался в обоих случаях через 20 мин. На рис. 6.16 представлены изменения во времени величин фото- ответов при добавлении бикарбоната и AAA.
Частичное замещение фосфата (Р) бикарбонатом (В) приводило к постепенному росту как максимальной амплитуды фотоответа, так и относительной чувствительности к новому стационарному уровню. Добавление через 17 мин AAA приводило к сильному увеличению обоих параметров (Uмакс и S), однако эффект носил переходный характер. Эффект AAA, представленный на рис. 6.15, получен в точке максимального увеличения амплитуды. Переключение с фосфатного раствора Рингера на бикарбонатный приводило к возвращению относительной световой чувствительности к первоначальному уровню, тогда как амплитуда фотоответа продолжала монотонно падать. Последующее включение Рингера, содержащего бикарбонат и ААА, приводило к частичному восстановлению максимальной амплитуды фотсответа. Даже в тех экспериментах, в которых эффект бикарбоната и/или AAA были очень мал, последующее переключение на фосфатный буфер всегда приводило к изменению амплитуды фотоответа, а последующее переключение на бикарбонат-AAA приводило к восстановлению. В большинстве экспериментов восстановление Uмаксбыло более полным, чем это показано на рис. 6.16.
Бикарбонат и AAA увеличивают концентрацию цГМФ в наружных сегментах палочек. Чтобы понять возможный механизм действия бикарбоната и AAA, в дальнейшем исследовалось их влияние на концентрацию внутриклеточного медиатора в фоторецепторах - цГМФ. Эксперименты проводились в соответствии с протоколом, описанным в таблице. Каждая топка соответствовала измерениям на 6 сетчатках. Среда инкубации в данном случае была идентична той, которая была в электрофизиологических экспериментах.
Как оказалось, влияние AAA на уровень цГМФ хорошо корретирует с результатами, полученными в электоро-физиологических экспериментах. В фосфатном Рингере добавление AAA вызывало небольшое увеличение концентрации цГМФ (которое в представленных данных статистически недостоверно). Замена фосфата на бикарбонат, однако, приводила порез 15 мин к 50%-ному увеличению уровня г1 МФ, а введение AAA в бикарбонатный Рингер повышало его в 3-4 раза (делая его в 6 раз выше, чем в фосфатном контроле). Для контроля в некоторых экспериментах сетчатку инкубировали с ингибитором фосфодиэстеразы - ИБМК - в течение 30 мин. В палочках, обработанных ИБМК, концентрация гГМФ была в 7 раз выше контроля.
Эти результаты прямо указывают на то, что как бикарбонат, так и AAA прямо или опосредовано воздействуют на механизмы фототранедукции в фоторецептсрах. Наблюдается хорошая количественная корреляция с действием бикарбоната в электрофизиологи 1еских экспериментах. Однако увеличение концентрации цГМФ при действии AAA оказалось несколько больше, чем э го- го следовало бы ожидать из измерений фотоответа. Возможные причины такого расхождения будут рассмотрены в соответствующем разделе обсуждения.
Бикарбонат и ААА прямо не влияют но фототрансдукцию. В дальнейшем исследовалось, обусловлены ли наблюдаемые эффекты прямым действием С02- НСО3и ААА на фототрансдукцию палочки. Для этого эксперимент и, аналогичные описанным выше, проводили на изолированных палочках, когда опосредованное влияние других структур сетчатки исключено. Для регистрации использовали палочки тигровой саламандры, так как регистрацию на них проводить легче, чем на палочках.
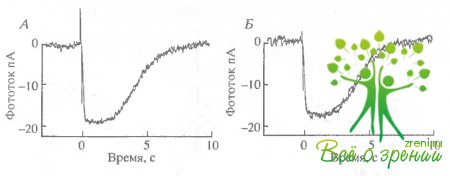
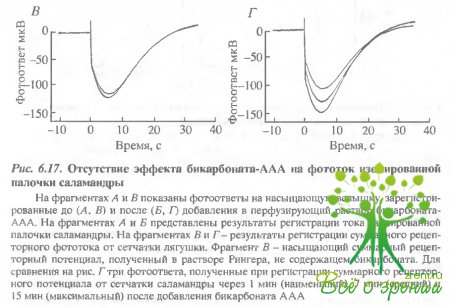
На рис. 6.17, Л приведены два отлета, полученные до введения ААА-бикарбоната, на рис. 6.17, Б - зарегистрированные после замены раствора, причем, Еторой ответ - в тот момент времени, когда ожидался максимальный эффект.
Очевидно, что существенных изменений в темновом токе не происходило. Более детальное изучение самой ранней фазы фотоответов также не выявило никаких изменений чувствительности (см., например, рис. 6.15, Б).
Для сравнения в нижнем ряду (рис. 6.17, В и Г) приведены соответствующие серии насыщающих ответов от ингактной сетчатки тигровой саламандры, зарегистрированные тем же методом регистрации ЭРГ, что и в экспериментах с лягушками. Результаты оказались такими же, как и описанные ранее. И бикарбонат, и AAA вызвали обратимое увеличение фотоответов. Таким образом, отсутствие эффекта на изолированных палочках объясняется не видовыми различиями между лягушками и саламандрами. Эти эксперименты прямо показывают, что эффект AAA не обусловлен прямым действием на фото- трансдукцию в палочках. Этот отрицательный результат не представляется удивительным, учитывая, что карбоангидраза не обнаружена в палочках. В биохимических экспериментах мы прямо проверили также, что AAA не влияет на фотоиндуцированный гидролиз цГМФ in vitro.
ДИДС полностью подавляет световую чувствительность, Естественно предположить, что действие бикарбоната и AAA обусловлено работой НСО3/Сl-обменника, обнаруженного нами и описанного в предыдущих разделах. Прямое действие ДИДС на ток изолированных фоторецепторов было подробно описано нами ранее. Здесь мы опишем действие ингибитора НСО3/Сl -обмена ДИДС на эффект AAA.
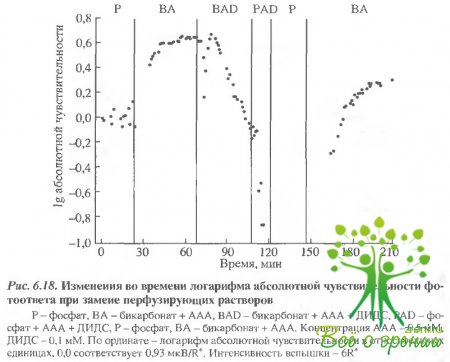
На рис. 6.18 представлены результаты типичного эксперимента. После стабилизации ответов в фосфатном Рингере про ток переключался на бикарбонат-AAA.
Это приводило к четырехкратному увеличению фотоответа. Когда фотоответ достигал нового стационарного уровня, в проток вводился 0,1 мМ ДИДС. Это приводило к быстрому и монотонному уменьшению фотоответа. Последующая замена в растворе бикарбоната на фосфат еще более ускоряла этот процесс, и фотоответ падал практически до нуля. Примерно на 120-й минуте стимул с интенсивностью 10000 R* вызывал ответ по амплитуде в 100 раз меньше первоначального.
Эффект ДИДС оказался обратимым. Через 35 мин после переключения протока на раствор, содержащий бикарбонат-ААА, величина фотоответа была в два раза больше, чем в фосфатном буфере в начале эксперимента.
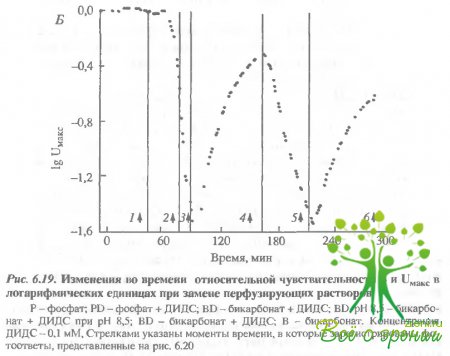
Эффект ДИДС зависит от рН. Эксперименты, представ ленные на рис. 6.19 и 6.20, демонстрируют прямую связь между эффектом ДИДС и изменениями рН. В эксперименте, показанном на рис. 6.19, а, добавление ДИДС в раствор Рингера, содержащий фосфатный буфер, приводило к уменьшению фотсответа, причем последующая замена фосфата на бикарбонат не приводила к его восстановлению. Затем в момент времени, когда амплитуда фотоответа падала до 5% своего первоначального уровня, рН протока изменялся на 1 единицу так, что его величина становилась 8,5. Это приводило к монотонному росту фотоответа в течение часа. Последующее уменьшение рН на 1 единицу (до 7,5) вновь приводило к уменьшению величины фотоответа.
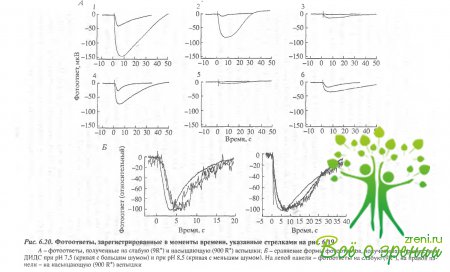
На рис. 6.20 представлены шесть пар фотоответов, полученных в одни и те же моменты времени, отмеченные стрелками на рис. 6.19, Каждая пара содержит фотоответ на слабую (9 R*) и на насыщающую (900 R*) вспышки.
Время достижения максимальной амплитуды и максимальная амплитуда на кривых, показанных на рисунке, были соответственно 3,6 и 38 мкВ (1 - фосфат), 4,5 с и 8 мкВ (2 - фосфат ДИДС), 5,5 с и 1,5 мкВ (3 бикарбонат - ДИДС), 3 с и 25 мкВ (4 - бикарбонат - ДИДС, рН 8,5), 4,7 с и 8 мкВ (6 - бикарбонат). В принципе, измерение кинетики фотоответов при регистрации суммарного рецепторного потенциала не совсем корректно. Тем не менее рис. 6.20 демонстрирует, что время достижения максимума отражается с помощью этой методики достаточно хорошо. Сравним фотоответы, полученные в ДИДС, при рН 7,5 и 3,5. Фотоогвет с большей амплитудой должен был бы нарастать быстрее. Тем не менее, если мы сравним кинетику "щелочного" и "кислого" ответов на рис. 6.20. где амплитуды отнормированы. то увидим, что "щелочной" ответ нарастает медленнее. Суммируем изложенные выше результаты:
Стационарное значение внутриклеточного рН. Среднее значение внутриклеточного рН в фоторецепторе при внеклеточном рН 7,5 составило в наших экспериментах 6,68. Это довольно низкое значение для возбудимых клеток. Однако величины внутриклеточного рН в различных тканях сильно различаются. Так, Schwiening и Baron [1994] обнаружили, что среднее значение рН в нейронах гиппокампа составило 6,61 в отсутствие бикарбоната, а в присутствии бикарбоната эта величина возрастала до 7,1. В то же время Raley-Susman et al. [1993] показали на тех же нейронах, что внутриклеточный рН составляет 7,76 в присутствии 25 мМ бикарбоната и рН 7,4.
По крайней мере три фактора могли влиять на низкую величину рН в наших экспериментах. Во-первых, сетчатки были обесцвечены, и это могло влиять на внутриклеточный рН по нескольким причинам. Во-вторых, фоторецепторы были не изолированы, а находились в сетчатке и, следовательно, под воздействием кислого окружения соседних фоторецепторов и других клеток сетчатки. В-третьих, значение внутриклеточного рН 6,68 было получено в среде, не содержащей бикарбоната. Добавление 6 мкМ бикарбоната увеличивало рН на 0.26 единицы. In vivo концентрация бикарбоната в крови саламандры составляет 20-25 мМ. Таким образом, можно полагать, что в нативных условиях величина рН в фоторецепторе выше.
Роль регуляции рН в работе фоторецептора. Как указывалось выше, фоторецептор находится в условиях постоянного закисления вследствие протекающих в нем метаболических процессов, происходящих как во внутреннем, так и в наружном сегменте. Поэтому основная функциональная роль описанных нами процессов состоит в предотвращении ацидоза клетки. По крайней мере два из обнаруженных нами механизмов используют для этого натриевый градиент, существующий на мембране фоторецептора, это Na+/H+-oбиен и Ка+-зависимый НС03/С1 -обмен.
Третий из обнаруженных нами механизмов – натрий-независимый, и именно это обстоятельство - присутствие в клетке двух механизмов, работающих в противоположном направлении, и может, по-видимому, наилучшим образом обеспечить в клетке оптимальный гомеостаз по рН.
Наблюдаемые нами изменения тока в фоторецепторе обусловлены изменениями внутриклеточного рН, Известно, что во многих типах клеток ДИДС и амилорид блокируют Nа+/Н+-обмен и НС03/Сl-обмен. Эти же соединения вызывали соответственно закисление и в наших экспериментах при измерении внутриклеточного рН. Таким образом, есть веские основания полагать, что и в описанных в этом разделе экспериментах, когда на внутренний сегмент клетки воздействовал ДИДС или амилорид, фототек изменялся вследствие внутриклеточного закисления. Существенно отметить, что во всяком случае в отношении ДИДС эффект вызывался именно закислением внутри внутреннего сегмента, а не изменением рН во внешнем сегменте. Это утверждение базируется на том, что при ацидозе во внешнем сегменте как темнэвой ток, так и насыщающий фотоответ изменяются одинаково.
При различных воздействиях на фоторецепторную клетку наружный и внутренний сегменты реагируют по-разному Это позволяет предположить, что, по крайней мере с точки зрения регуляции рН, эти две части клетки представляют собой относительно независимые образования, разделенные сильным диффузионным барьером Существование такого барьера вытекает из нескольких морфологических и физиологических свойств зрительной клетки: плотность дисков и малое расстояние между дисками и плазматической мембраной клетки, различные процессы, вызывающие внутриклеточное закисление и т.д. Ниже более подробно изложены причины, которые могут служить базисом для такого предположения.
Внутриклеточное закисление во внутреннем сегменте. Во внутреннем сегменте причиной внутриклеточного закисления являются интенсивные метаболические процессы, и блокирование механизмов экстракции Н+ амилоридом и ДИДС вызывает внутриклеточный ацидоз Эксперименты, проведенные с амилоридом при низком содержании кальция, свидетельствуют, что амилорид изменяет именно внутриклеточный рН, а не внутриклеточную концентрацию кальция Интерпретация нескольких экспериментов позволяет нам предположить, что регуляция рН во внутреннем сегменте относительно независима от наружного, и что изменение фототека обусловлено изменением рН именно в этой части клетки.
1. При перфузии внутреннего сегмента темновой ток может практически не изменяться при воздействии амилорида и ДИДС, в то время как фоточувствительность клетки практически полностью исчезает. При перфузии НС внутриклеточный ацидоз приводит к исчезновению как темнового тока, так и фоточувствительности.
2. Изменения внеклеточного рН при перфузии внутреннего сегмента должны приводить по крайней мере к кратковременным изменениям во внутриклеточном рН, если имеет место диффузия между двумя частями клетки. Соответственно должен был бы измениться и внутриклеточный рН в наружном сегменте. Однако фоточувствптельность НС при изменении внеклеточного рН около внутреннего сегмента не изменялась и, следовательно, можно полагать, что внутриклеточный рН в наружном сегменте также не изменялся.
3. Действие как ДИДС. так и амилорида при перфузии внутреннего сегмента происходит с большой задержкой, в то время как изменение рН в наружном сегменте происходят практически мгновенно.
Как амилорид, так и ДИДС при перфузии внутреннего сегмента вызывают медленное (в минутной шкале) уменьшение фотоответа. Одним из возможных объяснений этого может служить ингибирование метаболических процессов во внутрегаем сегменте, которые, как известно, ингибируются при внутриклеточном закислении. Уменьшение концентрации ГТФ или АТФ может воздействовать на процесс фототрансдукции, подавляя активацию трансдуцина или фосфорилирование родопсина. Поскольку темновой ток при этом не изменяется, можно полагать, что концентрация цГМФ также мало изменяется. Поскольку Кд активации трансдуцина меньше, то уменьшение концентрации ГГФ в первую очередь повлияет именно на световую чувствительность клетки.
То обстоятельство, что темновой ток остается практически неизменным, говорит о том, что не изменяется натриевый градиент и соответственно ни ДИДС, ни амилорид не влияли существенно на активность Na+- К+-АТФазы.
Механизмы транспорта То, что амилорид и ДИДС независимо могут приводить к потере световой чувствительности, свидетельствует о том, что для поддержания оптимального внутриклеточного рН необходимы как Na+/H+-, так и НСО3/Сl -обмен. Обычно активность обмена в клетках регулируется различными факторами. В нашем случае относительная активность может определяться не только общей метаболической активностью в клетке, но и соотношением анаэробных и аэробных путей и соответственно соотношением лактата и С02. Тот факт, что во внутреннем сегменте в определенных условиях внутриклеточный рН может поддерживаться даже в присутствии 2 мМ амилорида, совпадает с опубликованными ранее данными о том, что амилорид в этой концентрации существенно влияет на фотоответ, но не приводит к его полному исчезновению.
В физиологических условиях транспорт бикарбоната может играть более существенную роль, чем в наших экспериментах. Так, содержание бикарбоната в крови саламандры составляет 29-25 мМ, что примерно в 4 раза выше, чем в наших экспериментах. Тот факт, что ингибирование НСО3/Сl ДИДС всегда приводит к внутриклеточному закислению, свидетельствует о том, что транспорт бикарбоната в ВС сопряжен с градиентом Na+. О том же говорит то, что замена хлора на бикарбонат при перфузии ВС мало влияет на фоточувствительный ток.
Регуляция рН в наружном сегменте. Основной причиной, вызывающей внутриклеточное закисление в наружном сегменте, является процесс синтеза и гидролиза цГМФ. Поскольку наружный и внутренний сегменты фоторецептора пространственно разделены, поглощение эквивалентного количества Н+ во внутреннем сегменте не повлияет на этот процесс. Темновой ток в НС быстро подавляется при внутриклеточном закислеяии и по крайней мере кратковременно возрастает при внутриклеточном защелачивании Ниже обсуждаются основные факторы, вовлеченные в этот процесс.
Обмен бикарбоната Увеличение фотоответа при перфузии НС ДИДС является по всей вероятности результатом соответствующего внутриклеточного защелачивания. То, что это есть результат ингибирования натрий-зависимого НСО3/Сl -обмена, подтверждается тем, что темновой ток возрастал при замене хлора на глюконат. Как было показано нами в предыдущем разделе, это приводит к инверсии HCO3/Cl -обмена и внутриклеточному защелачиванию. ДИДС не полностью ингибировал этот процесс, однако это может объясняться двумя причинами. Во-первых, замена 95 мМ С1- может создавать такой мощный градиент хлора, что даже если небольшая часть НСО /СГ остается незгингибирован- ной ДИДС, это может обеспечить некоторую защиту от ацидоза. Во-вторых, рН-зависимость тока палочки довольно крутая.
То, что ДИДС при перфузии НС никогда не снижает фототока, свидетельствует против того, что в НС присутствуют другие, сопряженные с натрием, процессы, которые закачивали бы бикарбонат внутрь клетки Ингибирование таких процессов приводило бы к ацидозу.
Na+/H+-обмен. То, что ингибирование НС03/Сl -обмена ДИДС приводит к защелачиванию, свидетельствует о том, что рН в НС поддерживается несколько выше термодинамического равновесия механизмом, сопряженным с градиентом натрия. Естественно было предположить, что таким механизмом является Na+/H+- обмен. Уменьшение фотоотзета и темнового тока при перфузии НС амилоридом в значительной степени обусловлено именно этой причиной, хотя нельзя исключить и вклад других процессов (ингибирование Na+/Ca2+ обмена или прямого действия на цГМФ- регулируемые ионные каналы).
Механизм воздействия рН на фотоответ. Можно представить себе много путей прямого воздействия рН на механизмы фототрансдукции. Перечислим те возможности, подтверждение которым можно найти в литературе:
- Na+[/sup]/Ca2+[/sup]ослабляется при понижении рН, что ведет к увеличению внутриклеточной концентрации кальция и таким образом уменьшает фототок;
- проводимость плазматической мембраны фоторецептора уменьшается вдвое при снижении рН до 5,5;
- наиболее вероятным нам представляется вовлеченность в этот процесс гуанилатциклазы. Активность гуанилациклазы рН-зависима, причем, при увеличении рН активность возрастает, что соответствует знаку описанного нами эффекта. Вполне вероятно, что при изменении рН существенными становятся сразу несколько факторов.
Функциональная роль HCO3/Сl- и Na+/Н+-обменников в наружном сегменте. Естественно предположить, что существование в одной мембране обоих типов обменников необходимо для более тонкого поддержания гомеостаза или для контроля клеточного объема. Если речь идет о регуляции рН, то обменники работают в противоположном направлении так, что Na+/H+ стремится поддерживать рН выше термодинамического равновесия, а НСО3/Сl восстанавливает его. В НС фоторецепторной клетки такой механизм может эффективно предотвращать как ацидоз, так и внутриклеточное защелачивание клеток, поддерживая оптимальное значение рН. С другой стороны, при наличии механизма регуляции обмена изменения внутриклеточного рН могут быть фактором, регулирующим чувствительность фоторецепторной клетки.
Транспорт СО; в Мюллеровских клетках и влияние AAA. Ингибирование карбоангидразы (КА) в изолированной сетчатке приводит к более кислому стационарному состоянию во внутреннем объеме сетчатки. Это позволяет предположить повреждение системы удаления С02-НС0,-Н. В нашей геометрии удаление С02 может происходить только на рецепторной стороне сетчатки, около наружных сегментов палочек. Поэтому следовало бы ожидать, что ингибирозание КА приведет к
1) образованию С02-НС03 –Н+ в сетчатке;
2) уменьшению концентрации Н+ (подщелачиванию) около наружного сегмента. Это уменьшение может быть кратковременным, хотя в стационаром состоянии все метаболические кислоты, образованные в сетчатке, будут проходить один и тот же путь независимо от того, является ли транспорт активным.
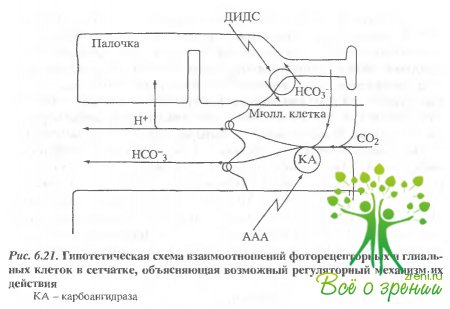
На рис. 6.21 представлена гипотетическая схема, учитывающая возможную роль Мюллеровских клеток в транспорте СО2-НСО3-Н+ в сетчатке. Гипотеза основана на двух фактах.
Во-первых, Мюллеровские клетки содержат большую часть КА сетчатки. Во-вторых, они морфологически близки к астроцитам мозга, которые, по-видимому, участвуют в удалении метаболического С02 из нейронов, утилизируя его в другом месте через НСО3/Сl- и Na+/Н+-обменники.
Предполагаемое высвобождение H+—HCO, Мюллеровскими клетками приведет к созданию эффективного внешнего градиента для этих ионов и для С02. Эффективность транспорта будет зависеть от катализируемого КА быстрого равновесия в бикарбонатной буферной системе. Предложенная схема, таким образом, указывает две возможные причины роста фотоответов при введении AAA:
- концентрация НСО повышается вблизи проксимальной части палочек, где находятся бикарбонатные об- менники, которые увеличивают концентрацию этого иона в клетке;
- концентрация Н+[/sup]вблизи наружного сегмента палочки уменьшается, снижая закисление внутри клетки. Оба процесса приведут к увеличению рН и оценить их относительный вклад сложно.
Корреляция между амплитудой ответа и концентрацией цГМФ. Изменения в фогоответах, наблюдаемые при действии бикарбоната и AAA, качественно хорошо коррелировали с изменениями общей концентрации цГМФ (см. таблицу). Наблюдаемое увеличение концентрации ц1 МФ обусловлено тем, что бикарбонат и AAA нейтрализуют подкисление палочек. Известно, что увеличение концентрации HEPLS и/или бикарбонатного буфера в интервале между 1 и 5 мМ примерно вдвое увеличивает концентрацию ц1 МФ в сетчатках жабы. Поскольку низкая буферная емкость сопровождается подкислением сетчатки, можно заключить, что концентрация цГМФ уменьшается при подкислении. Интересно, что в этой работе не обнаружили влияния буферов на содержание цГМФ в изолированных инкубированных НСП; это подтверждает наше предположение о том, что подкисление обусловлено прежде всего накоплением кислот в ткани интактной сетчатки.
Не следует ожидать строгой количественной корреляции между величиной фототока (выраженного как амплитуда насыщающего ответа) и концентрацией цГМФ. Натриевая проводимость НСП определяется свободной цГМФ, тогда как наши биохимические методы позволяют измерять общую цГМФ. Однако следует отметить очень высокую концентрацию цГМФ в присутствии AAA (см. таблицу) по сравнению со средние ростом фотоответов. Одним из объяснений может быть то, что сетчатки, инкубированные в биохимических экспериментах, были полностью погружены в среду. Если AAA блокирует прямой транспорт С02-НС03-Н на рецепторную сторону, то эти вещества в этом случае будут одинаково диффундировать к обеим сторонам сетчатки. Напротив, в соответствии с геометрией электрофизиологического эксперимента AAA может приводить только к кратковременному увеличению кислотного потока около фоторецептора (см. выше).
Многие процессы в фоторецепторах обусловлены рН. В наших экспериментах при пощелачивании происходило увеличение, а при подкислении - уменьшение как относительной чувствительности и амплитуды насыщающего ответа, так и скорости нарастания фотоответов. Это отчасти противоречит данным Liebman et al. [1984], которые нашли, что при перфузии кислым раствором происходит уменьшение насыщающего ответа, но увеличение относительной чувствительности. Однако их эксперименты отличались от наших тем, что включали кратковременные изменения рН (менее 1 мин;; можно предположить, что эффект рН на фототранедукцию внутри палочки не полностью развился из-за недостатка времени. Даже полученное нами и на первый взгляд сходное влияние рН на амплитуду насыщающего ответа отличается от результатов. Они нашли, что при низких рН происходит быстрое подавление темнового тока, заканчивающееся за 1 с, и не происходит немедленных изменений быстрой фазы нарастания ответа. Эти данные были интерпретированы как задержка Nа+/Са2+-обмена, приводящего к накоплению Са2+ в палочке. Напротив, наши эффекты развиваются в минутной временной шкале, включая изменения кинетики нарастания ответов и существенные изменения суммарной концентрации цГМФ.
Статья из книги: Молекулярные механизмы зрительной рецепции | Каламкаров Г.Р., Островский М.А..





Комментариев 0