Особенности фармакокинетики препаратов, применяемых для лечения заболеваний глаз │ Часть 2

Содержание:
Описание
Коэффициент очевидного удаления (А) характеризует скорость удаления вещества из организма во время фазы элиминации.Коэффициент очевидного всасывания (В) характеризует скорость всасывания вещества во время фазы абсорбции.
Коэффициент скорости потери препарата из передней камеры в кровь (k0) можно определить, зная коэффициент очевидного удаления (А), объемы роговицы (Vc) и передней камеры (Va), а также коэффициент gac который равен отношению концентрации вещества в роговице к его концентрации в передней камере (Сс/Са). когда наблюдается линейное параллельное уменьшение концентраций.
В системной фармакокинетике для определения коэффициента очевидного удаления используют коэффициент сдвига - b, определяемый методом наименьших квадратов.
где X и Y — значения, соответствующие независимой (время) и зависимой (концентрация) переменных; n — количество членов выборки (проб).
Коэффициенты очевидного удаления связаны с коэффициентом сдвига следующей функцией:
где ln — функция, обратная логарифму.
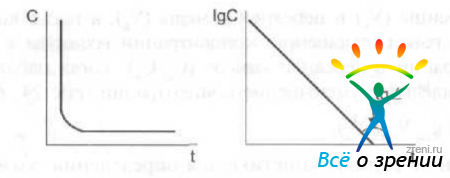
Кроме того, коэффициент потери лекарственного препарата из передней камеры можно определить графически, так как он равен тангенсу угла наклона кривой зависимости натурального логарифма концентрации от времени к оси абсцисс (рис. 26).
Рис. 26. Схема графического способа определения коэффициента потери лекарственного препарата из передней камеры.
Коэффициент скорости переноса препарата из роговицы в переднюю камеру относительно объема роговицы выражается следующей формулой:
где rса — значение отношения концентрации препарата в роговице к его концентрации в передней камере (Ct / Са) в момент времени, когда скорость уменьшения концентрации вещества в роговице равна нулю (dCc / dt = 0). Для простых растворов rса =0,75 (данная величина определена экспериментально). Если препарат способен растворяться в эпителии, то это значение увеличивается.
Коэффициенты обмена между роговицей и передней камерой относительно их объема взаимосвязаны:
В табл. 7
Таблица 7. Фармакокинетические параметры, описывающие обмен между роговицей и влагой передней камеры (данные экспериментальных исследований).
представлены величины описанных коэффициентов, полученные экспериментальным путем, для некоторых лекарственных препаратов.
В рассматриваемой модели кинетика препарата будет зависеть не только от описанных выше коэффициентов, но и проницаемости роговицы относительно слезы (Pdc) и относительно передней камеры (Рас). Эти параметры выражаются в см*ч-1.
Проницаемость роговицы относительно слезы характеризует силу сопротивления эпителия диффузии препарата. Ее можно определить, зная общее количество вещества, проникшего через роговицу в переднюю камеру (m0), площадь роговицы (Qc) и площадь под кривой зависимости концентрации препарата в слезе от времени (Ud).
где СA - точка пересечения кривой функции e -At с осью ординат (см. рис. 22 б).
Проницаемость слезы относительно передней камеры характеризует силу сопротивления стромы и эндотелия. Она прямо пропорциональна коэффициенту скорости обмена между роговицей и передней камерой относительно объема роговицы:
где qc - толщина роговицы.
Если
В табл. 8
Таблица 8. Величины проницаемости роговицы, полученные в эксперименте (по данным D. M. Maurice, S. Mishima)
указаны величины проницаемости роговицы, которые были определены экспериментальным путем.
Анализ данных, представленных в табл. 7 и 8, подтверждает ранее сделанный вывод о связи проницаемости эпителия с растворимостью препаратов в липидах. Об этом свидетельствует широкий диапазон значений проницаемости эпителия, которые значительно отличаются для липофобных соединений (флюоресцеин, аминогликозиды) и липофильных веществ (хлорамфеникол, стероиды).
Другое заключение, к которому приводят данные табл. 8, это то, что у человека эпителий является более значимым барьером, чем у кролика.
В начале главы было сказано, что некоторые фармакокинетические параметры можно определить по биологической реакции тканей глаза на активные компоненты.
Обычные фармакокинетические модели описывают концентрацию препарата как функцию дозы и времени. В противоположность им фармакодинамические модели независимы от времени и отражают связь между концентрацией и эффектом.
Так как фармакологический эффект воздействия препарата на организм количественно зависит от введенной дозы, то кривая биологической реакции может отражать поведение кривой изменения концентрации лекарства в ткани. Таким образом, фармакокинетика данного лекарства может быть проанализирована на основании биологической реакции, которую оно вызывает.
Осуществить данный анализ возможно при соблюдении некоторых условий:
- точная связь «доза—реакция» может быть получена при использовании изолированных образцов тканей;
- доступны методы точного измерения эффекта «на живом организме»;
- могут быть подвергнуты сравнению связь «доза—реакция», полученные как в лабораторных условиях, так и «на живом организме».
Для фармакокинетического анализа особенно подходит реакция внутриглазных мышц — миоз, мидриаз, циклоплегия. Может быть использована динамика внутриглазного давления или чувствительности роговицы, так как эти параметры можно измерить «на живом организме».
[banner_centerrs] {banner_centerrs} [/banner_centerrs]
Различными учеными (Levy, 1964; Schoenwald Smolen, 1971; Yoshida Mishima, 1975; Mishima, 1981; Ohara, 1977) в эксперименте была выявлена линейная связь между изменением ширины зрачка и введенной концентрацией препарата. Эта связь имеет следующее выражение:
где R, - коэффициент реакции тканей, С - концентрация, соответствующая данной реакции, s — коэффициент пропорциональности.
Коэффициент реакции ткани (R1) можно рассчитать, зная значение максимальной реакции ткани (Rmax) и значение реакции ткани при данной концентрации (R):
Известно, что при закапывании миотического средства минимальный диаметр зрачка равен 1 мм, а при использовании мидриатического средства максимальный диаметр зрачка равен 8.5 мм.
Обозначив диаметр зрачка до ввода лекарственного препарата как D0 , а после его закапывания как D, можно выразить значение R и Rmax для миотического средства следующим образом:
Для мидриатического средства:
Подставив описанные выше значения в формулу 12.2, получим, что коэффициент реакции в случае миотического средства равен:
В случае мидриатического средства:
Аналогично уравнениям коэффициентов миотической и мидриатической реакций можно получить уравнения для оценки циклоплегического, гипотензивного и других эффектов.
↑ Особенности кинетики лекарственных препаратов при субконъюнктивальной, парабульбарном и интравитреальном введении
После субконъюнктивальной инъекции часть лекарства через инъекционное отверстие попадает в конъюнктивальный мешок и из слезы через роговицу проходит в переднюю камеру. Однако количество вещества, проникающего в переднюю камеру после регургитации, у человека незначительно.
Из подслизистого депо, которое образуется в зоне инъекции, лекарственный препарат частично попадает в системный кровоток через сосуды, окружающие зону инъекции.
Основная доля препарата путем диффузии проникает в склеру, а далее в плоскую часть цилиарного тела, радужку и стекловидное тело (через плоскую часть цилиарного тела). Большая часть лекарства попадает во внутриглазную жидкость через область угла передней камеры. В зоне лимба вещество проникает в строму роговицы и далее поступает в переднюю камеру или непосредственного проникает в структуры, расположенные в этой области (трабекулярная ткань). Проникновение вещества в строму роговицы в зоне лимба можно проследить после субконъюнктивальной инъекции флуоресцеина при помощи щелевой лампы.
После субконъюнктивальной инъекции красителя значительное окрашивание влаги передней камеры заметно через 15 мин. Оно достигает своего максимума через 1—2 ч, а затем происходит уменьшение с коэффициентом скорости элиминации примерно равным 0,4 ч-1 (Maurice, Ota, 1978). Следует отметить, что концентрация препарата в подслизистом депо быстро падает и уже через 1 ч она составляет лишь одну сотую той, что была во введенном растворе (Conrad, Robinson, 1980).
После парабульбарной инъекции депо расположено ближе к заднему полюсу глаза, поэтому основной путь распространения препарата — это диффузия через склеру в сосудистую оболочку, и далее через плоскую часть цилиарного тела вещество проникает в стекловидное тело. Небольшая часть вещества, попавшая в эпителий цилиарных отростков, вместе с новообразованной жидкостью достигает передней камеры. В отличие от субконъюнктивальной инъекции лекарственное вещество практически не попадает в роговицу. При гистологическом анализе глазных яблок людей, которым перед энуклеацией делали парабульбарную инъекцию флуоресцеина, обнаружено окрашивание склеры и хориоидеи, а также цилиарной мышцы и стромы цилиарных отростков (Miyake, Ontsuki, 1981). Наблюдения глазного дна in vivo показали, что внутрь стекловидного тела попадает краситель.
После введения в стекловидное тело диффузия препарата неограничена, даже в том случае, если вещество имеет большой молекулярный вес. Это отсутствие замедления диффузии веществ в стекловидном теле обусловлено низкой концентрацией (0,01%) в нем коллагена. Поэтому вещество, введенное непосредственно в стекловидное тело, равномерно распределяется по всему объему.
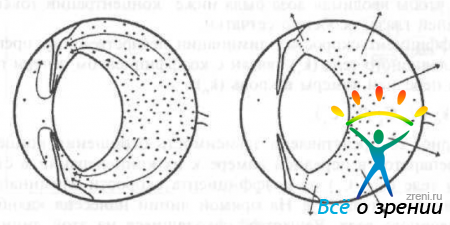
Лекарственное вещество элиминируется из стекловидного тела двумя путями: первый — через переднюю гиалоидную мембрану в заднюю камеру, а оттуда вместе с внутриглазной жидкостью по путям оттока препарата покидает глазное яблоко, и второй - через поверхность сетчатки (рис. 27).
Рис. 27. Схема элиминации лекарственных препаратов из стекловидного тела (по данным D. M. Maurice, S. Mishima).
В случае отсутствия возможности выхода через поверхность сетчатки препарат может покинуть стекловидное тело только через переднюю камеру.
Барьер между веществами, находящимися в стекловидном теле и сетчаткой, состоит из капилляров сетчатки и внутренней глиальной пограничной мембраны. Он непроницаем для веществ, обладающих большим молекулярным весом, таких как альбумин, но не мешает прохождению малых ионов. Кроме того, для некоторых веществ существуют активные транспортные механизмы (йодид, йодопирацет, флюоресцеин, простагландин Е, индометацин). В случае насыщения или блокирования этих механизмов скорость элиминации значительно замедляется. Это обусловлено тем, что скорость удаления веществ из стекловидного тела через сетчатку намного превышает их потерю через переднюю камеру.
Например, скорость удаления флюоресцеина и йодопирацета равна 0,28 ч-1 и 0,23 ч-1 соответственно; эти значения были бы в 6 раз меньшими при том же молекулярном весе, если бы эти вещества удалялись только через переднюю камеру.
При изучении фармакокинетических свойств стекловидного тела становится очевидным, что при выборе веществ, вводимых непосредственно в стекловидное тело, преимущество имеют те препараты, которые покидают его в основном через переднюю камеру, а не через сетчатку. При этом условии их терапевтическое действие будет продлено, концентрация препаратов будет более однородной по всему обьему стекловидного тела, оставаясь неизменной до сетчатки, а передний сегмент глаза будет омыт высокой концентрацией лекарства, созданной во в!гутриглазной жидкости. Однако очень важно, чтобы вводимая доза была ниже концентрации токсичной для тканей глаза, особенно сетчатки.
Коэффициент скорости элиминации лекарственного препарата из стекловидного тела (kv) связан с коэффициентом потери препарата из передней камеры в кровь (к0):
На рис. 28
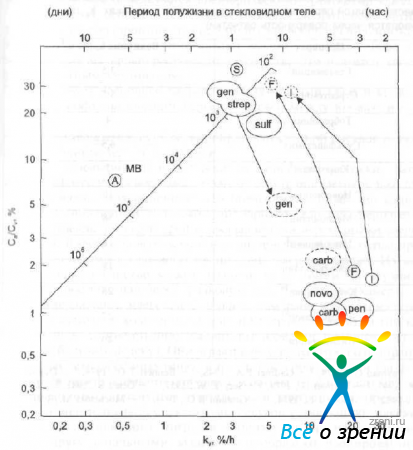
Рис. 28. Зависимость отношения концентрации препаратов в передней камере к их концентрации в стекловидном теле (по данным D.M, Maurice, S. Mishima).
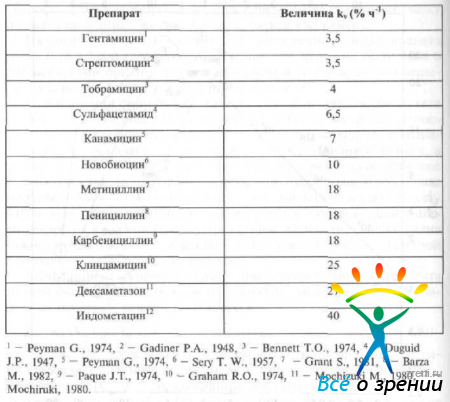
представлена зависимость отношения концентрации препаратов в передней камере к их концентрации в стекловидном теле (Са /Сv) от коэффициента скорости элиминации из стекловидного тела (kv). На прямой линии нанесена калибровка молекулярного веса. Вещества, находящиеся на этой линии или выше нее [альбумин (А), сахароза (S). гентаминин (gen), стрептомицин (strep), сульфацетамид (snlf)], покидают стекловидное тело преимущественно через переднюю камеру. Вещества, находяшиеcя значительно ниже этой линии [пенициллин (реn), карбенициллин (carb), новобиоцин (novo), флюоресцеин (F), йодид (I)], выводятся из стекловидного тела через сетчатку. Однако следует отметить, что при некоторых состояниях путь элиминации препарат может измениться. Например, при воспалении гентамицин частично покидает стекловидное тело через поверхность сетчатки (на рис. 28 название препарата обозначено прерывистой линией). Поэтому при введении гентамицина в стекловидное тело очень важно четко соблюдать рекомендуемую дозу, чтобы не вызвать токсического повреждения сетчатки. Как уже было сказано выше, в случае блокирования транспортного механизма, флуоресцеин и йодий покидают стекловидное тело преимущественно через переднюю камеру (на рисунке названия препаратов указаны прерывистой линией). Значения коэффициентов скорости элиминации некоторых антибиотиков из стекловидного тела представлены в табл. 9.
Таблица 9. Скорость потери лекарств после внутривитреального введения в глаз кролика (при более низких значениях kv препараты выводятся вместе с влагой передней камеры, при высоких значениях kv препараты выводятся через поверхность сетчатки)
↑ Особенности глазной кинетики лекарственных препаратов при системном применении
Если препарат вводится не внутрисосудистым путем (внутривенно или внутриартериально), то при рассмотрении возможности проникновения лекарственного вещества в ткани глаза следует учитывать особенности его системной фармакокинетики (всасывание, выведение, взаимодействие с белками крови и т.д.). После того как лекарство проникло в кровь, дальнейшее внутриглазное распространите препарата определяется специфическими факторами глаза.
Ткани глаза, особенно те, которые отвечают за зрительные функции, хорошо изолированы от системного кровообращения множеством барьеров, которые обеспечивают высокую степень отбора для попадающих из крови растворимых веществ. Это является своего рода защитным механизмом.
Существует несколько барьеров между тканями глаза и кровью. Это гематоофтальмический барьер и барьер между кровью и сетчаткой.
Гематоофтальмический барьер образован стенкой сосудов радужки. цилиарного тела и хориоидеи.
Поры, имеющиеся в эндотелиоцитах капилляров радужки, затянуты диафрагмой (фенестрами), поэтому они проницаемы только для веществ малого молекулярного веса (фенестрированный тип капилляров). Капиллярный эндотелий цилиарного тела характеризуется обильной ячеистой структурой и прерывистыми переходными соединениями. Вместе с новообразованной внутриглазной жидкостью препараты из плазмы крови могут проникнуть в заднюю камеру. Из задней камеры лекарство может легко перейти путем диффузии в стекловидное тело или через зрачковую зону в переднюю камеру.
Эндотелиальные клетки и базальная мембрана хориокапилляров имеют избыточное количество отверстий (перфорированный тип капилляров) и, соответственно, капилляры обладают проницаемостью даже для больших молекул. Они играют наиболее важную роль в транспортировке растворенных веществ из плазмы крови в ткани глаза.
Барьер между кровью и сетчаткой состоит из внешнего отдела, образованного пигментным эпителием, и внутреннего, представленного эндотелиальными клетками сосудов сетчатки.
Клетки пигментного эпителия сетчатки плотно присоединены друг к другу зональными зажимами и образуют изолированный клеточный слой, который имеет сопротивление, сравнимое с сопротивлением эпителия роговицы. Таким образом, пигментный эпителий является барьером с высокой сопротивляемостью диффузии веществ и обладает слабой проницаемостью для малых ионов.
Эндотелиальные клетки сосудов сетчатки соединяются зональными зажимами, которые полностью опоясывают клетки (соматический тип капилляров). Соответственно, эндотелий сосудов сетчатки представляет собой сильный барьер, который препятствует прохождению молекул большого размера.
Проницаемость сетчатки для ряда веществ ограничена наличием активных транспортных механизмов, которые удаляют вещество из сетчатки. Подобные транспортные механизмы существуют для флюоресцеина, йодида, пенициллина, индометацина и некоторых других веществ.
Разница в проникновении лекарств через барьер между кровью и тканями глаза зависит от их химических свойств. На прохождение молекул через барьер оказывают влияние молекулярный вес и степень ионизации молекулы.
Малые липофобные молекулы и ионы могут проходить через пигментный эпителий, а также через стенки капилляров сосудистой оболочки, и через эти структуры попадать в ткани глаза. Скорость внутрикамерного проникновения таких веществ обратно пропорциональна молекулярному весу. Bems-Bellhom и др. (1978), исследуя прохождение градуированных флюоресцинированных декстранов в переднюю камеру глаза крысы, обнаружили, что количество препарата, появившееся в радужной оболочке и передней камере, уменьшалось с увеличением размера вещества; момент прекращения появления наступил при молекулярном весе декстрана, равном 70 000 дальтон и эффективном радиусе молекулы — 6 нм. Следовательно, лекарства с большим молекулярным весом в случае, если они не обладают некоей степенью жирорастворимости, после системного введения будут иметь малую концентрацию в тканях глаза.
Было установлено, что внутриглазное проникновение лекарств сильно зависит от их липидорастворимости, а эффект молекулярного сита играет меньшую роль.
Определенные метаболиты, такие как аскорбиновая кислота (Kinsey V. E., Reddy D.V.N., 1964) и некоторые аминокислоты (Reddy D.V.N., 1979), в норме имеют концентрацию во влаге передней камеры большую, чем в плазме крови. Это вызвано наличием активных транспортных механизмов в цилиарном теле. В то же время отсутствуют доказательства активной транспортировки в глаз любого из синтетических лекарств.
Изучая особенности терапевтического действия лекарства, важно знать степень его проникновения в ткани, а также в жидкости глазa. Количество лекарства, обнаруженное в ткани, в большой степени зависит от степени ее васкуляризации или от ее связи с другими васкуляризованными тканями, а также от проницаемости внутренних барьеров.
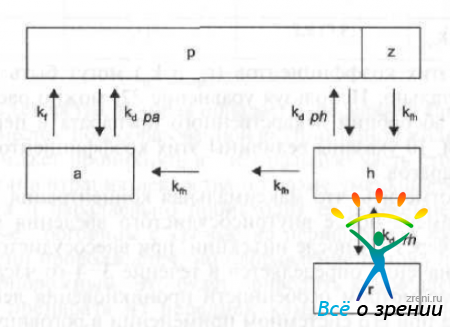
В глазной фармакокинетике для описания динамики обмена веществами между кровью и внутриглазной жидкостью используется модель, изображенная на рис. 29.
Pис. 29. Многокамерная фармакокинетическая модель глазной кинетики лекарственных препаратов (по данным D. M. Maurice, S. Mishima).
р - плазма, z — цилиарное тело, а — влага передней камеры, h — влага передней камеры, r — резервуар (хрусталик, радужка и стекловидное тело).
р - плазма, z — цилиарное тело, а — влага передней камеры, h — влага передней камеры, r — резервуар (хрусталик, радужка и стекловидное тело).
Вместе с новообразованной внутриглазной жидкостью, которая выделяется цилиарным телом в заднюю камеру, лекарственный препарат через зрачок поступает в переднюю камеру, откуда вещество удаляется из глаза через пути оттока водянистой влаги. Во время прохождения через заднюю камеру водяная штага омывает поверхность стекловидного тела, хрусталика и радужной оболочки, поэтому часть препарата проникает в эти структуры и вновь возвращается во внутриглазную жидкость по мере снижения концентрации препарата в ней. Обмен между ними структурами определяется соответствующими коэффициентами скорости потока жидкости и скорости диффузного обмена между камерами (см. рис. 29).
Однако на практике очень сложно измерить концентрацию препарата в задней камере, так как ее объем как у кролика, так и у человека мал. Поэтому для анализа глазной кинетики препаратов после системного введения используется однокамерная модель, изображенная на рис. 30.
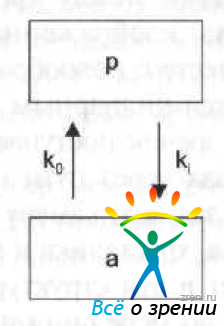
Рис. 30. Однокамерная фармакокинетическая модель глазной кинетики лекарственных препаратов (по данным D. М. Maurice, S. Mishima). р — плазма, а влага передней камеры.
Используя данную модель, скорость изменения концентрации препарата в передней камере после его системного применения можно описать следующим уравнением:
где Са и Ср — концентрация препарата в передней камере и плазме крови (без учета присоединения к белкам плазмы); ki — коэффициент абсорбции лекарственного препарата в переднюю камеру; ko — коэффициент скорости удаления препарата из передней камеры (расчет данного коэффициента был подробно описан выше).
В момент времени, когда концентрация препарата в передней камере перестает расти (dCa /dt = 0), отношение этих двух коэффициентов равно отношению концентраций препарата в передней камере и плазме. Соотношение концентраций в этот момент времени называется коэффициентом установившегося состояния (rap ), который определяется следующим уравнением:
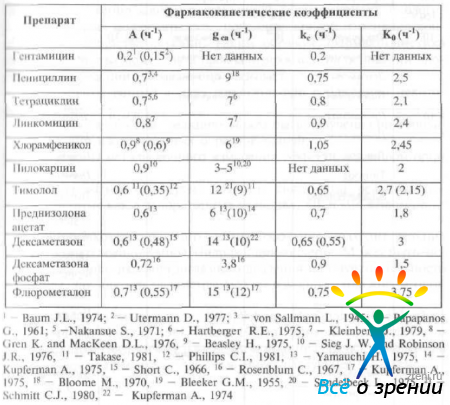
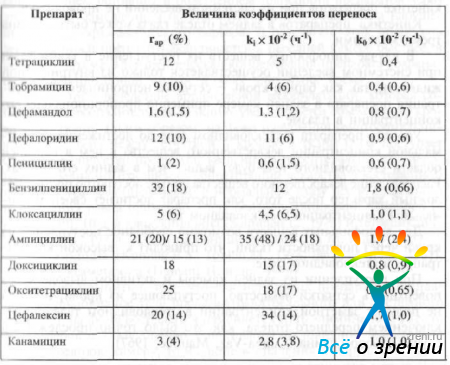
Два из этих коэффициентов (rар и k0) могут быть определены экспериментально. Используя уравнение 32, можно рассчитать коэффициент абсорбции лекарственного препарата в переднюю камеру. В табл. 10
Таблица 10. Величина коэффициентов проникновения некоторых антибактериальных препаратов из плазмы крови во влагу передней камеры у кролика и человека, полученные в результате компьютерного и графического анализа (ни данным D. M. Maurice. S. Mishima)
указаны величины этих коэффициентов для некоторых препаратов.
Следует отметить, что максимальная концентрация препарата в передней камере после внутрисосудистого введения может быть определена через 1 ч после инъекции, при внесосудистом пути введения это значение определяется в течение 3—4-го часа.
Теперь рассмотрим особенности проникновения лекарственного препарата при его системном применении в роговицу, хрусталик и стекловидное тело.
Когда лекарство попадает в кровь, оно проникает в периферические отделы роговицы из сосудов краевой петлистой сети. В то же время часть лекарства, которая попадает в переднюю камеру из плазмы крови вместе с новообразованной внутриглазной жидкостью, через эндотелий может проникнуть в центральную часть стромы.
Когда концентрация лекарства в плазме уменьшается до низкого значения и параллельно происходит ее снижение в передней камере, обмен роговицы с кровью на периферии и жидкостью через эндотелий продолжается, но направление потока препарата будет противоположным. Это будет приводить к замедлению скорости потери препарата из передней камеры. Экспериментальное определение коэффициентов, регулирующих данный обмен, для используемых препаратов не проводилось.
Лекарство, введенное системно, проникает в хрусталик путем диффузии из имеющихся в глазу жидкостей, омывающих его поверхности. Эпителий хрусталика обладает высокой сопротивляемостью липофобным веществам. В случае липофильных соединений (тетрациклин, хлорамфеникол и др.) хрусталик можно рассматривать как депо для данных веществ. Но широких исследований роли хрусталика в кинетике препаратов при их системном введении не проводилось.
Кинетика препаратов в заднем отделе глаза может быть описана тремя моделями.
В случае липофобных веществ их поступление в ткани глаза при системном введении осуществляется только из внутриглазной жидкости, так как барьер кровь — сетчатка непроницаем. Концентрация препарата в задней камере примерно пропорциональна его концентрации в плазме.
Уровень препарата в стекловидном теле до достижения максимальной концентрации лекарственного вещества в нем в передней области стекловидного тела будет выше, чем в задних его отделах. Распределение лекарственного вещества примет абсолютно противоположный характер после того, как препарат достигнет своей максимальной концентрации в стекловидном теле.
Для липофильных веществ возможно свободное поступление из крови через поверхности ткани, что приводит к высокой концентрации в стекловидном теле.
При поступлении из задней камеры и активном выводе через поверхность сетчатки лекарство, поступающее из крови, никогда не получит заметной концентрации в стекловидном теле, за исключением переднего отдела, как это было точно прослежено в случае флюоресцеина (Cunha-Vaz, Maurice, 1967).
↑ Особенности глазной кинетики препаратов при различных заболеваниях
Кроме диагностических и поверхностных анестезирующих средств, лекарства создаются для применения при различных заболеваниях глаза. В результате патологических процессов, происходящих в тканях глаза, кинетика препарата может претерпевать значительные изменения. Коэффициенты обмена между отделами фармакокинетических моделей, описанных ранее, будут отличаться по сравнению с коэффициентами, определенными для нормального глаза. Больше всего на кинетику препаратов оказывает влияние воспалительный процесс любого генеза (травма, аллергический или инфекционный процесс). При таких заболеваниях, как глаукома, катаракта, дегенеративные процессы кинетика лекарственных средств практически не изменяется по сравнению с нормой, описанной ранее.
Изменение кинетики препаратов на фоне воспаления связано с повреждением роговицы и облегчением транспорта препаратов через этот барьер, замедлением потока внутриглазной жидкости и нарушением гематоофтальмического барьера. В результате этих процессов лекарственный препарат накапливается в передней камере быстрее, в большем объеме и терапевтическая концентрация препарата сохраняется во внутриглазной жидкости более длительное время.
Кроме того, вследствие артериальной вазодилатации, которая сопровождает воспалительную реакцию, увеличивается объем потока крови через ткани. Таким образом, на фоне нарушения гематоофтальмического барьера между сетчаткой и кровью в ткани глаза поступает большее количество препарата, введенного парентерально или перорально. Величина отношения концентрации лекарства в воспаленном глазу кролика к концентрации в нормальном глазу после системного применения равна примерно 3 для бензилпенициллина (Salminen L. и др., 1969), 10 для клоксациллина (Salminen L., 1978) и тетрациклина (Salminen L., 1977), 12 для карбенициллина (Barza М. и др., 1973), 5 для гентамицина (Kuming В. S., Tonkin М., 1974; Barza М. и др., 1981), и 6 для дексаметазона (Hamard Н. и др., 1975).
Следует помнить о том, что для некоторых препаратов, попавших в стекловидное тело после интравитреального или системного введения, на фоне воспаления изменяется путь элиминации. И если в нормальном глазу препарат покидает стекловидное тело только через переднюю камеру, то на фоне воспаления и нарушения барьера кровь - стекловидное тело лекарственное вещество может элиминироваться и через поверхность сетчатки. Примером такого изменения кинетики является гентамицин (см. рис. 28). В то же время в результате воспалительного процесса может нарушаться активный транспортный механизм, который обеспечивает элиминацию препарата из стекловидного тела через поверхность сетчатки, что приведет к замедлению выхода препарата из стекловидного тела. Примером такого изменения кинетики является карбенициллин (см. рис. 28).
При введении препаратов в виде периокулярной инъекции, как правило, значительного изменения их кинетики на фоне воспалительного процесса не происходит.
В заключении следует сказать, что анализ глазной кинетики лекарства в условиях имеющихся барьеров и резервуаров, образованных тканями глаза, проведенный в данной главе, показал возможные значения для коэффициентов обмена между отделами фармакокинетической модели глаза и способы их определения.
При применении препаратов в виде глазных капель и мазей основную роль в проникновении его во внутренние структуры глаза играет роговица.
При введении препаратов с помощью периокулярных инъекций вещество распространяется путем диффузии через поверхность склеры и в некоторых случаях роговицы. При введении препарата в область заднего отрезка глаза его проникновение в переднюю камеру и роговицу ограничено.
Очень важно помнить о возможности проникновения лекарственного препарата в системный кровоток при его местном применении. Этот процесс не только уменьшает количество препарата, достигающего точки мишени, но и может привести к появлению нежелательных явлений системного характера. Уменьшить явления системной абсорбции можно с помощью местного введения вазоконстрикторных препаратов.
При введении препарата в стекловидное тело необходимо учитывать путь его элиминации, чтобы не только достичь необходимой концентрации препарата во всех отделах стекловидного тела, но и избежать токсического повреждения сетчатки.
При системном применении в среднем около 0,01—0,07% введенной дозы достигает тканей глаза. На проникновение препаратов во внутриглазные структуры при их системном применении оказывает влияние химическое строение вещества.
Кроме того, патологический процесс (воспаление) может значительно изменить фармакокинетику препаратов, что следует учитывать при выборе оптимальных режимов применения лекарственных средств.
Изучение фармакокинетики не должно ограничиваться пониманием того, как глазные ткани влияют на проникновение и распространение лекарства в глазу. Поэтому фармакокинетические исследования должны быть расширены для того, чтобы иметь возможность устанавливать зависимость этих процессов от химических свойств лекарств. В этом направлении были проделаны только предварительные шаги, и мы надеемся, что анализ, проведенный в этой главе, послужит основой для разработки системного и рационального подхода к выбору доз и способов применения лекарственных препаратов.
----
Статья из книги: Офтальмофармакология. Руководство для врачей | Е.А. Егоров, Ю.С. Астахов, Т.В. Ставицкая



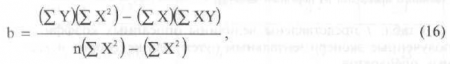







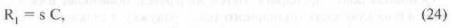


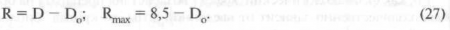





Комментариев 0