Роль кислотности слезы и CU-Кофактора активности фермента лизилоксидазы в патогенезе кератоконуса
Содержание:
Описание
↑ Роль кислотности слезы и CU-Кофактора активности фермента лизилоксидазы в патогенезе кератоконуса
Автор: С. Э. Аветисов, В. Р. Мамиконян, И. А. Новиков
Учреждение Российской академии медицинских наук НИИ глазных болезней РАМН, Москва
Проведен детальный анализ миграции соединений меди в строме роговицы. Установлено, что у пациентов с кератоконусом вследствие избыточной щелочной слезы на средней периферии роговицы возникают биохимические условия, препятствующие продвижению ионов меди к центру роговицы. Обеднение дикупрохлорат-ионом центральной зоны роговицы приводит к инактивации фермента лизилоксидазы, формирующего поперечные сшивки коллагена, и развитию кератоконуса. Установленная связь между кислотностью слезы и распределением меди в роговице открывает новые возможности патогенетического лечения кератоконуса.
Существуют различные теории возникновения и развития кератоконуса. В последнее время все чаще предпринимаются попытки найти генетическое объяснение его этиологии. Между тем, несмотря на активные поиски, однозначного комплементарного заболеванию генетического маркера до сих пор выявить не удалось. Многие исследователи отмечают изменение активности регулирующих ферментов, как разрушающих структурные элементы стромы, так и участвующих в их создании.
Исследования методом сканирующей электронной микроскопии вещества роговицы, измененной кератоконусом, свидетельствуют об отсутствии поперечных сшивок в коллагене стромы. Большинство исследователей соглашается с тем, что это ведущий морфологический признак тканевой аномалии, приводящей к постепенному пластическому течению материала и как следствие — к кератэктазии.
Поперечные сшивки коллагена формируются в результате взаимодействия продуцируемого кератоцитами в межклеточное пространство неупорядоченного "молодого" тропоколлагена и Cu-зависимого фермента лизилоксидазы. Хотя факт снижения его активности при кератоконусе сомнения не вызывает , однозначных генетических признаков снижения активности фермента на текущий момент не выявлено.
Целью настоящей работы явилось клинико-экспериментальное исследование кислотности слезы и ее роли в интрастромальной миграции ионов меди как фактора, определяющего активность фермента лизилоксидазы.
↑ Материал и методы
Получен спектр электронного парамагнитного резонанса (ЭПР-спектроскопия) образцов ткани 7 кадаверных роговиц без признаков кератоконуса и 8 образцов из дисков роговиц, удаленных при сквозной кератопластике (СКП), из них в 3 образцах обнаружено клинически видимое кольцо Флейшера.
Использовали ЭПР-спектрометр Varian Е-112. Параметры съемки: 20 мВт, 9 ГГц, комнатная температура. Исходя из параметров съемки, резонансную кривую масштабировали в размерности g-фактора, что дало возможность использовать спектр как характеристический для обнаружения некоторых веществ и установления их валентности.
[banner_centerrs] {banner_centerrs} [/banner_centerrs]
Кроме того, проведен рентгеноструктурный анализ образцов ткани из 2 кадаверных роговиц и 2 дисков роговиц, удаленных при СКП по поводу кератоконуса. Рентгенограмма была получена на рентгеноструктурном анализаторе ДРОН-ЗМ. Для этого же материала получен элементный состав на рентгенофлюоресцентном спектрометре "Респект" (XRF-анализ). Элементный состав определяли отдельно для центральной зоны роговицы и для зоны кольца Флейшера.
В группе из 33 пациентов (33 глаза) в возрасте 15—34 года с установленным кератоконусом II—IV стадий проведена рН-метрия слезы базальной секреции в зоне слезного ручья контактным электродом (потенциометр "HANNA Instruments").
Аналогичное исследование выполнено в группе из 56 пациентов (56 глаз) в возрасте 16—28 лет с клинически нормальными анатомическими и биомеханическими свойствами роговицы. Группа была разделена на две подгруппы. Критерием деления служило курение в анамнезе. Основанием для использования этого критерия послужили данные литературы о возможной связи кератоконуса и курения.
↑ Результаты и обсуждение
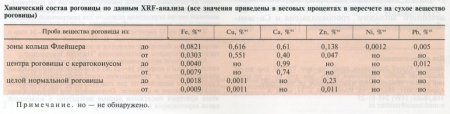
Рентгенофлюоресцентный анализ образцов ткани, полученных из 7 кадаверных роговиц без признаков кератоконуса и роговиц, удаленных при СКП по поводу кератоконуса, выявил резкое различие в содержании микроэлементов халькофильной группы.
Если для кадаверных роговиц без признаков кератоконуса установлено незначительное присутствие меди и цинка в веществе стромы, то в роговицах, удаленных при СКП по поводу кератоконуса, было обнаружено накопление меди в зоне кольца Флейшера (в 500—600 раз большее по отношению к нормальному содержанию) и одновременно отсутствие (на уровне чувствительности метода) этого микроэлемента в центральной части роговицы.
Аналогичное поведение в плане накопления в зоне кольца Флейшера при кератоконусе демонстрировали все обнаруженные микроэлементы халькофильной группы и железо.
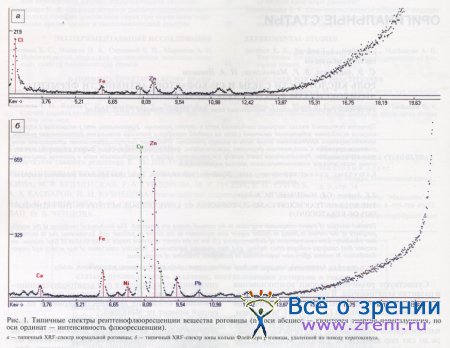
Типичные XRF-спектры показаны на рис. 1. Данные XRF-анализа приведены в таблице.
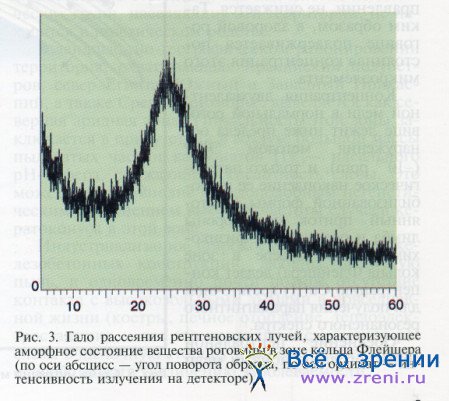
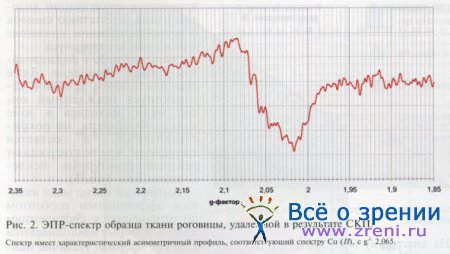
ЭПР-спектроскопия вещества роговицы, взятого в зоне кольца Флейшера, позволила установить двухвалентную форму нахождения меди (рис. 2), а отсутствие пиков (гало рассеяния) на рентгенограмме указывало на аморфное состояние вещества в этой зоне (рис. 3).
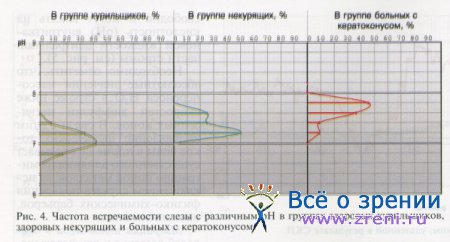
Прямые измерения рН слезы базальной секреции в клинической части исследования выявили различия в кислотности слезы в разных группах (рис. 4).
Было установлено, что у больных с кератоконусом наиболее часто слеза имеет рН 7,6—7,8; у здоровых некурящих людей — рН 7,2—7,6; у курильщиков — рН 7,0—7,2.
Полученные результаты позволяют рассматривать уровень кислотности слезы в качестве возможного патогенетического фактора в механизме развития кератоконуса.
Современные представления о физиологических процессах в роговице дают основание говорить о следующей предполагаемой схеме миграции влаги и химических соединений в ее строме.
При нормальной работе клеток заднего эпителия роговицы (ЗЭР) возникает градиент содержания воды в существенно-белковом матриксе стромы. Задняя часть стромы, примыкающая к десцеметовой мембране, оказывается наиболее обезвоженной. Одновременно с дегидратацией, возникшей в результате работы ЗЭР, высокая гидрофильность коллагена приводит к встречному процессу. Непрерывно происходит восполнение внутритканевой влаги за счет постоянного перераспределения ее к задней части стромы из более гидратированных участков.
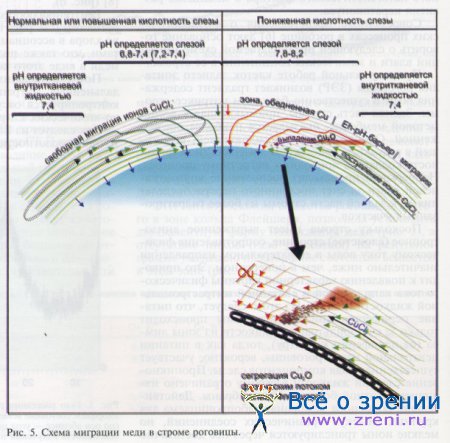
Поскольку строма имеет выраженное анизотропное (слоистое) строение, сопротивление физическому току воды в ее латеральном направлении значительно ниже, чем в поперечном. Это приводит к появлению характерной картины физического тока капиллярной и связанной интрастромальной жидкости (рис. 5).
Из этого следует, что питание периферической части стромы происходит только за счет фильтрации жидкости из зоны лимба (от периферии к центру), тогда как в питании центральной части роговицы, вероятно, участвует существенная доля компонентов слезы. Проникновение слезной жидкости в строму ограничено наличием плотной боуменовой мембраны. Действительно, боуменова мембрана слабопроницаема для крупных молекул органических соединений, но мелкие ионы транслируются через нее достаточно свободно и могут влиять на кислотность (рН) внутритканевой жидкости центральной части стромы (см. рис. 5).
Необходимо отметить, что абсолютные значения массо-переноса Н20 в строме ниже скоростей диффузии несвязанных ионов. В связи с этим направление физических токов воды в норме не оказывает существенного влияния на миграцию ионов металлов, за исключением случаев появления физико-химических барьеров, описанных ниже.
Миграция ионов меди в здоровой роговице и при кератоконусе. Строма роговицы в норме, по данным прямых измерений, имеет близкий к нейтральному (0V) окислительно-восстановительный потенциал (Eh) и практически непроницаема для крупных белковых соединений.
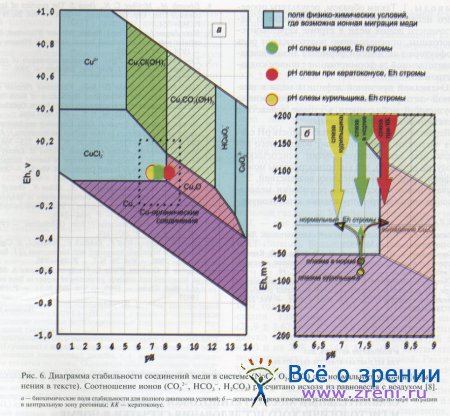
Таким образом, биохимические и физические условия, существующие в строме, позволяют предположить, что большая часть меди поступает в роговицу со стороны лимба в виде подвижного комплексного дихлоркупрат(1)-иона [СuСl2]. Зона физико-химической устойчивости меди в этой форме показана на Eh-рН-диаграмме (рис. 6).
Рентгенофлюоресцентный анализ нормальной роговицы (см. рис. 1) выявляет заметное количество хлора в ассоциации с халькофильными элементами, что также подтверждает форму нахождения меди в виде этого комплекса.
После попадания в строму со стороны лимба дальнейшая миграция меди к центру роговицы контролируется отсутствием или наличием физико-химических Eh-рН-барьеров (см. рис. 6).
Как следует из Eh-pH-диаграммы, при недостаточной кислотности слезы миграционные способности меди будут ограничены. На диаграмму (см. рис. 6) нанесены реальные значения рН слезы базальной секреции в зоне слезного ручья (по данным собственных измерений).
Медь, попадая на границу зоны, где рН определяется избыточно-щелочной слезой, образует нерастворимое соединение с кислородом (Cu20) и теряет ионно-диффузионную мобильность. Оксид меди сегрегируется и некоторое время еще мигрирует в виде коллоидных микрочастиц, подчиняясь физическому току интрастромальной жидкости, пока не теряет мобильность окончательно.
В завершении процесса Cu2O сгружается в кольцевой зоне при десцеметовой оболочке (см. рис. 5), где частично переходит в двухвалентную форму (СuО), видимую на ЭПР-спектрах (см. рис. 2).
В случае нормальной кислотности слезы медь не теряет ионной формы и ее миграционная способность как от периферии к центру роговицы, так и в обратном направлении, не снижается. Таким образом, в здоровой роговице поддерживается постоянная концентрация этого микроэлемента.
Концентрация двухвалентной меди в нормальной роговице лежит ниже предела обнаружения методом ЭПР (~10 в минус 3 степени ррm), и только патологическое накопление ее иммобилизованной формы (постоянный приток со стороны лимба и оседание на физико-химическом барьере в зоне кольца Флейшера) делает концентрацию Cu(II) достаточной для получения парамагнитного резонансного спектра.
Обеднение центральной зоны роговицы ионами меди приводит к инактивации лизилоксидазы, отсутствию сшивок в новообразованном коллагене и развитию кератоконуса.
Значение меди в формировании кольца Флейшера. Даже при длительном течении кератоконуса осажденный оксид меди, находясь в зоне кольца Флейшера, не рекристаллизуется, а остается аморфным, что подтверждают рентгеноструктурные исследования (см. рис. 3).
Аморфный оксид меди является эффективным сорбентом по отношению к соединениям железа, которые накапливаются в нем и окисляются до Fе3+-формы. Наличие окислов железа (гематосидерина) делает эту зону видимой и известной как кольцо Флейшера.
Впрочем, смесь окисных и закисных соединений меди (Cu20 • СuО) представляет собой самостоятельный красно-бурый пигмент. Весьма вероятно, что часть клинически видимых колец Флейшера образована вообще без участия соединений железа. В этом случае наиболее ярко окрашенной будет передняя часть стромы в зоне кольца Флейшера, где пигмент имеет более рассеянную форму и еще не подвергся окончательной сегрегации.
В случае, когда кольцо Флейшера при развитом кератоконусе хорошо заметно, и когда оно визуально не выделяется, накопление двухвалентной меди подтверждается ЭПР-спектроскопией (см. рис. 2). Это доказывает, что накопление меди в зоне кольца первично по отношению к гематосидерину.
Преобладание соединений меди над соединениями железа в кольце Флейшера подтверждается рентгенофлюоресцентным анализом (см. рис. 1 и таблицу).
Влияние внешних факторов.
Одним из примеров внешнего воздействия на кислотность слезы является курение. Курильщик, регулярно подкисляя слезу табачным дымом, увеличивает ионную мобильность меди в роговице. Даже если у него имеется собственная генетическая предрасположенность к щелочной слезе, курение, возможно, оказывает тормозящее влияние на развитие кератоконуса. Последнее объясняет, в частности, парадоксальную 95% негативную ассоциацию кератоконуса и курения, отмеченную некоторыми исследователями.
В старой медицинской литературе кератоконус описывают как заболевание преимущественно народов Средиземноморья, северной части Аравийского полуострова, юга Каспийской низменности, Крыма, Кавказа, Адриатики, хотя этот факт кажется достаточно странным, так как многие из этнических групп, населяющих эти территории, не находятся в генетическом родстве.
В ландшафтно-географическом районировании территория, охватывающая Аравийский полуостров, север Египта, Южный и Западный Прикаспий, а также Средиземноморье, выделяется как северная аридная зона. Уникальность этой зоны заключается в присутствии в воздухе большой массы пылеватых частиц карбонатов — идеального рН-буфера, снижающего кислотность слезы. Это может служить вполне правдоподобным негенетическим объяснением высокой частоты случаев кератоконуса в этой зоне.
Индустриализация, широкое использование железобетонных конструкций, дающих щелочную пыль, и одновременно почти полное отсутствие контакта с высокозольными дымами в повседневной жизни (костры, печное отопление, теплоэлектростанции) — все это приводит к смещению рН слезы в щелочную сторону и гипотетически может способствовать увеличению заболеваемости.
↑ Выводы
1. Таким образом, результаты проведенного исследования, свидетельствующие о недостаточности ионов меди в строме кератоконусной роговицы, опосредованно подтверждают роль Cu-кофактора в активации фермента лизилоксидазы, ответственной за формирование сшивок коллагена стромы.
2. Очевидной причиной дефицита меди в центральной части роговицы является ограничение ее диффузионной мобильности в строме вследствие недостаточной кислотности слезы.
3. Вероятно, собственная вариабельность рН слезы и в частности щелочной сдвиг водородного показателя при кератоконусе имеют генетическую природу, но очевидно, что кислотность слезы можно модифицировать за счет внешних воздействий. Это открывает новые перспективы разработки медикаментозных методов предупреждения кератоконуса.
---
Статья из журнала: Вестник Офтальмологии | Том 128. №2 2011



Комментариев 0