Сетчатка │ Часть 3

Содержание:
Описание
↑ Зрительные пигменты и фоторецепция
Описывая строение сетчатой оболочки, необходимо хотя бы кратко остановиться на процессах, происходящих в фотороцепторах и определяющих понятие фоторецепции.
Процесс восприятия света связан непосредственно с физико-химическими процессами, происходящими в стопках мембран наружных члеников палочек и колбочек, и представляет собой целую систему связанных между собой химических преобразований, направленных на трансформацию световой энергии в нервный импульс. В систему этих преобразований входят также механизмы, направленные на восстановление веществ, обеспечивающих световосприятие. регенерацию наружных члеников фоторецепторых клеток и др. Центральное место в восприятии световой энергии занимают специализированные вещества — зрительные пигменты, которые располагаются именно в мембранах наружных члеников фоторецепторных клеток.
Сейчас мы кратко остановимся на сути происходящих при световосприятии процессах. Первоначально мы опишем особенности химической организации мембран наружных члеников фотороцепторов и зрительных пигментов.
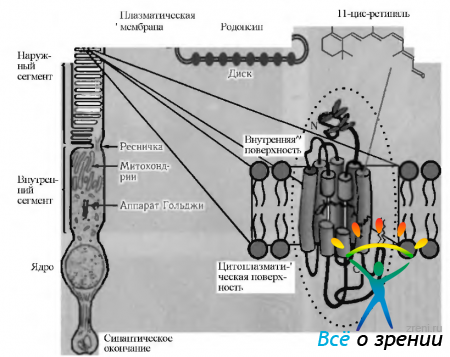
Как было указано выше, мембраны наружных сегментов палочек и колбочек содержат зрительные пигменты, которые абсорбируют световую энергию и инициализируют зрительное возбуждение. Эти белковые молекулы внедрены в двухслойные липидные мембраны пластин наружных члеников фоторецепторов (рис. 3.6.35).
Рис. 3.6.35. Схематическое изображение локализации родопсина в наружном членике палочки (по Hargrave, 1996)
В наружных сегментах палочек липиды и белки составляют примерно 50% веса. Большинство липидов относятся к фосфолипидам. В состав фосфолипидов, помимо глицерина, входят также две цепи жирной кислоты (в положении 1 и 2) и фосфорнокислая группа (в положении 3). В липидном слое мембраны цепи жирных кислот ориентированы таким образом, что внутри мембраны образуется гидрофобная область, а снаружи располагаются глицерол/фосфатные группы, обеспечивающие гидрофильность этой поверхности мембраны. Характерной особенностью липидов сетчатки является высокое их насыщение ненасыщенными жирными кислотами.
Наружные сегменты палочек содержат также большое количество различных белков, главным из которых является опсин. Родопсин представляет собой соединение 11-цис-ретиналя (альдегид витамина А) с опсином посредством основания Шиффа. Родопсин относится к так называемым трансмембранным белкам, N-конец которых обращен в междисковое пространство, а С-конец обращен в цитоплазму (рис. 3.6.35). Благодаря этому молекулы хромофора ориентированы параллельными рядами вдоль мембран наружных члеников фоторецепторов, т. е. располагаются перпендикулярно падающим на него фотонам, обеспечивая максимальный сбор световой информации. Установлено, что диск наружного сегмента палочки содержит от 300 до 900 молекул родопсина.
В сетчатке человека выявлено четыре типа зрительных пигментов. Один тип обнаружен в палочках (родопсин) и три в колбочках (иодопсин). В зависимости от спектральных особенностей поглощения световой энергии колбочковые пигменты разделяются на чувствительные к красной (570 нм), зеленой (540 нм) и синей частям спектра (440 нм). 11-цис-ретиналь является хромофором для всех четырех классов зрительных пигментов человека.
Основным механизмом преобразования световой энергии является изменение характера взаимодействия хромофора (11-цис-ретиналь) с белком (опсин). Механизм этого процесса сводится к тому, что при действии световой энергии происходит изомеризация 11-цис-ретиналя с превращением его в полностью транс-ретиналь. Изменение строения молекулы ретиналя разрушает ее связь с опсином, что приводит к нарушению третичной структуры белка. Этот процесс происходит через ряд звеньев с образованием промежуточных продуктов. Эти промежуточные вещества существуют исключительно короткое время и их можно анализировать только при низких температурах. Наиболее важным звеном в этом процессе является переход метародопсина I в метародопсин II. Именно на этом этапе и происходят конформационные изменения белковой части родопсина, что приводит к появлению у последнего ферментативной активности. Эти изменения инициируют дальнейший каскад процессов преобразования, о которых речь пойдет несколько ниже.
После разрушения связи хромофора с опсином наступает обратный — процесс, т. е. регенерация родопсина. Происходит это следующим образом. При обесцвечивании зрительного пигмента полностью-транс-ретиналь высвобождается из зрительного пигмента и преобразуется в полностью-транс-ретинол. Полностью-транс-ретинол из наружных сегментов фоторецепторов поступает в пигментный эпителий сетчатки, где он эстерифицируется, превращаясь в эфир полностью-транс-ретинил эфир. Последний превращается в 11-цис-ретинол благодаря деятельности фермента — ретиноид изомеразы. Образовавшийся в результате реакции 11-цис-ретонол возвращается в фоторецепторы. где, окисляясь, превращается в 11-цис-ретиналь. 11-цис-ретиналь соединяется с опсином, образуя родопсин. Вновь образованный родопсин может опять абсорбировать фотон и инициализировать зрительный цикл. Таким образом, та же самая молекула опсина может многократно использоваться в зрительном возбуждении.
Из приведенной цепи реакций видно, что составленные части родопсина повторно используются в зрительном цикле. Тем не менее процесс регенерации хроматофора предполагает обязательное постоянное пополнение клеток пигментного эпителия витамином А, из которого образуется эфир 11 -цис-ретинила.
В организм человека витамин А поступает с пищей и хранится в печени. Поступая в кровь, он связывается с ретинол-связывающим белком и затем с преальбумином. Этот белковый комплекс, благодаря наличию фенестр в эндотелиальной выстилке капиллярных сосудов хориоидеи, легко проникает через мембрану Бруха и достигает клеток пигментного эпителия сетчатки. Затем витамин А отделяется от белковой части комплекса и поступает в цитоплазму пигментных клеток для дальнейших преобразований в 11-цис-ретиналь.
Для восстановления родопсина необходимо пополнение и его белковой части, т. е. опсина. Пополнение фоторецепторов опсином происходит благодаря постоянно протекающему процессу регенерации наружных члеников палочек и колбочек. Вновь образованные мембранные пакеты. содержащие в своем составе и опсин, постепенно передвигаются к апикальной поверхности фоторецептора, где опсин связывается с 11-цис-ретиналем, образуя «новый» родопсин.
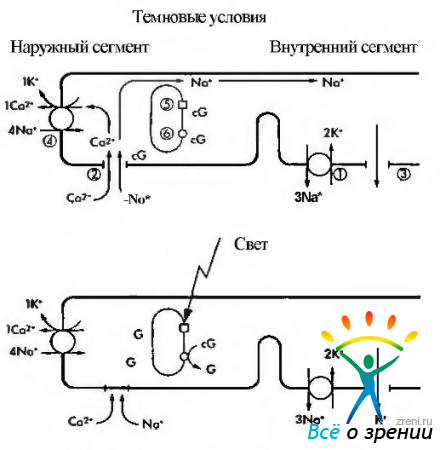
Кратко описав характер химических преобразований родопсина в процессе зрительного цикла, необходимо ответить на вопрос — каким образом описанные физико-химические процессы приводят к инициализации нервного импульса? Чтобы понять этот процесс необходимо обратиться к рис. 3.6.38.
[banner_centerrs] {banner_centerrs} [/banner_centerrs]
Рис. 3.6.38. Схематическое изображение механизма формирования нервного импульса в фоторецепторной клетке: В темноте ионы натрия (Na+), как и ионы кальция (Са+), перемещаются из наружного сегмента фоторецептора во внутренний благодаря деятельности Na+/K насоса (1). а поступают в наружный сегмент через катионные каналы (2). При этом формируется «темновой ток» ионов натрия. Катионные каналы открыты тогда, когда сСМР (cG) находится в связанном состоянии. Поток ионов натрия в направлении внутреннего сегмента происходит по мере выхода из клетки ионов калия (3). Вследствие поглощения фотона родопсином (5) активизируется фосфодиэстераза (6), что приводит к повышению концентрации cGNP и закрытию катионных каналов. Следствием этого является уменьшение проницаемости мембраны для ионов натрия и усиление ее поляризации. Посредником в этом процессе являются ионы кальция, поскольку они эффективно блокируют натриевые каналы и вызывают наблюдаемую гиперполяризацию. Выведение ионов кальция обеспечивается деятельностью ионообменника (4) и при закрытых каналах
На рисунке видно, что в темновых условиях фоторецепторы деполяризованы. Это связано с тем, что натриевые каналы плазматических мембран сегментов палочек и колбочек в темноте открыты и из внеклеточного пространства в цитоплазму фоторецептора поступает большое количество ионов натрия. При этом диффузия натрия из наружного сегмента фоторецепторов во внутренний сегмент в темновых условиях обеспечивает формирование «темнового тока».
Натриевые каналы остаются открытыми благодаря высокой концентрации циклического гуанозин монофосфата (cGMP). Равновесие между ионами натрия и калия поддерживается благодаря деятельности АТФ-зависимого натрий/калиевого насоса.
Воздействие на зрительный пигмент световой энергии приводит к закрытию ионных каналов и снижению проводимости Na+ через мембрану наружного сегмента (рис. 3.6.38). При этом изменяется трансмембранный потенциал фоторецептора и возникает гиперполяризация. Таким образом, фоторецепторы отвечают на освещение не потенциалами действия, а гиперполяризацией, величина которой пропорциональна интенсивности освещения.
В деполяризованном (темновом) состоянии фоторецепторы высвобождают нейромедиаторы в синаптическую щель, которые взаимодействуют с постсинаптическими терминалами биполярных и горизонтальных клеток.
Увеличение степени освещенности вызывает градуированную гиперполяризацию, которая вызывает уменьшение выделения нейромедиатора.
Необходимо отметить, что фоторецепторы, как и горизонтальные и биполярные клетки, не генерируют потенциалы действия, и таким образом отвечают на световую энергию уменьшением выделения медиатора. Только нейроны третьего порядка (ганглиозные клетки) генерируют потенциалы действия.
Как указано выше, индуцирует гиперполяризацию фоторецептора перекрытие ионных каналов. Изучению механизмов этого процесса посвящено большое количество исследований. Установлено, что основную роль в закрытии ионных каналов играет циклический гуанозин монофосфат (cGMP). Именно cGMP индуцирует целый каскад реакций ферментативного превращения различных белков с участием ионов кальция. Одну из центральных ролей в этом процессе играют белок-передатчик трансдуцин и фермент фосфодиэстераза. Именно фосфодиэстераза снижает концентрацию cGMP, что и приводит к закрытию ионных каналов.
Необходимо указать и на то, что фоторецептор не просто регистрирует световую энергию. Он также адаптируется к степени освещенности. Например, колбочки могут адаптироваться таким образом, что наша зрительная система регистрирует свет от слабых интенсивностей освещения до ярко освещенных солнцем объектов.
↑ Нейромедиаторы (нейротрансмиттеры) сетчатой оболочки
Описывая микроскопическое строение сетчатой оболочки, мы неоднократно упоминали о наличии определенных структурных отличий синаптической организации нейронов сетчатки. Нейроны сетчатки отличаются и используемым типом нейромедиатора при передаче информации от одного нейрона другому.
В последнее время было обращено особое внимание на изучение нейромедиаторов сетчатки, что позволило более точно дифференцировать различные типы нейронов и выявить их функцию. Развитию направления изучения нейромедиаторов способствовали успехи смежных дисциплин, таких как ауторадиография, иммунология и молекулярная биология.
Клетки, окрашенные конъюгированными к различным типам нейромедиаторов антителами, меченными пероксидазой хрена, окрашивают самые нежные нервные волокна. На основании этого возможна довольно точная дифференциация клеток, особенно при одновременной их импрегнации по Гольджи. Большинство исследований нейромедиаторов нейронов сетчатки проведено на животных, но многое и на сетчатке человека. Необходимо отметить, что полученные данные при исследовании животных во многом совпадают с данными исследования сетчатки человека.
Перед тем как более подробно остановиться на каждом из выявленных в сетчатке нейромедиаторе, необходимо указать, что все они обнаруживаются и в центральной нервной системе, что еще раз доказывает существование единства механизмов их развития и функционирования.
Глютаминовая кислота. Глютаминовая кислота относится к наиболее распространенным нейромедиаторам нейронов «вертикальных» нейронных трактов сетчатки (рис. 3.6.39, а).
Рис. 3.6.39. Распределение глютаминовой кислоты (а) и гамма-аминомасляной кислоты (б) в нейронах сетчатой оболочки человека: интенсивное черное окрашивание цитоплазмы клеток различных слоев сетчатки свидетельствует о положительной гистохимической реакции на выявляемый медиатор. Наиболее интенсивное окрашивание выявляется в цитоплазме ганглиозных клеток, менее интенсивное в нейронах внутреннего и наружного ядерных слоев (стрелки)
Все фоторецепторы используют глютаминовую кислоту для передачи сигналов к нейрону следующего порядка.
Предполагают, что глютаминовая кислота является нейромедиатором всех биполярных и большинства ганглиозных клеток сетчатки позвоночных.
Поглощение, высвобождение и физиологическое действие глютамата и его агонистов на нейроны второго порядка подтвердило, что глютамат является нейромедиатором возбуждающего действия в первом синапсе сетчатки. Действие этого нейромедиатора на нейроны второго порядка происходит посредством двух различных типов сенсорных каналов. Один тип постсинаптического рецептора относится к метаботропному, а второй является ионотропным. Метаботропные рецепторы активизируются посредством G-белка. Ионотропные рецепторы представляют собой интегральные мембранные белки, фиксирующие глютаминовую кислоту. Этот процесс приводит к открытию катионных каналов. В настоящее время выявлен целый ряд ионотропных рецепторов.
Дендриты биполярных клеток, расположенные в наружном плексиформном слое, имеют рецепторные каналы, которые относятся или к метаботропным или ионотропным. В то же время их аксоны, расположенные во внутреннем плексиформном слое, имеют каналы и рецепторы для гамма-аминомасляной кислоты (типов А, В и С), допамина и глицина. Это связано с тем, что все виды амакриновых клеток являются на этом уровне внутреннего плексиформного слоя пресинаптическими.
Гамма-аминомасляная кислота (ГАМК). Классический тормозной нейромедиатор, гамма-аминомасляная кислота (ГАМК). встречается во многих типах амакриновых и горизонтальных клеток у большинства позвоночных. Имеются некоторые противоречия при решении вопроса — содержится ли ГАМК в горизонтальных клетках обезьян и человека.
При окрашивании сетчатки человека видно, что четко окрашивается внутренний плексиформный слой и приблизительно половина тел амакриновых клеток, лежащих во внутреннем ядерном слое. Горизонтальные клетки не окрашиваются (рис. 3.6.39, б).
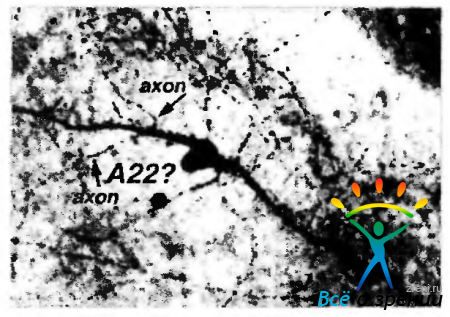
Благодаря использованию двойных методов окрашивания стало известно, что амакриновые клетки типа А2, А10, А13, А17, А19 и межплексиформная клетка накапливают ГАМК и, вероятно, используют ее как первичный нейромедиатор. Некоторые амакриновые клетки одновременно с ГАМК используют и другие нейромедиаторы, такие как серотонин, ацетилхолин (звездчатые амакриновые клетки), допамин, нейропептиды (вещество Р).
ГАМК-эргические амакриновые и межплексиформные клетки действуют на отростки биполярных, амакриновых и ганглиозных клеток или тела клеток в нейропиле сетчатки посредством всех трех типов ГАМК рецепторов.
Глицин. Глицин является аминокислотой. В центральной нервной системе и сетчатке глицин выполянет медиаторные функции. Определяется он в амакриновых клетках, не дающих реакцию на ГАМК. Предполагают, что к глицинэргическим относятся также несколько типов биполярных клеток. Глицин осуществляет некоторые формы постсинаптичес-кого торможения.
В сетчатке человека выявляется два морфологических типа глицинэргических амакриновых клеток. Менее интенсивно окрашиваются клетки типа АН. Более интенсивно окрашиваются клетки А4 и А8. Глициновые рецепторы также найдены на всех нейронах, являющихся постсинаптическими по отношению к амакриновым клеткам — на аксонах биполярных клеток, на дендритах ганглиозных клеток. Обнаружены глициновые рецепторы и в мюллеровских клетках.
Допамин. Нейромодулятор допамин обнаруживается в нескольких типах амакриновых клеток сетчатки млекопитающих. Наиболее интенсивно окрашивается при проведении иммуногистохимической реакции амакриновая клетка типа А18.
Допаминовая клетка первого типа (А18) образует синапс на амакриновой клетке палочки АН и, возможно, также на клетках А8 и А17.
Второй тип допаминовой амакриновой клетки был описан у обезьян и человека. Эта клетка отдает дендриты, распределяющиеся в 3-м слое (страте) внутреннего плексиформного слоя.
Допаминовые клетки первого типа обеспечивают функционирование восходящих путей, направляющихся к наружному плексиформному слою. В этом слое они образуют синапсы с ГАМК-эргическими межплексиформными клетками.
Допаминовые рецепторы (D1 и D2) были идентифицированы на нейронах внутреннего и наружного ядерных слоев сетчатки многих позвоночных.
Предполагают, что рецептор D1 характерен для горизонтальных клеток наружного плексиформного слоя и некоторых амакриновых клеток внутреннего плексиформного слоя. Рецепторы D1 также выявлены на телах ганглиозных клеток.
Рецепторы D2 найдены в наружном ядерном слое, наружной пограничной мембране и даже в пигментном эпителии сетчатой оболочки. Присутствуют они и во внутреннем плексиформном слое.
Ацетилхолин. Классический эксцитатный нейромедиатор периферической нервной системы — ацетилхолин. Он найден в амакриновых клетках сетчатки позвоночных. У кролика такие клетки были названы звездоподобными клетками. Различают два типа подобных клеток. Клетки одного типа располагаются в субпластинке а внутреннего плексиформного слоя. Тело другого типа клеток смещено к слою ганглиозных клеток, а их дендриты распределяются в субпластинке Ь.
Эти ацетилхолинсодержащие амакриновые клетки близки по строению почти у всех позвоночных. Описаны они и в сетчатке человека.
Как мускариновые, так и холиномиметические рецепторы выявлены в сетчатке млекопитающих, особенно в ганглиозной клетке (Y-клетки). Влияние ацетилхолина и его антагонистов на ганглиозную клетку пока неясно.
Серотонин. Имеется два типа серотонинсодержащих амакриновых клеток в сетчатке кролика. Один из них относится к клетке типа А17 системы палочек. В сетчатке кошки выявлены совершенно иные серотонинэргические типы амакриновой клетки. Первый тип клеток кошки подобен широкопольной клетке А20, а второй—А18 или дофаминовой клетке.
Аденозин. Пуриновый нуклеотид аденозин в сетчатке млекопитающих может быть нейромедиатором или нейромодулятором. Ауторадиография и иммуногистохимия показали наличие аденозина в амакриновых и ганглиозных клетках. В сетчатке человека также выявляются аденозинсодержащие клетки, которые можно отнести к биполярным и горизонтальным клеткам.
Влияние аденозина на сетчатку и на функции ганглиозных клеток верхних бугорков четверохолмия было зарегистрировано при использовании методов электрофизиологии, что подтверждает его нейромедиаторную роль.
Пептиды. В настоящее время на роль пептидных нейромедиаторов в ткани мозга претендует около 50 белков. Из них приблизительно четвертая часть выявлется в сетчатой оболочке. Это вазоактивный кишечный полипептид (VIP), вещество Р, энкефалины, соматостатин, нейроактивный пептид Y, глюкагон, холецистокинин и нейротензин. Перечисленные медиаторы выявлены в амакриновых клетках сетчатки разнообразных животных. Более подробно мы остановимся на веществе Р.
Вещество Р относится к нейропептидам. Состоит оно из 11 аминокислот и принадлежит к семейству тахикининов, включающему нейрокинин А, нейропептид К и нейрокинин В. Вещество Р является нейромедиатором или нейромодулятором сетчатки млекопитающих.
Только среди амакриновых клеток сетчатки человека обнаруживаются Р-эргические клетки (рис. 3.6.40).
Рис. 3.6.40. Субстанция Р в амакриновых клетках сетчатки человека (по Kolb et al., 1995)
Эти клетки отличаются широким дендритным полем, достигающим 3-го слоя (S3) внутреннего плексиформного слоя. Здесь отростки формируют густое сплетение. Либо от тел клеток, либо от их дендритов отходят «аксон-подобные» отростки, которые, в свою очередь, разделяются на два длинных нежных отростка, расходящихся в противоположных направлениях на сотни микрон и заканчивающихся в слоях S5 и S3. Длинные дендриты этих клеток заканчиваются также на стенках кровеносных сосудов.
Оксид азота. Окись азота образуется во многих нейронах периферической и центральной нервной системы и выполняет нейромедиатор-нуто роль. Косвенно способность клеткой синтезировать оксид азота можно выявить путем проведения гистохимической реакции, выявляющей активность НАДФ-диафоразы. При применении этого метода выявлено три типа амакриновых клеток и один тип ганглиозной клетки, дающих четкую реакцию на НАДФ-диафоразу. Эти клетки обладают большим телом и лежат в слое амакриновых клеток или смещены к слою ганглиозных клеток. Их дендриты достигают 3-го слоя внутреннего плексиформного слоя.
↑ Глиальная система сетчатки
Глиальная система сетчатой оболочки выполняет те же функции, что глия центральной нервной системы. В сетчатке различают четыре типа клеток:
- мюллеровская клетка,
- астроциты,
- олигодендроциты
- микроглия.
Астроглия . Астроциты возникают в эмбриональном периоде из клеток неврального гребня, проникая в сетчатку по ходу зрительного нерва. Различают «фиброзный» и «протоплазматический» астроциты. Типичной особенностью астроцитов центральной нервной системы, в том числе сетчатки, являются длинные маловетвящиеся отростки, часть которых примыкает к стенкам небольших кровеносных сосудов. Тело клетки и ядро имеют овальную и полигональную форму и слабо окрашены. В ядре содержится небольшое количество хроматина. Ядрышко, как правило, обнаружить не удается. Цитоплазма астроцитов насыщена микрофила-ментами (10 нм в диаметре). Хорошо развит эндоплазматический ретикулум. Видны гранулы гликогена, длинные митохондрии, центриоли и реснички. Фибриллы могут объединяться в пучки различной толщины и длины. Иммуногистохимически как в цитоплазме клеток, так и в их отростках выявлен маркерный белок — фибриллярный кислый белок глии.
Фиброзные астроциты содержат мало митохондрий и больше микрофиламентов, чем протоплазматические астроциты.
Отростки протоплазматических астроцитов более короткие и толстые. Простираются они во внутреннем плексиформном слое. Их ядра различного размера и содержат грубые зерна гетерохроматина. Как тела клеток, так и их отростки располагаются только в слое нервных волокон сетчатки. Причем морфология клеток изменяется в различных участках сетчатки. Вблизи диска зрительного нерва их отростки исключительно длинные, а по периферии клетки принимают звездчатую форму с одинаковой длины более короткими отростками. Астроциты отсутствуют в области желтого пятна и зубчатой линии. Вообще, число астроцитов коррелирует с толщиной слоя нервных волокон сетчатки, в котором разветвляются их отростки.
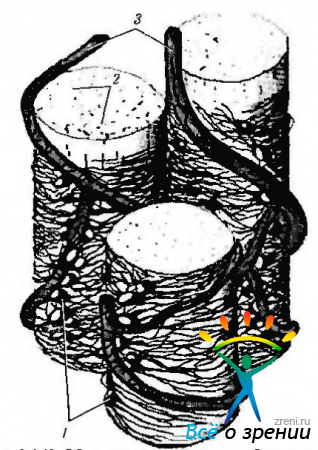
Астроциты охватывают, особенно при проникновении в склеральный канал, аксоны ганглиозных клеток, формируя вокруг них футляр (рис. 3.6.42).
Рис. 3.6.42. Объемное схематическое изображение взаимоотношения астроцитов с пучками аксонов ганглиозных клеток и кровеносными сосудами в слое нервных волокон сетчатки: 1 - астроциты; 2 — аксоны ганглиозных клеток; 3 — кровеносные сосуды
Особенностью астроцитов является и то, что они контактируют с кровеносными сосудами, образуя при этом щелевые контакты, расположенные на их ножках. Между собой они соединяются при помощи щелевых контактов и зон слипания. Предполагают, что это взаимодействие обеспечивает функционирование гематоэнцефалического барьера.
Подобно мюллеровским клеткам, астроциты обеспечивают нейроны глюкозой и участвуют в поддержании ионного состава межклеточной жидкости. Кроме того, астроциты поддерживают нормальный уровень метаболизма нейромедиаторов.
Одной из основных функций астроцитов является защитная функция. При повреждении ткани сетчатки астроциты подвергаются гипертрофии и размножаются, образуя глиальный рубец. Процесс регуляции пролиферативной активности астроцитов в норме и при патологичесих состояниях (глаукома) как сетчатки, так и зрительного нерва находится под контролем эндотелина-1.
Олигодендроциты. Классические формы олигодендроглиальных клеток свойственны зрительному нерву. В сетчатке большинства позвоночных животных клетки, напоминающие олигодендроциты, располагаются в слое ганглиозных клеток. В сетчатке человека этот тип клеток рядом исследователей не выделяется. Тем не менее некоторые исследователи на основании общности функции мюллеровских клеток и клеток олигодендрогии считают эти клетки близкими по происхождению.
Олигодендроциты позвоночных являются самыми мелкими клетками ганглиозного слоя. Их форма округлая или овальная. Ядрышко небольшое и расположено в центре ядра. Для клеток этого типа характерно расположение группами по 2—3 клетки в непосредственной близости от крупных нейронов. Именно поэтому их количество существенно возрастает при увеличении концентрации нейронов. Среди клеток редко встречаются митозы.
Как и остальные глиальные элементы сетчатой оболочки, олигодендроциты образуют единую функционально-метаболическую систему с нейронами сетчатки.
По всей видимости, олигодендроциты, расположенные в слое ганглиозных клеток, не способны к миелогенезу. Появляется эта способность лишь в области диска зрительного нерва при формировании миелиновой оболочки аксонов ганглиозных клеток.
Микроглия . Микроглия складывается из маленьких клеток (до 30 мкм), имеющих мезодермальное происхождение. В ганглиозном слое у всех позвоночных микроглиоциты часто являются сателлитами нейронов, а свои цитоплазматические отростки посылают к капиллярам, оплетая их.
Различают два типа микроглиальных клеток. Один тип клеток мигрирует в сетчатку на наиболее ранних этапах эмбрионального развития вместе с мезенхимой зрительного нерва. Второй тип клеток поступает в сетчатку из кровеносного русла (моноциты) или исходят из перицитов кровеносных сосудов.
Цитоплазма микроглиальных клеток напоминает цитоплазму астроцитов, но при этом в ней меньше гранул гликогена и меньше микрофиламентов. Цитоплазма скудная, а ядро светлое. Отличительной особенностью микроглиальных клеток является насыщение цитоплазмы длинными профилями шероховатой эндоплазматической сети, наличием небольшого количества микротрубочек. В цитоплазме можно также обнаружить многочисленные лизосомы и липофусциновые гранулы.
Клетки микроглии распределены равномерно во всей толще сетчатой оболочки, но неравномерно по площади сетчатки. Необходимо подчеркнуть, что микроглиальные клетки являются единственным глиальным элементом слоя Хенле в области центральной ямки.
Функции микроглии сетчатки до сих пор полностью не выяснены. По происхождению, форме, топографии и по аналогии с гистиоцитами центральной нервной системы их можно отнести к фагоцитирующим и переваривающим клеткам. В отличие от макроглиальных клеток микроглия не участвует в процессах репарации. После травмы они размножаются и начинают напоминать гистиоциты. При этом они фагоцитируют продукты распада клеточных элементов сетчатки Как и в головном мозге, микроглиальные клетки способны к амебоидному передвижению (трансформируются в макрофаги). Таким образом, основной функцией микроглии является защитная функция. Это особенно четко проявляется при различных патологических состояниях как сетчатой оболочки, так и увеального тракта.
Клетки Мюллера. Мюллеровские клетки являются самыми крупными клетками сетчатой оболочки. Распространяются они от наружной пограничной мембраны до внутренней пограничной мембраны. Средняя плотность мюллеровских клеток примерно равна 8000—13 000 клеток в мм2.
В эмбриональном периоде мюллеровские клетки возникают из внутреннего слоя зрительного бокала в два этапа. На самых ранних этапах нейроэпителиальные клетки края глазного бокала, смежные с клетками будущего пигментного эпителия сетчатки, образуют первичные нейроны (колбочки, горизонтальные клетки и ганглиозные клетки). Второй этап развития нейроэпителиальных клеток приводит к образованию палочек, биполярных, амакриновых клеток, а также мюллеровских клеток. Все развивающиеся нейроны и мюллеровские клетки мигрируют к месту своего постоянного расположения. При этом мюллеровские клетки обеспечивают правильную ориентацию, перемещение и жесткое топографическое расположение нейронов в процессе эмбрионального развития сетчатки.
Мюллеровские клетки обладают многочисленными отростками, выполняющими все межклеточные пространства ткани сетчатки и оплетающими тела нейронов.
Различают четыре типа отростков мюллеровской клетки:
- Радиальные отростки, распределяющиеся во внутреннем плексиформном слое.
- Нежные горизонтальные отростки, распространяющиеся в обоих плексиформных слоях, а также в слое нервных волокон.
- Тонкие, волосоподобные отростки, образующие «корзинки» вокруг внутренних сегментов фоторецепторов.
- Отростки, образующие ячеистую сетчатую структуру вокруг тел ганглиозных клеток и клеток внутреннего плексиформного слоя.
Мюллеровские клетки формируют также ножкоподобные окончания на кровеносных сосудах сетчатки большого калибра.
Клетки Мюллера прикрепляются к наружной пограничной мембране при помощи десмосом, а к нейронам при помощи плотных контактов. Между ними не выявлено щелевых синаптических контактов. Цитоплазма мюллеровских клеток неодинакова в различных участках. Эти структурные различия отражают функциональные особенности. Внутренняя половина клетки содержит шероховатую и гладкую эндоплазматическую сеть, аппарат Гольджи, митохондрии, свободные рибосомы и радиально ориентированные филаменты, диаметром 10—20 нм. Наличие перечисленных органоидов предполагает высокий уровень белкового синтеза.
Внешняя, или склеральная, половина клетки приспособлена к поглощению метаболитов (эндоцитоз) и их внутриклеточному транспорту. Вблизи наружной пограничной мембраны видны многочисленные микротрубочки и митохондрии. Вполне вероятно, что эти органоиды обеспечивают клетку энергией, необходимой для активного транспорта метаболитов.
Наружная часть клетки содержит гликоген, количество которого зависит от степени оксигенации сетчатки. Если в экспериментальных условиях уменьшить кровенаполнение сосудов сетчатки, то запас гликогена в клетках быстро истощится. Отмечено, что значительно возрастает количество гликогена в цитоплазме мюллеровской клетки, расположенной на уровне внутреннего синаптического слоя в условиях световой адаптации.
Иммуноморфологически показано, что цитоплазма клеток насыщена промежуточными филаментами, реактивными в отношении винментина и глиального фибриллярного кислого белка. Последние два компонента можно обнаружить в норме только во внутренней части тела клетки. После травмы или отслойки сетчатой оболочки они распределяются по всему телу клетки.
Какова основная роль мюллеровской клетки? Для того чтобы выяснить ее, необходимо напомнить особенности кровоснабжения сетчатки. Микроциркуляторная сеть сетчатки располагается с внутренней и наружной поверхностей сетчатки, вне нервных слоев ее. Капилляры не проникают внутрь сетчатки. Более того, наружная треть сетчатки обеспечивается питательными веществами сосудистой оболочкой путем диффузии. В этих условиях основным трофическим путем становится система капилляр — глиальная клетка — нейрон. В этой системе центральную роль играет мюллеровская клетка. О высокой метаболической активности клеток Мюллера и возможной их роли в метаболизме медиаторов свидетельствуют данные гистохимии. Иммуногистохимическими исследованиями выявлено наличие в цитоплазме глютамина, таурина и глютамин синтетазы. Обнаружена также матричная РНК ангидразы 11, обеспечивающей буферные свойства межклеточного пространства сетчатки. Мюллеровские клетки сетчатки крысы, культивированные in vitro, содержат матричную РНК инсулина, контролирующую метаболизм глюкозы. Недавно показано, что клетки Мюллера могут синтезировать ретиноидную кислоту.
Одной из наиболее важных функций мюллеровской клетки является разрушение нейромедиаторов.
В электрофизиологических экспериментах доказано, что мюллеровские клетки генерируют медленный компонент электроретинограммы. При этом мюллеровская клетка играет роль К электрода. Ионы К, высвобождаемые в результате деятельности нейронов сетчатки (в основном, биполярных клеток), концентрируются на поверхности мюллеровских клеток, затем проникают в их цитоплазму, что приводит к деполяризации мембраны. Этот процесс и является причиной формирования b-волны (медленный компонент) электроретинограммы. Интересно, что потенциалы мюллеровских волокон регистрируются лишь в толще внутреннего синаптического слоя, т. е. в районе основного источника ионов калия и именно там, где концентрируется основная масса синапсов. Исходя из изложенного выше, видно, что мюллеровские клетки выполняют довольно разнообразные и важные функции. К ним можно отнести следующие:
- Поставка нейронам сетчатки продуктов распада гликогена, необходимых для аэробного метаболизма.
- Выведение продуктов обмена нейронов (углекислого газа, аммиака, продуктов обмена аминокислот).
- Защита нейронов от избыточного высвобождения нейромедиаторов.
- Фагоцитоз продуктов распада нейронов при патологических состояниях.
- Синтез ретиноидной кислоты из ретинола, имеющей большое значение в развитии сетчатки, центральной нервной системы, а также метаболизма зрительного пигмента.
- Защита нейронов путем контроля гомеостаза ионов, акцептируя внеклеточно расположенные ионы кальция и перераспределяя их.
Нарушение функции мюллеровских клеток связывают с развитием многих заболеваний, в частности старческого и связанного с Х-хромосомой юношеского ретиношизиса.
Глиальные клетки активно участвуют в процессах репарации при повреждении сетчатки. Путем иммунной гистохимии установлено, что мюллеровские клетки сетчатки крысы реагируют на повреждение, подобно астроцитам мозга, путем накопления кислого фибриллярного белка, играющего большую роль в процессах фибриллогенеза. Накопление этого белка отмечено у людей в условиях реактивного глиоза сетчатки.
Дополнительная глия. В сетчатке выявлены клетки, лишь отдаленно напоминающие астроциты, но не обладающие всеми их структурными признаками. Поскольку они тесно прилежат к ганглиозным клеткам, эти клетки были названы параганглиозными клетками (название схожее с перинейрональными клетками центральной нервной системы). По всей видимости, они выполняют трофическую функцию по отношению к ганглиозным клеткам.
Продолжение в следующей статье: Сетчатка ? Часть 4
----
Статья из книги: Строение зрительной системы человека | Вит В. В.



Комментариев 0