Вторичная глаукома ? Часть 2

Содержание:
Описание
↑ Дистрофическая глаукома
Дистрофические изменения в глазу представляют собой часть глаукоматозного процесса при всех его формах и разновидностях. В связи с этим выделение дистрофической глаукомы в отдельную группу в значительной степени условно. В эту группу отнесены те формы глаукомы, при которых дистрофические изменения играют решающую роль в генезе повышения ВГД.
Отслойка сетчатки и глаукома. Регматогенная отслойка сетчатки обычно сопровождается гипотонией глаза. Однако и вторичная глаукома при этом заболевании описана неоднократно [Нестеров А. П., 1955; Phelps С. D., Burton Т. С., 1977]. Заболевание возникает только на той стороне, на которой поражена сетчатка, и развивается по типу первичной ОУГ. Патогенез глаукомы у таких больных неясен. В некоторых случаях возникновению отслойки сетчатки предшествовала травма глаза и глаукому можно было бы рассматривать как травматическую. Однако у большинства больных с глаукомой и отслойкой сетчатки в анамнезе не было травмы, УПК был открыт и в нем не обнаруживали каких-либо дефектов, кроме пигментации трабекулы. После успешной операции по поводу отслойки сетчатки ВГД постепенно нормализовывалось [Phelps С. D., Burton Т. С., 1977]. Возможно, причиной повышения ВГД служит отложение в трабекуле гранул пигмента, клеток, крупных белковых молекул и фагоцитов, проникающих в полость стекловидного тела и затем в переднюю камеру из хориоидальной тканевой жидкости и пигментного эпителия через разрыв сетчатки. Закрытие разрыва после успешной операции приводит к прекращению этого процесса, и трабекулярная система постепенно очищается.
Вторичную глаукому при отслойке сетчатки следует дифференцировать от первичной ОУГ, которая при этом заболевании встречается значительно чаще (в 4—6%), чем в общей популяции [Phelps С., Burton Т. С., 1977]. В таких случаях правильный диагноз устанавливают после исследования второго глаза или на основании данных анамнеза.
Вторичная преходящая ЗУГ может возникнуть как следствие операции по поводу отслойки сетчатки. Вдавление склеры в заднем отделе глаза приводит к уменьшению глубины передней камеры и сужению ее угла, а у части больных и к его блокаде. Это осложнение особенно часто наблюдается при исходной мелкой передней камере и афакии. Через несколько дней или недель передняя камера восстанавливается, и глаукома разрешается. С целью снижения ВГД рекомендуется место применять адреналин, тимолол, клофелин, а для предупреждения образования синехий — кортикостероиды.
Иридокорнеальный эндотелиальный синдром (ИЭС). ИЭС включает в себя прогрессирующую атрофию радужки, синдром Чандлера [Chandler Р., 1956] и синдром Когана — Риза [Cogan D., Reese А., 1969].
Для всех разновидностей ИЭС характерны неполноценность роговичного эндотелия, атрофия радужки, образование тонкой мембраны и гониосинехий в УПК. Болезнь, как правило, поражает один глаз. Изменения эндотелия заключаются в нарушении формы, нечеткости границ, появлении дефектных клеток. Отек роговицы развивается не всегда (чаще при синдроме Чандлера), и степень его выраженности варьирует от легкой до булезной кератопатии. Изменения радужки также вариабельны. При прогрессирующей атрофии радужки строма истончается настолько, что образуются сквозные дефекты в ее ткани, одновременно наблюдаются смещение зрачка (корэктопия) и выворот пигментного листка по краю зрачка (рис. 54).
Рис. 54. Выворот пигментного листка радужки, атрофия стромы, сквозной дефект радужки в глазу с прогрессирующей атрофией радужки.
При синдроме Чандлера атрофия радужки выражена значительно слабее, смещение зрачка незначительное, щели и отверстия в радужке отсутствуют. В глазах с синдромом Когана — Риза степень атрофии радужки варьирует в широких пределах, возможно образование сквозных отверстий. Основной отличительный признак этой формы болезни — образование мелких пигментных невусов или диффузной пигментации поверхности радужки.
При гистологическом исследовании в отдельных участках УПК при всех разновидностях ИЭС обнаруживают десцеметоподобную мембрану, покрытую одним слоем роговичного эндотелия. Образование гониосинехий также характерно для всех разновидностей ИЭС, но особенно часто наблюдается при прогрессирующей атрофии радужки. Повышение ВГД вызвано образованием гониосинехий и эндотелиальной мембраны в УПК.
Патогенез ИЭС не установлен. Наибольшим признанием пользуется концепция, разработанная D. Campbell и соавт. (1978). По их мнению, в основе болезни лежат эндотелиальные нарушения. Роговичный эндотелий обрастает угол передней камеры и распространяется на радужку. Сокращение эндотелиальной мембраны приводит к закрытию УПК, образованию гониосинехий, деформации и смещению зрачка, вывороту пигментного листка, растяжению радужки в отдельных сегментах. Определенную роль в происхождении атрофии радужки играет также ее ишемия.
[banner_centerrs] {banner_centerrs} [/banner_centerrs]
Описаны случаи глаукомы и при других поражениях роговичного эндотелия, в частности при эндотелиально-эпителиальной дистрофии Фукса и задней полиморфной дистрофии роговицы. Глаукома обычно протекает по типу открытоугольной, но возможно и образование гониосинехий.
Лечение вторичной глаукомы при поражении роговичного эндотелия такое же, как и при первичной ОУГ или хронической ЗУГ: гипотензивные препараты, хирургическая операция. При выраженных явлениях кератопатии Фукса производят сквозную кератопластику, межслойную имплантацию передней капсулы хрусталика. Для устранения болевого синдрома назначают мягкие контактные линзы.
Первичный системный амилоидоз и гемолитическая глаукома. Первичный системный амилоидоз — наследственное заболевание, характеризующееся отложением амилоида в различных органах, в том числе в веках и орбите. К глазным проявлениям этой болезни относят экзофтальм, косоглазие, анизокорию, внутреннюю офтальмоплегию, периваскулит сосудов сетчатки и вторичную глаукому. Причиной ухудшения оттока водянистой влаги из глаза и повышения ВГД служит отложение амилоида в трабекулярной системе [Tsukochara S., Matsuo Т., 1977]. Заболевание протекает по типу открытоугольной глаукомы. Лечение такое же, как и при первичной ОУГ.
Гемолитическая глаукома развивается после обширных кровоизлияний в стекловидное тело, вызванных сосудистыми изменениями (гипертоническая болезнь, диабет, болезни крови, окклюзия ЦВС и др.) или травмой. Особенности этой формы глаукомы рассмотрены в следующем разделе этой главы.
↑ Травматическая глаукома
Травматическая глаукома может быть вызвана механическим, химическим и радиационным повреждениями глаза. Причины повышения ВГД неодинаковы в разных случаях: внутриглазные кровотечения (особенно часто гифемы), повреждения структур угла передней камеры, блокада дренажной системы глаза сместившимся хрусталиком или продуктами его распада, химическое или радиационное повреждение эпи- и интрасклеральных сосудов. Существенную роль могут играть также последствия травматического увеита.
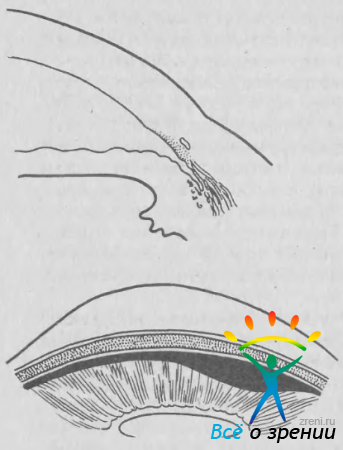
Внутриглазные кровотечения. Наиболее частой причиной геморрагий при тупой травме глаза служит разрыв переднего отдела цилиарного тела по линии, разделяющей продольные и радиальные волокна ресничной мышцы. Причиной разрыва служит резкое смещение кзади хрусталика и радужки в момент удара (рис. 55).
Рис. 55. Рецессия УПК после тупой травмы глаза (схема).
При этом разрываются артериальные веточки, идущие к радужке и мышце от большого круга кровообращения, расположенного в этой зоне. Повышение ВГД вызывает остановку кровотечения, однако через 2—5 дней оно нередко вновь возобновляется. Этому способствуют частичный лизис и ретракция кровяного сгустка, а также снижение ВГД. Повторное кровотечение может быть более значительным, чем первичное. В некоторых случаях возникает» тотальная гифема, занимающая всю переднюю камеру («черный глаз»), эритроциты проникают в строму роговицы и окрашивают ее, ВГД резко повышается, возникает болевой синдром. Повышение офтальмотонуса в таких случаях вызвано пропитыванием трабекулярного аппарата форменными элементами крови и продуктами их распада, иногда блокадой зрачка кровяным сгустком.
Профилактика острой глаукомы после тупой травмы заключается в предупреждении повторных кровотечений. Назначают постельный режим, бинокулярную повязку, аскорбиновую кислоту, рутин, аминокапроновую кислоту, дицинон в течение 5 дней. Медикаментозное лечение уже возникшей острой глаукомы заключается в назначении осмотических средств (глицерол или маннитол), диакарба и местном применении тимолола или клофелина.
Показаниями к хирургическому лечению служат сильные боли, высокий уровень ВГД, окрашивание кровью роговицы, отсутствие признаков рассасывания гифемы. Следует иметь в виду, что удаление гифемы в первые дни после травмы опасно из-за возможности повторного кровотечения. Наилучшие результаты дает операция, выполненная на 4—5-й день после кровотечения. В это время происходит максимальное сокращение сгустка крови, а слипание его с окружающими тканями выражено слабо.
Операция заключается в парацентезе роговицы и удалении крови с помощью ирригации или ирригации-аспирации. В тех случаях, когда сгусток склеен с тканями, его удаление связано с определенными трудностями. Наименее травматичная процедура заключается в следующем. Производят два парацентеза. Через один из них в переднюю камеру под небольшим давлением вводят гиалон, который отстаивает кровяной сгусток от тканей. Затем сгусток выходит из другого разреза самопроизвольно или его удаляют с помощью шпателя.
Кровоизлияния в стекловидное тело также могут быть причиной развития вторичной гемолитической глаукомы через несколько недель или месяцев после травмы. В таких случаях трабекулярный фильтр забивается «теневыми» клетками крови.
«Теневые» клетки (Ghost cells) представляют собой дегенеративно-измененные эритроциты, потерявшие эластичность и гемоглобин. Они имеют слегка буроватый цвет (цвет хаки) и сферическую форму.
Дегенерация эритроцитов заканчивается через 2—3 нед после кровоизлияния. Измененные «теневые» эритроциты сохраняются в стекловидном теле на протяжении многих месяцев. Если гиалоидная мембрана повреждена, то «теневые» клетки выходят в переднюю камеру. В отличие от нормальных эритроцитов они не могут пройти через трабекулярную сеть и, откладываясь в ней, забивают трабекулярные щели и поры, обычно в средних и наружных трабекулярных слоях.
Лечение такое же, как и при первичной открытоугольной глаукоме. При его недостаточной эффективности производят промывание передней камеры, иногда — витрэктомию.
Прогноз благоприятный, так как после истощения запаса «теневых» клеток в стекловидном теле отток водянистой влаги и ВГД нормализуются.
Смещение и повреждение хрусталика. Травматическая дислокация хрусталика нередко приводит к повышению ВГД. Вывих хрусталика в переднюю камеру особенно опасен, так как сопровождается блокадой угла передней камеры, резким повышением офтальмотонуса и повреждением эндотелия роговицы, поэтому удаление вывихнутого хрусталика не следует откладывать. Вывихнутый в стекловидное тело хрусталик с неповрежденной капсулой не может вызвать повышения ВГД. Если офтальмотонус все же повышен, то это связано с другими последствиями травмы глаза. То же можно сказать и о подвывихе хрусталика. При любом смещении последнего создаются условия для появления грыжи стекловидного тела и возникновения зрачкового блока. В таких случаях противопоказаны миотики, так как сужение зрачка и ущемление в нем витреальной грыжи усиливают зрачковый блок. Наоборот, расширение зрачка может устранить его блокаду. При недостаточной эффективности мидриатиков показана Витрэктомия или Витрэктомия в сочетании с ленсэктомией.
При повреждении капсулы хрусталика происходит набухание хрусталиковых волокон. Резкое увеличение объема хрусталика в предрасположенных глазах может привести к острому приступу глаукомы. Возможен и другой механизм повышения ВГД при значительном повреждении капсулы хрусталика. Частицы распадающихся хрусталиковых волокон и макрофаги забивают трабекулярный фильтр и нарушают отток водянистой влаги. Хирургическое удаление хрусталиковых масс приводит к нормализации офтальмотонуса.
Травматическая рецессия угла передней камеры. Тупая травма глаза иногда сопровождается повреждением трабекулярной диафрагмы. Надрывы и разрывы трабекулы в последующем рубцуются, что может служить причиной повышения ВГД.
Значительно чаще глаукома ассоциируется с рецессией УПК. Этим термином обозначают уже упоминавшийся выше разрыв, как бы расщепление переднего отдела ресничного тела по линии, разделяющей продольные и радиальные волокна цилиарной мышцы. Причиной разрыва, по-видимому, служит резкое смещение кзади хрусталика и радужки в момент удара. Глаз сдавливается в переднезаднем направлении. Одновременно увеличивается поперечный диаметр глазного яблока. При этом прочно связанные со склеральной шпорой продольные волокна цилиарной мышцы отрываются от радиальных волокон, с которыми они соединены только рыхлой тканью.
В результате рубцовых процессов рецессия постепенно становится менее заметной или полностью облитерируется. В поврежденной зоне УПК могут возникнуть задние синехии, маскирующие зону рецессии.
При травматической рецессии УПК глаукома развивается через несколько лет (10—20 лет) после травмы и только в небольшой части случаев. По-видимому, травма служит лишь одним из факторов риска возникновения болезни, которая протекает по типу первичной открытоугольной или смешанной глаукомы. Следует отметить, что в большинстве таких случаев кортикостероидная проба также дает положительный результат, как и при первичной ОУГ [Armaly М., 1967]. Для установления диагноза имеют значение травма глаза в анамнезе, односторонний характер глаукомы глубокая передняя камера или ее неравномерная глубина, обрывки гребенчатой связки в углу камеры, заднее прикрепление корня радужки, расширенная склеральная шпора. Лечение такое же, как и при первичной глаукоме.
Другие разновидности травматической глаукомы. Вторичная закрытоугольная глаукома, возникающая после проникающих ранений глаза, может быть следствием травматического увеита, образования гониосинехий, сращения и заращения зрачка, развития набухающей катаракты. Одно из последствий сидероза и халькоза заключается в развитии дегенеративных изменений в трабекулярном аппарате глаза. При достаточной выраженности таких изменений может возникнуть вторичная ОУГ [Гундорова Р. А., Степанов А. В., 1985].
Химические, особенно щелочные, ожоги часто приводят к развитию временной глазной гипертензии или глаукомы. Гипертензия, возникающая в ранней фазе после ожога, вызвана поступлением в глаз продуктов воспаления, прежде всего простагландинов; имеет значение также повреждение склеральных и эписклеральных сосудов. Во второй, репаративной, фазе, длительность которой составляет несколько недель или даже месяцев, глаукома ассоциируется с образованием гониосинехий, органическим зрачковым блоком, набухающей катарактой и поражением дренажной системы глаза. В поздней послеожоговой фазе глаукома является следствием рубцовых и спаечных процессов.
В первых двух фазах гипотензивный эффект может дать сочетание противовоспалительных средств с препаратами, уменьшающими продукцию водянистой влаги (тимолол, клофелин, диакарб). Миотики противопоказаны, так как они могут усиливать экссудацию и способствовать образованию задних синехий и заращению зрачка. В некоторых случаях показаны оперативные вмешательства — удаление набухающей катаракты, иридэктомия при выраженном зрачковом блоке. В поздней фазе могут быть применены миотики. Если сохранилась нормальная конъюнктива в верхнем сегменте глаза, то производят фистулизирующую операцию. В противном случае ограничиваются циклокриокоагуляцией.
Глаукома открытоугольного типа может развиться после радиационной терапии опухолей глаза или орбиты. Болезнь часто сочетается с конъюнктивальными телеангиэктазиями, а в более тяжелых случаях — с рубеозом радужки и внутриглазными геморрагиями. Для лечения могут быть использованы и консервативные, и хирургические методы лечения, но часто они дают неудовлетворительные результаты [Бровкина А. Ф. и др., 1991].
Р. А. Гундорова и А. В. Степанов (1985) описали глаукому, возникающую после травмы в отсутствие каких-либо изменений в глазу, — «неотягощенная травматическая глаукома». Они объясняют ее возникновение повреждением склеральных дренажных путей или манифестацией первичной латентной глаукомы.
↑ Послеоперационная глаукома
Операции на глазном яблоке и орбите могут осложняться временным или постоянным повышением ВГД. Наиболее часто причинами вторичной послеоперационной глаукомы служат экстракция катаракты, кератопластика, оперативные вмешательства по поводу отслойки сетчатки и первичной ЗУГ.
Вторичная афакическая глаукома. После экстракции катаракты нередко возникает временное повышение ВГД или развивается вторичная афакическая глаукома. Реактивная гипертензия глаза, вызванная операционной травмой, сохраняется от нескольких часов до 2—3 дней. Более стойкое повышение офтальмотонуса и глаукома могут возникнуть в ранние сроки после операции и в отдаленном периоде. Ранняя афакическая глаукома обычно бывает следствием операционных и послеоперационных осложнений, таких как ущемление в ране или роговичное предлежание стекловидного тела, блокада пузырьком воздуха, экссудатом или стекловидным телом зрачка и колобомы радужки, образование гониосинехий. Ранняя афакическая ОУГ может возникнуть в результате рецидивирующей гифемы при грыжах и предлежании стекловидного тела, прямом повреждении дренажной системы глаза при чрезмерно заднем положении склерального разреза во время экстракции катаракты. Вместе с тем рассечение десцеметовой оболочки кпереди от кольца Швальбе вызывает расслабление трабекулярной мембраны, в результате чего увеличивается риск возникновения функциональной блокады склерального синуса. После экстракапсулярной экстракции катаракты возможна блокада интратрабекулярных щелей и отверстий распадающимися остатками хрусталиковых волокон, а после интракапсулярной экстракции с применением химотрипсина — фрагментами зоннулярной связки. Следует отметить, что артифакия не увеличивает риск возникновения глаукомы после экстракции катаракты.
Лечение глаукомы в таких случаях должно быть направлено не только на снижение ВГД с помощью гипотензивных средств, но и на устранение основной причины глаукомы: зрачкового блока, стекловидного тела из передней камеры, остатков хрусталиковых масс.
В более позднем периоде к вторичной ОУГ могут привести рубцовые изменения в дренажной области склеры, дистрофические изменения в трабекулярной системе в зоне операции, отложение в ней пигмента и «теневых» эритроцитов. Поздняя ЗУГ может быть следствием сращения и заращения зрачка, колобомы радужки и гониосинехий. Резкое повышение ВГД и клиническая картина, напоминающая острый приступ глаукомы, наблюдаются при цилиовитреальном блоке (злокачественная глаукома). Наконец, нужно иметь в виду, что возрастная катаракта и первичная ОУГ развиваются в одном и том же возрасте. Первичная ОУГ может предшествовать операции по поводу катаракты или возникнуть спустя некоторое время после нее.
Лечение глаукомы в афакических глазах имеет некоторые особенности. При зрачковом блоке производят лазерную или хирургическую дополнительную иридэктомию. Зрачковая мембрана может быть перфорирована импульсным ИАГ-лазером. При хронической закрытоугольной глаукоме производят циклодиализ или иридоциклоретракцию. Операцию выполняют в верхнем сегменте, если экстракция катаракты была произведена через роговичный разрез, и в нижнем сегменте при лимбальном разрезе.
При ОУГ назначают медикаментозное лечение. В случае недостаточно выраженного гипотензивного эффекта производят лазерную трабекулопластику или хирургическую операцию. Выбор операции зависит от конкретного случая и опыта хирурга. Мы предпочитаем производить фильтрующую иридоциклоретракцию, трабекулэктомию или клапанную трабекулотомию. Некоторые авторы рекомендуют циклодиализ. Лечение афакической злокачественной глаукомы рассматривается в главе 13.
Кератопластика и глаукома. Частота возникновения глаукомы после проникающей кератопластики варьирует от 10 до 40% [Thoft R. A. et al., 1974; Polack F. М., 1980]. Послеоперационная глаукома служит одной из основных причин помутнения трансплантата, а затем и атрофии зрительного нерва. Различия в частоте развития глаукомы после кератопластики зависят от особенностей контингента больных, техники операции и размера трансплантата. Глаукома особенно часто возникает в афакических глазах, а также после выполнения кератопластики в сочетании с экстракцией катаракты. Риск развития глаукомы повышается с увеличением размеров ложа реципиента и трансплантата. Вместе с тем частота глаукомы уменьшается, если размеры трансплантата превышают диаметр ложа на 0,2—0,5 мм, и увеличивается при тугом стягивании несквозными швами краев роговиц донора и реципиента. Лучший результат получен при использовании сквозных швов с короткими стежками [Zimmerman Т. J. et al., 1979; Perl Т. et al., 1981].
Механизм возникновения глаукомы после кератопластики не вполне ясен. Повышение ВГД в части случаев связано с увеитом, зрачковым блоком, гониосинехиями. Однако чаще глаукома возникает без какой-либо видимой причины. R. J. Olson и Н. Е. Kaufman (1978) полагают, что рассечение десцеметовой оболочки по всей окружности лишает трабекулярную диафрагму опоры спереди. Это приводит к ее расслаблению и коллапсу. В свете данных о блокаде склерального синуса можно предположить, что расслабление трабекулярной мембраны приводит к коллапсу синуса. В афакических глазах эта тенденция усиливается из-за ослабления поддержки трабекулярной мембраны не только спереди, но и сзади.
Одним из факторов риска после кератопластики является сужение УПК. Сужение выражено тем больше, чем туже стягивают края роговицы реципиента и трансплантата и чем меньше диаметр трансплантата по сравнению с диаметром ложа [Olson R. J., Kaufman Н. Е., 1978]. Наложение сквозных швов на роговицу реципиента и трансплантат уменьшает неблагоприятное влияние рассечения десцеметовой оболочки на трабекулярную диафрагму.
Лечение глаукомы, возникающей после кератопластики, — трудная задача для врача. Обычно медикаментозное лечение бывает недостаточно эффективным. Операции фистулизирующего типа часто приводят к помутнению трансплантата. В афакических глазах может быть рекомендован циклодиализ. Наиболее безопасной процедурой является циклокриокоагуляция, которую при необходимости можно производить повторно.
Послеоперационная глаукома с витреальным и витреохрусталиковым блоками. Передний витреальный блок может возникнуть после экстракции катаракты или других внутриглазных операций на афакическом глазу. Предрасполагающими факторами являются малые размеры глазного яблока, мелкая передняя камера, узкий УПК, повышенная плотность и низкая проницаемость передней гиалоидной мембраны стекловидного тела.
По невыясненным причинам витреальная жидкость скапливается в заднем сегменте глаза, что при низкой проницаемости гиалоидной мембраны ведет к возникновению значительного градиента давлений между стекловидным телом и передней камерой глаза, смещению стекловидного тела и радужки кпереди и блокаде УПК. Возникает перманентный, острый приступ глаукомы, характеризующийся болевым синдромом, светобоязнью, слезотечением, инъекцией сосудов глазного яблока, отеком роговицы, щелевидной передней камерой и высоким уровнем ВГД.
Медикаментозное лечение только в редких случаях и лишь временно купирует приступ. Своевременно проведенное хирургическое лечение позволяет полностью купировать приступ и предупредить его рецидивы. Промедление с операцией приводит к образованию гониосинехий. В таких случаях исход хирургического лечения может оказаться неблагоприятным.
Послеоперационная глаукома с витреохрусталиковым блоком иногда возникает как тяжелое осложнение после фистулизирущих операций, особенно выполненных на глазах с первичной ЗУГ. Клиническая картина, диагностика и лечение такие же, как и при первичной ЗУГ с витреохрусталиковым блоком.
↑ Неопластическая глаукома
Глаукома при внутриглазных опухолях. Внутриглазные новообразования нередко приводят к нарушению гидродинамического равновесия в глазу с повышением или понижением ВГД. Понижение офтальмотонуса обычно связано с нарушением секреторной функции цилиарного тела токсического или воспалительного генеза. Глаукома чаще развивается в поздней стадии болезни и более характерна для передней локализации опухоли в зоне цилиарного тела и радужки. В одних случаях механизм развития глаукомы заключается в смещении кпереди иридохрусталиковой диафрагмы, возникновении относительного зрачкового блока и блокады угла передней камеры корнем радужки. При этом развивается симптоматика, характерная для острого или подострого приступа глаукомы. В других случаях повышение ВГД вызвано распространением опухоли на структуры УПК, отложением в трабекулярной сети опухолевых клеток, макрофагов и продуктов опухолевого некроза, образованием гониосинехий. У таких больных возможно и острое, и хроническое течение глаукомы. Наиболее частой причиной опухолевой глаукомы служат меланобластомы, реже — вторичные метастатические опухоли, ретинобластомы, медуллоэпителиомы. Диагностика глаукомы в подобных случаях не вызывает затруднений. Значительно важнее и сложнее определить ее этиологию. Лечение, как правило, заключается в энуклеации. Органосохранное лечение при внутриглазных опухолях, сопровождающихся глаукомой, в большинстве случаев неэффективно и опасно для жизни больного.
Новообразования орбиты, тиреотропный экзофтальм. Повышенное давление в орбите, чем бы оно не было вызвано, передается на орбитальные, а затем и эписклеральные вены. На уровень ВГД влияют также застой крови и утолщение сосудистой оболочки глаза, прямое давление на глаз орбитального содержимого и экстра окулярных мышц.
При тиреотропном экзофтальме ВГД меняется в зависимости от положения глаза: оно максимальное при взгляде кверху и минимальное при взгляде книзу. Атрофия зрительного нерва при орбитальной патологии может быть следствием как повышенного ВГД, так и прямого давления новообразования на нерв.
----
Статья из книги: Глаукома. Нестеров А.П.



Комментариев 0