Оксид азота в наружном синаптическом слое сетчатки позвоночных

Описание
Известно, что оксид азота (NO) играет важную роль в работе нервной системы. Гистохимические и иммуноцитохимические эксперименты с использованием NADPH-диафоразы показали, что NO-синтаза - фермент, образующий оксид азота из L-аргинина широко распространен в разных отделах мозга позвоночных. В сетчатке NO-синтаза была обнаружена в разных слоях: в эллипсоидах фото эецепторных клеток, амакриновых клеток, в мюллеровских клетках, в горизонтальных клетках, в биполярных клетках.
NO-синтаза, продуцирующая эндогенный оксид азота, является гемсодержащим металлоэнзимсм. Существуют несколько разновидностей NO-синтазы: нейронная (160 кДа), эндотелиальная (135 кДа), индуцируемая (130 кДа) и митохондриальная (127 кДа) Этот фермент является гомодимером, каждый мономер которого содержит сайты связывания кофакторов окислительно-восстановительной реакции: никотинамид-зденин-динуклеотид фосфата (НАДФ-Н), флавин мононуклеотида (ФМН), флавинаденин динуклеотида (ФАД), кальмодулин, тетрагидробиоптерин (Н4Б) и гемовую группу. NO-синтаза катализирует двухстадииную реакцию окисления L-аргинина через N-гидрокси-L-аргинин до цитруллина и NO. Каждый мономер NO-синтазы содержит оксидазный домен, который связывает ген. Н4Б и аргинин, - он расположен в N-конце, и редуктазный домен, который связывает ФАД, ФМН и НАДФ-Н, он расположен в С-конце. Для активности фермента необходимо димерное взаимодействие между двумя оксигеназными доменами, связанными с редуктазными доменами посредством Са2+/кальмодулина, который осуществляет перенос электрона от флавина к гену.
Есть много данных, свидетельствующих о возможной роли оксида азота и в работе различных элементов сетчатки. Так, существуют свидетельства того, что NO может модулировать работу ионных каналов фоторецепторных клеток. Установлено, что оксид азота воздействует на цГМФ-зависимый синаптический ток в оn-биполярных клетках, может активировать цГМФ-зависимый ток катионов в ганглиозных клетчатках сетчатки и в фоторецепторных колбочках. В этих случаях эффект NO, по-видимому, обусловлен активацией растворимой гуанилат-циклазы, так как увеличение концентрации цГМФ вызывает увеличение тока цГМФ-зависимых каналов. Однако в других рецепторных тканях обнаружено также и прямое действие NO на каналы. Таким образом, NO может влиять на величину активации цГМФ-зависимых каналов различными способами. Нами была обнаружена NO-синтазная активность во внутреннем сегменте фоторецепторных клеток. Существуют и другие работы, подтверждающие наличие NO-синтазы в фоторецепторах, а также в биполярных и горизонтальных клетках.
Одной из основных известных функций оксида азота является его способность активировать растворимую гуанилатциклазу и таким образом влиять на концентрацию внутриклеточного цГМФ. В фоторецепторных клетках большая часть гуанилатциклазы является мембрансвязанной, однако в наружных сегментах фоторецепторных палочек быка была обнаружена и растворимая NO-чувствительная фракция. Так как светочувствительная проводимость фоторецепторов прямо зависит от уровня внутриклеточного цГМФ, наличие в фоторецепторных палочках и NO-синтазы и NO- чувствительной гуанилатциклазы свидетельствует о возможной роли оксида азота в фототрансдукции.
Нами было проведено определение активности NO-синтазы в различных слоях сетчатки. Мы попытались выяснить, находится ли этот фермент в нативных фоторецепторах при физиологических условиях в активной форме и способен ли регулировать концентрацию NO. Если же оксид азота синтезируется, может ли он, как это происходит в обонятельных и слуховых клетках, прямо влиять на активацию цГМФ-активируемых каналов?
В ряде экспериментов оксид азота измеряли в срезах сетчатки лягушки. Как известно, морфологически клетки сетчатки распределяются в ней слоями. Таким образом, получая срезы, удавалось выделить относительно гомогенную фракцию, соответствующую тому или иному слою сетчатки. Сетчатка замораживалась на микротомном столике рецепторной стороной вверх, и затем срезались горизонтальные слои: первый и второй срезы толщиной 15 ± 3 мкм каждый (наружные сегменты фоторецепторов) и третий - 25 ± 5 мкм (внутренние сегменты фоторецептсров) Подробнее методы приготовления срезов и контроля полученных препаратов описаны в работах Донцова и др. [1978], Зака и др. [1974].
Образование NO регистрировалось в водорастворимой фракции, полученной из срезов соответствующих слоев сетчатки с помощью NO-селективных электродов (ISO-NO. WPI, диаметр электрода - 2 мм).
Для приготивления водорастворимых фракций белков сетчатки объединяли замороженные срезы из 5-6 сетчаток (отдельно наружные и внутренние сегменты) и проводили экстракцию, инкубируя образцы в течение 10 мин при 24 °С в буфере 10 мМ HEPES, 1 мМ MgCl2, рН 7,4. Водорастворимую фракцию отделяли центрифугированием в течение 1 ч при 20 000 об./мин. Реакция образования оксида азота начиналась после добавления к су- пернатанту 1-500 мкМ субстрата NO-синтазы L-аргинина и эквимолярной концентрации NADPH. Необходимо отметить, что результаты были более стабильными при добавлении 0,5 мкМ кальмодулина. который является кофактором для NO-синтазы.
Концентрация эндогенного оксида азота в интактной сетчатке при физиологических условиях измерялась с помощью NO-селективных микроэлектродов или методом ЭПР. Кончики стеклянных микроэлектродов имели диаметр 50- 100 мкм, они покрывались пленкой ионообменника Nafion (Aldrich), обладающего высокой селективностью к NO по сравнению с N02. Чувствительность микроэлектродов в калибровочных растворах оставалась стабильной, однако довольно сильно изменялась после погружения электрода в ткань сетчатки или клеточную суспензию. Подобные необратимые изменения, наблюдавшиеся также и при использовании коммерческих электродов, могут объясняться адгезией и взаимодействием белков с поверхностью электродов. В связи с этим калибровка электродов всегда производилась до и после измерений, и затем использовалась усредненная калибровочная кривая. Однако это могло послужить источником постоянной ошибки, например, в том случае если необратимые изменения происходили мгновенно в результате контакта электродной поверхности с клетками. Другим источником ошибки могла стать чувствительность электрода, покрытого Nafion, к другим веществам, например, к дофамину. Исходя из этих соображений, оптимальной представляется оценка концентрации N0, основанная на измерении фракции микроэлектродного тока, которая подавляется ингибиторами NО-синтазы.
Во время измерений изолированная сетчатка помещалась фоторецепторной стороной вверх на фильтровальной бумаге в чашку Петри, заполненную раствором Рингера так, чтобы он покрывал сетчатку на 2-3 мм. Микроэлектрод опускался вертикально с помощью пошагового манипулятора (Narishige) до момента соприкосновения с поверхностью, затем погружался еще на 60-100 мкм внутрь сетчатки - на этом уровне и производилось измерение тока.
Другим удобным методом измерения эндогенной концентрации оксида азота оказался метод ЭПР. Для измерения концентрации N0 использовалась спиновая ловушка - комплекс эндогенного железа (Fе2+) с экзогенным лигандом - диэтилдитиокарбаматом (ДЭТК). Связывание N0 с этими ловушками приводит к образованию парамагнитных мононитрозильных комплексов железа с ДЭТК (МНКЖ-ДЭТК), регистрируемых методом ЭПР. Оценка интенсивности сигнала ЭПР этих комплексов позволяет судить о синтезе N0 в биосистеме, катализируемой NО-синтазой. МНКЖ-ДЭТК обладает гидрофобными свойствами, и поэтому в живых тканях он накапливается в клеточных мембранах. Основное преимущество такого метода состоит в том, что он позволяет измерять внутриклеточную концентоацию NO in vivo интактной сетчатке.
Для введения ловушки сетчатки инкубировались 20 мин в темноте в 1 мл стандартного раствора Рингера с добавлением ДЭТК в концентрации 0,5 мМ при температуре 4 °С. Сетчатки осторожно промывались в новой порции раствора Рингера и инкубировались 5 мин в 1 мл раствора Рингера с добавлением I мкМ супероксид дисмутазы в темноте при температуре 27 °С. Иногда в конце инкубирования в раствор на 2 мин добавлялся дисульфид натрия в концентрации 20 мМ для того, чтобы убрать эндогенный Сu2+, который также формирует парамагнитный комплекс с ДЭГК, который дает сигнал ЭПР со сверхтонкой структурой (СТС), частично перекрывающей сигнал МНКЖ ДЭТК. После этого каждая сетчатка замораживалась на микротомном столике для приготовления срезов наружных и внутренних сегментов фоторецепторов, как это было описано выше. Соответствующие срезы ~20 сетчаток хранились в жидком азоте до измерений.
Отсутствие токсичности ДЭТК проверялось по изменению параметров b-волны электроретинограммы. Так, добавление в перфузионный раствор ДЭТК в концентрации 0,5 мМ приводило к временному увеличению максимального фотоответа и следующего за этим уменьшением амплитуды не более чем на 20%.
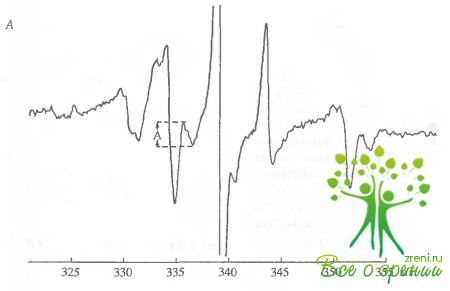
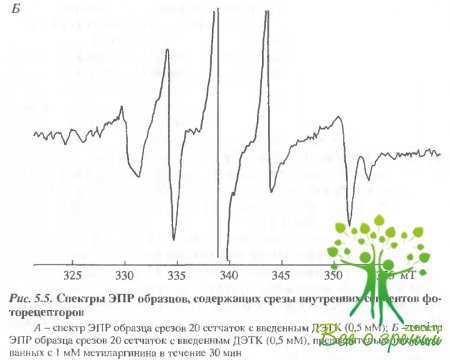
В предварительных экспериментах определялось, распределение NO-ловушки в целой сетчатке. После обычной процедуры инкубирования с ДЭТК сетчатка погружалась в раствор с насыщенным содержанием NO, и затем методом ЭПР измерялась концентрация комплекса МНКЖ-ДЭТК в равных слоях сетчатки. После насыщения N0 во всех слоях сетчатки регистрировался спектр ЭПР, представляющий собой сумму сигналов ЭПР МНКЖ-ДЭТК и комплексов Сu2+-ДЭТК. Об интенсивности сигнала ЭПР МНКЖ-ДЭТК в этом сложном спектре можно было судить по интенсивности его компоненты А, не перекрывающейся сигналом Сu2+-ДЭТК. Эта компонента А хорошо видна на рис. 5.5, А, где приведен спектр ЭПР-образца, содержащего срезы внутренних сегментов фоторецепторов.
Хорошо видно, что эта компонента пропадает после ингибирования синтеза N0 метиларгинином. Таким образом сигнал Сu2+-ДЭТК "в чистом виде" представлен на рис. 5.5, Б. Необходимо отметить, что сигнал, полученный после насыщения препарата N0 в предварительных экспериментах, был намного выше, чем сигнал, полученный для эндогенного NO. Это означает, что количество ловушек N0 (комплексов Fе2+-ДЭТК) в наших экспериментах не лимитировано образования МНКЖ-ДЭТК при участии эндогенного NO.
Регистрация спектров ЭПР проводилась на спектрометре Brucker ER-200 D SRC при температуре 77 °К, микроволновая частота 9,550 ГГц. Замороженные образцы срезов сетчатки помещались в кварцевый сосуд Дьюара (внутренний диаметр 5 мм), заполненный жидким азотом. Сосуд помещался внутрь квадратной кварцевой кюветы ТЕ 102, предназначенной для регистрации спектров ЭПР
Для оценки концентрации МНКЖ-ДЭТК использовался стандартный образец - раствор МНКЖ-ДЭТК в диметилформамиде с известной концентрацией (0,36 мМ): проводилось сопоставление интенсивностей сигнала МНКЖ-ДЭТК в препаратах срезов сетчатки с сигналом стандартного образца. Содержание белка в образцах ЭПР определялось биуретовым методом с использованием раствора бычьего альбумина в качестве стандарта.
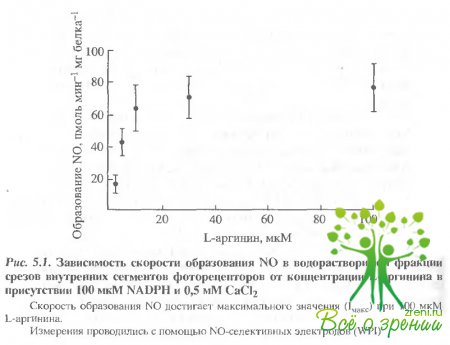
Измерение активности NО-синтазы. Добавление L-аргинина (1 и- 100 мкМ) в препарат, содержащий водорастворимую фракцию наружных или внутренних сегментов, вызывало увеличение концентрации N0 в препаратах как внутренних, так и наружных сегментов фоторецепторов, причем, зависимости скорости образования оксида азота от концентрации b-аргинина имели сходный характер. На рис. 5.1 показана такая зависимость, являющаяся результатом 5 экспериментов, проведенных на экстрактах внутренних сегментов (концентрация СаС12 составляла 0,5 мМ). При этих условиях для NO-синтазы были получены значения Vмaкc = 72 ± 20 пмоль N0 (мг белка)-1(мин)-1 и Км = 7,4 ± 1,5 мкМ для L-аргинина.
Значение Vмaксдостигается при насыщающей концентрации субстрата L-аргинина 10 мкМ. В отсутствие L-apгинина или при добавлении D-аргинина образование NO зафиксировано не было. Результаты были стабильными и воспроизводимыми в присутствии 0,5 мкМ кальмодулина.
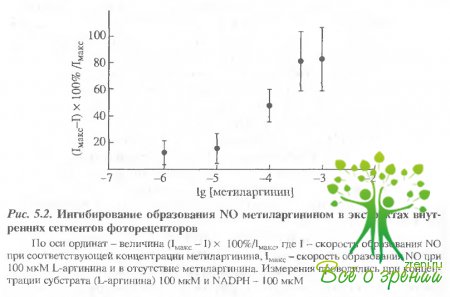
Образование NO ингибировалось метиларгинином (NG-метил-L-аргинин) В присутствии 100 мкМ L-аргинина и 100 мкМ NADPН последовательно добавлялся метиларгинин в разных концентрациях.
На рис. 5.2 отображена зависимость ингибирования NO-синтазы от концентрации метиларгинина. При концентрации ингибитора 100 мкМ происходило уменьшение активности образования NO в 2 раза.
Как и ожидалось в случае конкурентного ингибирования, активность фермента полностью восстанавливалась при добавлении 1 мМ L-аргинина.
Зависимость активности NO-синтазы от концентрации Са2+. Для того чтобы выяснить, будет ли активен фермент при нормальной для фоторецепторных клеток концентрации Са2+, изучалась зависимость активности NO-синтазы от концентрации Са2+.
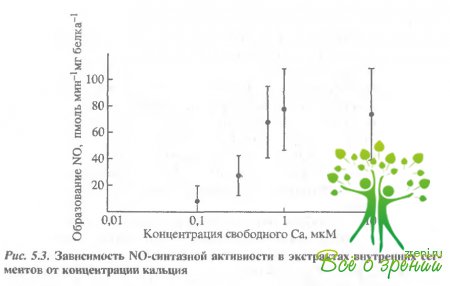
Концентрация кальция регулировалась Са2+/ЕСТА-буфером. На рис. 5.3 приведена зависимость активности NO-синтазы от концентрации свободного Са2+ в присутствии 10 мкМ L-аргинина (усреднение по результатам 5 экспериментов).
В бескальциевом растворе (1 мМ EGTA) образование NO зафиксировано не было. С повышением концентрации Са2+ увеличивалось образование NO, достигая 50% при 0,4 мкМ и максимального значения активности при 0,7 мкМ свободного Са2+. Соответственно при концентрации Са2+ 0,27 мкМ активность NO- синтазы составляла примерно 25% от максимальной, что хорошо согласуется с данными, полученными для темноадаптированных палочек жабы.
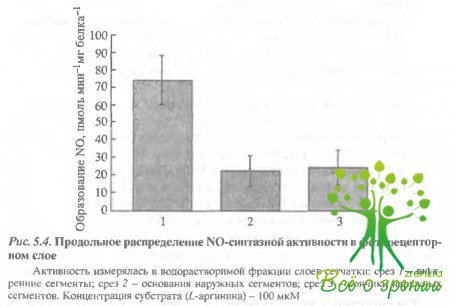
Распределение активности NO-синтазы во внутренних и наружных сегментах фоторецепторов. На рис. 5.4 показано продольное распределение NO-синтазной активности в фоторецепторе по срезам: срез 1 - окончания наружных сегментов, срез 2 - основания наружных сегментов и срез 3 - внутренние сегменты. Измерения проводились с помощью NO-селективных электродов (WPI).
Самая высокая активность обнаружена во внутренних сегментах, однако активность NO-синтазы в наружных сегментах оказалась также довольно высокой. Более того, отсутствие падения градиент а активности от основания к окончанию наружного сегмента доказывает, что наличие здесь NO-синтазной активности обусловлено не диффузией из внутреннего сегмента.
Константы Км и Vмаксопределялись отдельно для препаратов, содержащих внутренние и наружные сегменты. Оказалось, что существенных различий между срезами нет, отсутствует и ощутимая разница между константами ингибирования для метиларгинина или зависимостями от концентрации Са2+. Это дает основания полагать, что в обоих исследованных слоях сетчатки фермент идентичен.
Эноогенная концентрация N0 в наружном фоторецепторном слое сетчатки. Измерения эндогенной концентрации оксида азота проводились с помощью специальных микроэлектродов на расстоянии 60- 100 мкм от окончаний наружных сегментов, при этом кончик электрода достигал уровня ядер фоторецепторных клеток. Как уже было сказано выше, измеряемый ток содержал и другие компоненты, не соответствующие N0. Поэтому после стабилизации электродного тока в перфузионный раствор добавлялся ингибитор NO-cинтaзы-мeтилapгинин. Это вызывало постепенное уменьшение тока, который через 15-30 мин стабилизировался на новом уровне, предположительно соответствующем отсутствию NО.
Измерения проводились на 6 сетчатках каждый раз с новым электродом. В табл. 5.1 даны усредненные результаты этих экспериментов. Так как калибровочная кривая зависимости т ока от концентраций значительно изменялась от электрода к электроду, в каждом из экспериментов зарегистрированные значения тока сначала переводились в эквивалентные концентрации N0, а уже затем полученные значения усреднялись. Именно эти результаты и приведены в табл. 5.1.
В случае, если полный микроэлектродный ток обусловлен N0, получается наибольшее значение эндогенной концентрации оксида азота, составляющее 2,05 ± 0,47 мкМ (колонка 1). Однако, имея ч виду все возможные артефакты, правильнее считать, что NО-сигнал представлен фракцией, подавляемой метиларгинином (колонка 3). Это рассуждение подтверждается и измерениями концентрации N0 с помощью спин-ловушки, которые доказывают фактически полное ингибирование эндогенного образования N0 после добавления 1 мМ метиларгинина. В итоге, считая наиболее верным расчет концентрации N0 по величине тока, подавляемого метиларгинииом, получаем, что стационарная концентрация оксида азота в области проксимальных частей фоторецепторов равна 1,17 ± 0,38 мкМ.
Другим подходом к измерению эндогенной концентрации оказался метод ЭПР. Техника ЭПР позволяет в представленных экспериментах измерять внутриклеточную концентрацию N0, накапливающегося в составе МНКЖ-ДЭТК к моменту замораживания препарата в интактной клетке в полностью интактной сетчатке. На рис. 5.5 приведены типичные спектры ЭПР препарата, содержащего срезы внутренних сегментов фоторецепторных клеток. Ни один из возможных источников образования N0 добавлен не был. Спектр содержит легко определяемую компоненту сигнала МНКЖ-ДЭТК (на рис. 5.5, А она обозначена А). По величине этой компоненты можно было определить число парамагнитных комплексов и, следовательно, количество N0 по отношению к количеству белка в пробе.
Калибровка дает среднее значение 25 ± 12 пмоль N0 (мг белка)-' для 6 экспериментов.
Однако наиболее интересным результатом, полученным методом ЭПР, является полное исчезновение сигнала МНКЖ-ДЭТК в том случае, если до начала измерений сетчатка была инкубирована в растворе, содержащем 1 мМ метиларгинина (рис. 5.5, Б). Это позволяет сделать вывод, что ингибитор проникает в интактную клетку достаточно хорошо, чтобы практически полностью подавить образование N0, что и подтверждает выбор истинного NO-сигнала во время измерений с помощью NO-чувствительных микроэлектродов (см. выше).
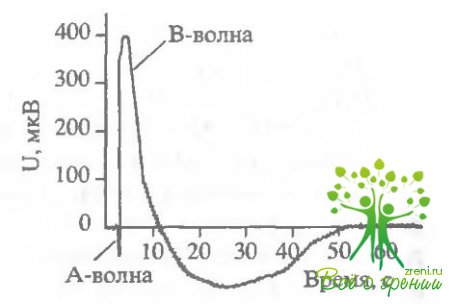
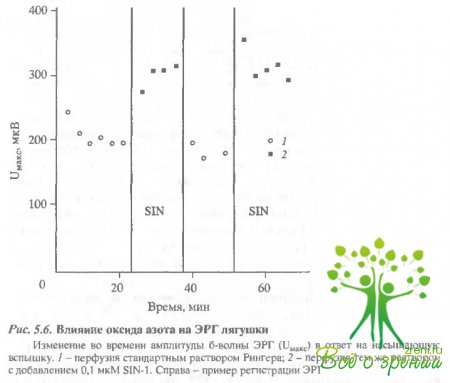
Действие оксида азота на электрические ответы сетчатки и зрительных клеток.Поскольку в слое фоторецепторов нами обнаружена высокая концентрация оксида азота, интересно посмотреть, действует ли оксид азота на фотоответы зрительных клеток. В первой серии экспериментов было исследовано влияние N0 на амплитуды b-волны ЭРГ лягушки. Рис. 5.6 отражает изменения амплитуды b-волны ЭРГ в ответ на насыщающую вспышку в течение одного из шести аналогичных экспериментов.
После стабилизации амплитуды ответа сетчатки, перфузируемой стандартным раствором Рингера, была произведена замена на раствор, содержащий 8114-1. В ходе эксперимента наблюдалось стабильное увеличение амплитуды ЭРГ при замене стандартного перфузирующего раствора на раствор с добавлением амплитуда b-волны ЭРГ возрастала в среднем на 30% при добавлении N0. В результате обратной замены раствора, содержащего БПМ-1, на стандартный происходило уменьшение Uмакс до начального значения. В дальнейшем характер влияния N0 сохранялся - амплитуда ответа сетчатки увеличивалась в среднем на 30% при замене стандартного перфорирующего раствора Рингера на раствор, содержащий SIN-1. Необходимо отметить интересную особенность. Во всех экспериментах при первой замене стандартного раствора на раствор. содержащий SIN-1, происходило лишь незначительное увеличение амплитуды ЭРГ. Однако замена на исходный раствор Рингера вызывала уменьшение амплитуды на 30%, а в результате следующего добавления SIN-1 Uмaкс вновь увеличивался на 30%. В дальнейшем характер изменения амплитуды был абсолютно стабильным - увеличение амплитуды b-вилны ЭРГ при добавлении NO и уменьшение после замены на стандартный растзор. На рис. 5.6 (в верхнем правом углу) представлен типичный пример регистрации b-волны ЭРГ после насыщающей вспышки?
Для контроля был поставлен аналогичный эксперимент с использованием раствора SIN-1, выдержанного в течение 24 ч. В этом случае амплитуда ЭРГ оставалась неизменной до и после замены растьора.
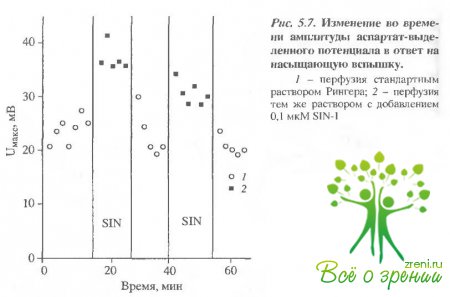
Во второй серии экспериментов подобным образом было исследовано влияние МО на амплитуду аспартат-выделенного потенциала сетчатки лягушки. В этом случае сетчатку перфузировали стандартным раствором Рингера с добавлением аспартата натрия, который блокирует синаптическую передачу между фоторецепторами и нейронами второго порядка. Следовательно, можно полагать, что амплитуда аспартат-выделенного потенциала отражает вклад в ЭРГ фоторсцепторной и гпиальной компонент.
На рис. 5.7 представлен пример изменения амплитуды аспартат-выделенного потенциала после добавления и отмывания SIN-1 в ходе аналогичного первому эксперимента.
Хорошо видно, что N0 влияет сходным образом на амплитуду аспартат-выделенного потенциала и ЭРГ. Имеет место такое же стабильное увеличение амплитуды аспартат-выделенного потенциала на 30% в результате замены стандартного перфузирующего раствора на раствор содержащий SIN-1, и обратное уменьшение амплитуды после отмывания. Интересным является тот факт, что так же, как и в первом случае, при первом добавлении SIN-1 заметного изменения амплитуды не наблюдалось, однако дальнейшие уменьшение и увеличение амплитуды были абсолютно стабильными.
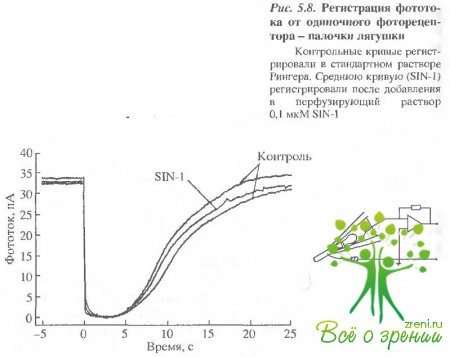
Следующий эксперимент был поставлен для проверки предположения о возможности влияния N0 непосредственно на работу фоторецептооов и собственно ЦН-каналов. В данном случае регистрировался фотоответ изолированной палочки саламандры методом всасывающего электрода. На рис. 5.8 представлен пример записи фотоответов от одиночной клетки до и после перфузии наружного сегмента раствором, содержащим S-нитрозоцисгеин.
Как видно в случае изолированной клетки, заметного эффекта оксид азота не дает. (Не было обнаружено эффекта и в том случае, когда в пипетку засасывался наружный сегмент, а внутренний сегмент перфузировался раствором, содержащим N0). Небольшое уменьшение амплитуды фотоответ а и скорости восстановления сетчатки после вспышки, вероятно, объясняется естественным ухудшением физиологических свойств выделенной сетчатки с течением времени.
NO-синтаза в наружном и внутреннем сегментах фоторецептора. В результате гистохимических исследований (с использованием NADPH-диафоразы и антител) N0 синтаза была ранее обнаружена только во внутреннем сегменте фоторецепторов. Однако оказалось, что NO-синтазная активность во внутреннем сегменте наибольшая, однако и в наружных сегментах также было обнаружено существенное образование NO. Поскольку активность NO-синтазы в апикальной и базалъной частях наружных сегментов практически не различалась (см. рис. 5.4), есть основание утверждать, что фермент присутствует в обоих сегментах, а не образуется только во внутреннем сегменте и затем транспортируется в наружный, важно отметить, что в препаратах срезов слоев сетчатки, содержащих нейроны второго порядка, NO синтазная активность нами не зафиксирована. Это обстоятельство подчеркивает принадлежность этого фермента именно фоторецепторному слою.
Активность фермента зависит от концентрации кальция, причем характеристики этой зависимости в фоторецепторных, эндотелиальных клетках и клетках мозга сходны. Эти результаты согласуются с результатами Venturini el al. [1991], полученными на препаратах наружных сегментов палочек быка: схожи Км для L-аргинина и согласуются параметры ингибировапия метиларгинином Отличается лишь полученная величина максимального образования NO - она оказалась примерно в четыре раза больше, но это различие не так уж значимо. Во-первых, ни в одном и в случаев фермент не выделялся в чистом виде, поэтому нормализация к общему содержанию белка во фракции условна. Во-вторых, измерения проводились в водорастворимой фракции, на что могли повлиять различия ь процедуре приготовления препарата и различия между животными.
Согласно данным Venturim et al. [1991], 50%-ная активность фермента достигается при 600 нМ SIN-1 Са2+, а согласно нашим данным, - при 400 нМ. Существуют и другие данные: 50%-ная активность NO-синтазы, выделенной из мозжечка крысы, достигается при 200 нМ Са2+, а максимальная активность - при 1 мкМ Са2+. Внутриклеточная концентрация свободного Са2+ в наружных сегментах палочек жабы составляет примерно 270 нМ, при освещении, как известно, она может только уменьшаться. Следовательно, согласно данным Venturini et al. [1991], NO-синтаза в наружных сегментах должна быть в значительной мере инактивирована при физиологической концентрации Са2+, тогда как, по нашим данным, активность фермента должна будет составлять -25% при 270 нМ Ca2+. Необходимо отметить, что ситуация значительно отличается во внутреннем сегменте, где активность NO-синтазы существенно выше и где концентрация кальция неизвестна.
Эндогенная концентрация NO в фоторецепторном слое. Наиболее интересен результат, свидетельствующий о достаточно высокой постоянной концентрации NO вокруг проксимальных частей фоторецепторов в интактной сетчатке. Однако основной проблемой измерений с помощью NO-селективных электродов остается их чувствительность к другим, отличным от NO веществам, например, дофамину, а также другие артефакты. Поэтому для оценки концентрации NO использовалась фракция электродного тока, подавляемая метиларгинином. Эта фракция составила ~1 мкМ NO. Такая оценка кажется обоснованной, так как активность NO-синтазы в растворе блокируется в присутствии 0,1 мМ метиларгинина (см. рис. 5.2). Об этом свидетельствует факт полного исчезновения сигнала ЭПР МНКЖ-ДЭТК в образцах, обработанных в течение 1 ч метиларгинином в концентрации 1 мМ (см. рис. 5.5, Б). Дальнейшие исследования доказали, что способность метиларгинина проникать в клетку достаточна для блокады NO-синтазы in сity. Хотя нельзя полностью исключать и другие, менее очевидные, источники ошибки. Так, например, обусловленное метиларгинином изменение концентрации NO может подействовать на концентрацию дофамина, что в свою очередь повлияет на результаты.
Принципиально важно, что эндогенная концентрация оксида азота, измеренная с помощью NO-электрода, по порядку величины совпадает с оценочным значением, полученным в результате применения принципиально иного метода - метода ЭПР. Такая оценка показала, что за 30 мин во фракции накапливалось 25 пмоль NO/мг белка. I мг белка, представленного во фракции в основном родопсином, соответствует количеству вещества -29 пмоль. Отсюда следует, что 1 молекула N0 приходилась на 1000 молекул родопсина. Так как концентрация родопсина в наружном сегменте составляет порядка 1 мМ, получаем примерно микромолярную концентрацию NO.
Интересно сравнить полученную нами концентрацию NO ~ 1 мкМ с данными, полученными для других тканей: максимальная экдотелиальная концентрация NO, зафиксированная в эндокарде кролика, составила 0,95 мкМ, в почках крысы она оказалась еще меньше - 0,11 мкМ.
Поскольку в зрительной клетке нами обнаружена большая эндогенная концентрация оксида азота, естественно было бы предположить, что NO играет регулятсрную роль в процессах фототрансцукции. Но это не так. Обнаружено действие доноров NO на ЭР1. Но основной вклад при записи b-волны электроретинограммы вносят оn-биполярные и глиальные клетки, хотя также существуют данные о влиянии нейронов третьего порядка. Поэтому влияние NO на амплитуду ЭРГ еще раз подтверждает данные о возможном участии оксида азота в процессе передачи зрительного сигнала на уровне синапса между фоторецепторами и горизонтальными клерками и на уровне ганглиозных клеток. К сожалению, этот эффект, наблюдаемый при записи b-волны ЭРГ, не позволяет сделать более точные выводы о том, на каком именно этапе это происходит.
Влияние оксида азота на амплитуду аспартат-выделенного потенциала свидетельствует о чувствительности глиальных и/или фоторецепторных клеток. Однако сравнительно небольшая для физиологии величина эффекта (30%) и отсутствие влияния NO на фотоответ одиночного фоторецептора позволяет предположить, что мы имеем дело с второстепенным или резервным механизмом, в норме не задействованным в процессе фототрансдукции.
Как уже было сказано, влияния NO на мембранные токи наружного сегмента палочки обнаружено не было, хотя наблюдалось 30%-ное увеличение амплитуды аспартат-выделенного потенциала. Существование работы, подтверждающей влияние NO на активность растворимой гуанилатциклазы, позволяет предположить, что оксид азота, синтезируемый во внутреннем сегменте, участвует в синаптической передаче между фотонецепторами и оn-биполярными клетками. Возможно, NO влияет на величину мембранного потенциала внутреннего сегмента, активируя гуанилатциклазу и таким образом увеличивая уровень цГМФ. Существованием подобного эффекта может объясняться "защита" ЦН-каналов наружного сегмента от влияния оксида азота, имеющего совершенно другую мишень.
Таким образом, полученные данные позволяют сделать вывод, что оксид азота, синтезируемый во внутренних сегментах фоторецепторов, не участвует в процессе преобразования светового импульса в самом фоторецепторе, однако может влиять на работу нейронов второго и третьего порядков.
Оксид азота и цГМФ-активируемый ток. Ранее было обнаружено, что NO может прямо влиять на активность ЦН-зависимых каналов обонятельных нейронов и слуховых клеток. Однако вопрос, играет ли такой механизм существенную роль в работе обонятельных или механорецепторных клеток, остался открытым. Ни в обонятельных, ни в механорецепторных клетках существенная концентрация NO не обнаружена. Зарегистрированная нами довольно высокая активность NO-синтазы в препаратах срезов слоя фоторецепторов и в интактной сетчатке позволяла предположить, что NO может играть существенную роль в механизме фототрансдукции. прямо активируя цГМФ-зависимые каналы. Более того, ранее нами было показано, что реахенты, модифицирующие SH-группы, могут прямо актизировать цГМФ-регулируемые каналы в фоторецепторной клетке.
В предыдущей главе описано влияние различных доноров NO на величину интегрального тока цГМФ-активируемых каналов наружного сегмента палочки лягушки. В этих экспериментах очевидного прямого влияния на проводимость каналов, аналогичного действию на каналы из слуховых волосковых клеток или обонятельных нейронов, обнаружено не было. Хотя в разных экспериментах модификация SН-групп нуклеотидрегулируемых каналов из фоторецепторных клеток, обонятельных нейронов и слуховых волосковых клеток в одинаковой степени приводила к активации каналов.
Отсутствие влияния N0 на проводимость нуклеотидрегулируемых каналов из наружного сегмента фоторецепторных палочек позволяет предположить, что прямое действие оксида азота на ионные каналы вряд ли может играть физиологическую роль во всяком случае в сенсорных клетках. По-видимому, такой механизм является лишь следствием химической природы взаимодействия оксида азота с цистеинами белка, формирующего канал. Вероятно, в клетках, где N0 существует in vivo (фоторецепторных клетках), цГМФ активируемые каналы к нему не чувствительны. Напротив, в том случае, когда нативная концентрация оксида азота в клетке высокая, существует специальный механизм, который препятствует взаимодействию N0 с ионным каналом.
Статья из книги: Молекулярные механизмы зрительной рецепции | Каламкаров Г.Р., Островский М.А..



Комментариев 0