Глия Сетчатки
Описание

Сетчатка позвоночных животных, так же как и мозг в целом, представляет собой сообщество нервных и глиальных клеток. Все пространство между телами и отростками нейронов заполнено глиальными клетками и их отростками. Среди глиальных клеток сетчатки по численности и по массе преобладают мюллеровские клетки. Кроме них, различают также астроциты, олигодеидроциты и микроглиоциты.
В классических исследованиях строения сетчатки позвоночных животных сведения о глиальных ее элементах довольно скудны.
Ramon у Cajal [1911, 1972] различал в сетчатке высших позвоночных два вида нейроглиальиых элементов: мюллеровские волокна и истинные астроциты; у амфибий он описывает лишь клетки Мюллера. Долгое время о принадлежности клеток сетчатки к глии судили лишь по характеру расположения] их по отношению к нейронам, по форме их ядра и отростков. Общепринятым было мнение об опорной и трофической роли глиальных клеток сетчатки, другие ее функции были не известны [Винников, 1947]. Электронно-микроскопические исследования позволили выяснить ультраструктурные отличия глиальных клеток мозга и сетчатки от нейронов [Sjostrand, 1956; Cohen, 1961; Боровягин, Франк, 1962; и др.]. Применение экспериментального подхода, новых гисто- и биохимических методик в последние 10—15 лет существенно расширили наши знания о глиальных клетках сетчатки.
В настоящем разделе мы предлагаем описание общих свойств структурно-функциональной организации глиальных клеток сетчатки позвоночных животных на примере собственных исследований сетчатки лягушки с привлечением данных литературы.
Мюллеровские клетки (синонимы: лучевые или радиальные глиоциты, мюллеровские волокна, радиальная глия Мюллера). Со времени первых описаний этих глиальных клеток [Muller, 1851; Ramon у Cajal, 1972; Огнев, 1904] было предпринято немало исследований (гистологических, ультраструктурных, био- и гистохимических), однако до сих пор нет полного представления о структурно-функциональных свойствах этих клеток в сетчатке. Тем не менее они исследованы лучше других глиальных элементов.
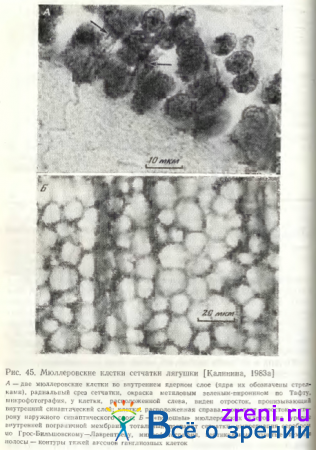
Общий вид мюллеровских клеток можно наблюдать при импрегнации сетчатки различных позвоночных серебром по Гольджи (см. рис. 44).
Ядросодержащая часть этих клеток расположена среди биполярных клеток во внутреннем ядерном слое сетчатки (рис. 45, А).
Как правило, ядро с окружающей его цитоплазмой веретенообразной формы. Длинной осью ориентировано перпендикулярно плоскости сетчатки. На поперечных срезах сетчатки при малых увеличениях микроскопа и некоторых способах окраски во внутреннем синаптическом слое выявляется поперечная исчерченность, обусловленная прохождением через этот слой отростков (тяжей) мюллеровских клеток. Эти отростки пронизывают также слой ганглиозных клеток, расширяясь здесь в виде пирамиды, и образуют плоские округлые «подошвы» на уровне внутренней пограничной мембраны (рис. 45, Б); диаметры последних колеблются от 5 до 25 мкм. По детальным исследованиям и схемам В.Л. Боровягина [1963], внутренняя пограничная мембрана образована этими расширенными окончаниями тяжей мюллеровских клеток и слоем диффузно-рассеянного вещества базальной.
мембраны.
Наружные отростки мюллеровских клеток менее мощные, короткие расширенные их тяжи участвуют в формировании наружной пограничной мембраны [Боровягин, 1963]. Терминальные отделы апикальных отростков мюллеровских клеток образуют регулярно расположенные тонкие и светлые микроворсинки, выходящие за пределы наружной пограничной мембраны (см. рис. 44). Это также хорошо видно па четких снимках ультраструктуры сетчатки черепах [Давыдова, 1981].
Ультраструктура мюллеровских клеток исследована у ряда позвоночных животных: рыб [Villegas G., Villegas R., 1963], амфибии [Боровягин, Франк, 1962; Боровягин, 1963]; рептилий [Pedler, 1963; Rasmussen, 1974]; млекопитающих [Ladman, 1961; Amcmliya, 1969; Rasmussen, 1972; Magalhaes, Coimbra, Silva-Pinto, 1973] и человека [Fine, Zimmerman, 1962; Inomata, 1965; Radnot, 1967; Uga, Nakao, 1970; Uga, Srnelser, 1973; Ugar Ikui, 1974; и др.]. Электронно-микроскопические исследования показали, что наружная и внутренняя пограничные мембраны сетчатки сформированы расширениями тяжей мюллеровских клеток, соединяющихся между собой с помощью десмосомных образовании [Sjostrand, 1953; Villegas, 1960; Cohen, 1961; Боровягин, Франк, 1962], так же как соединяются клетки пигментного эпителия сетчатки [Porter, Jama da, 1960].
Склеральные отростки мюллеровских волокон плотно облегают поверхность внутренних сегментов фоторецепторов и образуют множество пальцевидных отростков (диаметр 35—50 нм, длина 4—7 мкм) в сторону наружных сегментов фоторецепторов и пигментного эпителия. При этом поверхностные мембраны фоторецепторных клеток находятся в тесном контакте с поверхностными мембранами мюллеровских клеток (расстояние между ними 10—15 нм) [Sjostrand, 1956; Villegas, 1960; Боровягин, Франк, 1962; Magalhaes, Coimbra, 1972; и др.]. Исследование сетчатки в световом (см. рис. 44) и в электронном микроскопах [Hama, Kosaka,1978] показало, что отростки мюллеровских волокон образуют сотовидные комплексы в наружном и внутреннем ядерных слоях.Между клетками Мюллера не установлена электрическая связь и не показано наличие тангенциальных щелевых синаптических контактов, в то время как между фоторецепторами и горизонтальными клетками одинакового типа, а также между клетками пигментного эпителия такие связи обнаружены электрофизиологически и электронно-микроскопически [Бызов, 1979,. 1984] Представляет интерес проверка морфологами существования синаптических связей между близлежащими мюллеровскими клетками.
Витреальные тяжи мюллеровских клеток, проходящие через внутренний синаптический слой, обволакивают тела ганглиозных клеток [Боровягин, Франк, 1962]. Достигнув слоя немиелинизированных аксонов ганглиозных клеток, эти тяжи изолируют пучки аксонов подобно шванновским клеткам и выстилают дно глаза под слоем базальной мембраны. В цитоплазме мюллеровских клеток, помимо типичных клеточных органелл, обнаружена густая продольно ориентированная сеть тонких фибриллей (толщиной менее 10 нм), сосредоточенных в центральной части волокна. В глиальных клетках центральной нервной системы выявлена такая же фибриллярная сеть, имеющая белковую природу [Gray, 1959].
[banner_centerrs] {banner_centerrs} [/banner_centerrs]
Адекватная световая стимуляция сетчатки лягушки приводит к изменению ультраструктурной организации мюллеровских клеток. Увеличивается сеть тонких фибриллей, количество рибосом и гранулярного эндоплазматического ретикулюма, что указывает на увеличение синтеза белка; пальцевидные отростки глиальных клеток оказываются в контакте с мембраной отростков пигментного эпителия; на поверхностной мембране склерального полюса образуется большое число впячиваний и скопление осмиофильного материала [Боровягин, Франк, 1962].
Функции радиальной глии Мюллера чрезвычайно многогранны. Не вызывает сомнения «скелетная», опорная роль этих клеток. Вытянутые тела их, пронизывая сетчатку и посылая горизонтальные отростки в ее слои, дают опору телам и отросткам нейронов. По данным световой и электронной микроскопии, мюллеровские клетки дифференцируются в эмбриогенезе сетчатки первыми [Nakayama, 1957; Meller, Glees, 1965; Mishima, Fujita, 1978; Неклюдова, Дабагян, 1983], за ними крупные ганглиозные клетки и другие нейроны. Можно считать, что радиальная глия выполняет функцию направления роста нервных отростков клеток сетчатки, подобно направляющему влиянию глии на рост отростков и миграцию нейронов в развивающемся мозге и культуре ткани [Rakic, 1972, 1982; Kerns, Hinsman, 1973; и др.].
Не подлежит сомнению и трофическая функция радиальных клеток Мюллера. Ультраструктурный базис трофической роли глии этого вида был продемонстрирован, например, в сетчатке черепахи [Lasansky, 1961]. Микроциркулярная сеть ретины большинства исследованных низших позвоночных животных располагается с внутренней и наружной поверхностей сетчатки, вне нервных слоев ее; сосуды и капилляры не проникают внутрь сетчатки [Prince, 1956; Rasmussen, 1974]. Необходимым трофическим путем становится система капилляр-глиальная клетка- нейрон [De Robertis, Gerschenfeld, 1961; Боровягин, Франк, 1962; Stell, 1972]. Интенсивный обмен веществ в сетчатке млекопитающих также реализуется этой системой [Erskine, 1963; Hogan, Feeney, 1963]. На ультраструктурном уровне установлена, например, связь периферических ретинальных сосудов человека с базальной мембраной мюллеровских клеток [Spitznas, gornfeld, 1977]. Авторы показали, что из периваскулярной зоны з базальную мембрану глиальных клеток переходят коллагеновые фибриллы диаметром 25 нм.
Глиальные клетки Мюллера активно участвуют в процессах репарации при повреждениях сетчатки. Например, в эмбриональном периоде они могут фагоцитировать дегенерирующие клетки ганглиозного слоя цыпленка [Meller, 1981], а также замещать нервные клетки сетчатки, погибшие в результате экспериментальной ишемии у кролика на 14-й день после перерезки задней ресничной артерии [Kikuchi, Takei, Mizuno, 1977]. Путем иммунной гистохимии установлено, что глия Мюллера сетчатки крысы реагирует на повреждение, подобно астроцитам мозга, накоплением фибриллярного кислого белка глии (ФКБГ— GFA) [Bignami, Dahl, 1979]. Авторы считают, что накопление ФКБГ связано с процессом фибриллогенеза. ФКБГ-позитивный материал был выявлен также иммуно-гистохимически в мюллеровских клетках сетчатки человека в условиях реактивного глиоза [Molnar et al., 1984].
Ультраструктурные и радиоавтографические исследования мюллеровских клеток кролика установили гетерогенность их внутреннего устройства [Magalhaes, Coimbra, 1972; Magalhaes, Coimbra, Silva-Pinto, 1973]. Витреальная зона клеток характеризуется высоким уровнем синтеза гликогена, микрофиламентами и инвагинациями мембраны. В средней ядросодержащей части клеток (на уровне внутреннего ядерного слоя) показан активный синтез белка. Наружный отдел содержит большое количество микротрубочек и единственную в клетке митохондрию. Такая структура мюллеровских клеток предполагает всасывание глюкозы и накопление углеводов во внутренней части клеток как резервуара потенциальной энергии для внутренней сетчатки. Гистохимический анализ распределения гликогена в темно-адаптированной сетчатке лягушки показал наличие его в зоне контактов фоторецепторов с разветвлениями мюллеровских клеток, а также во внутреннем синаптическом слое и тяжах мюллеровских клеток [Шабадаш А., Шабадаш С., 1971; Magalhaes, Coimbra, 1972]. В условиях световой адаптации в мюллеровских волокнах значительно возрастает содержание гликогена на Уровне внутреннего синаптического слоя. Аналогичный факт наблюдался в сетчатке протея в синапсах и местах контактов биполяров с мюллеровскими клетками [Dowling, 1970]. Экспериментальное выключение артерий в сетчатке собаки приводит к почти полному истощению запасов гликогена в клетках Мюллера [Magalhaes, Coimbra, Silva-Pinto, 1973], что подтверждает факт передвижения глюкозы из сосудистой системы в глиальные клетки. Принципиальный вопрос о переходе крупных молекул из глии в нейроны и в обратном направлении пока остается открытым [Певзнер, 1979], но косвенные данные свидетельствует о таком перемещении.
Гисто- и биохимические исследования мюллеровских волокоц последних лет показали ряд черт отличия их от нейронов сетчат. ки. Например, иммунохимически и иммуногистохимически опре. дел ял и карбонангидразу С в сетчатке куриных эмбрионов й взрослых кур [Linser, Moscona, 1981а]. Было установлено, что в недифференцированной сетчатке фермент содержится во всех клетках, но по мере их специализации увеличивается в мюллеровских клетках и падает в нейронах. У взрослых птиц фермент сохраняется лишь в клетках Мюллера. На этих же объектах исследовали локализацию белка S-100 [Linser, Moscona, 1981Ь]. Он обнаружен в нейронах на ранних стадиях онтогенеза и в зрелом периоде. Мюллеровские клетки не содержат S-100 ни в эмбриональном, ни во взрослом периоде онтогенеза.
Биохимические особенности глиальных клеток являются основой участия их в специфической деятельности нервных клеток [Певзнер, 1979]. Глиальные клетки Мюллера обладают высоким сродством к тормозному медиатору сетчатки — ГАМК. По типу захвата ГАМК клеточными элементами (по данным биохимии и радиоавтографии) сетчатки позвоночных животных разделены на 3 группы [Арутюнян, Геворгян, Петросян, 1981]. К первой группе отнесены сетчатки животных (кролик, крыса, обезьяна), у которых ГАМК захватывается в основном глиальными мюллеровскими клетками [Hyde, Robinson, 1974; Bruun, hingcr, 1974; Voaden, 1976; Sarthy, 1982]. Во вторую группу вошли сетчатки (золотая рыбка, лягушка, голубь, курица) с нейрональным типом захвата ГАМК [Voaden, 1976; и др.]. У этих животных медиатор накапливается в горизонтальных, амакриновых и ганглиозных клетках. К третьему типу относят сетчатку кролика, в которой ГАМК накапливается сперва в клетках Мюллера, а затем в слое амакриновых клеток [Ehinger, 1977; Bauer, Ehinger, Tornqvist, 1981].
Мюллеровские клетки содержат также рН]-(±)-цисаминоциклогексан-угольной кислоты (АСНС) — избирательный ингибитор нейронального транспорта АМК [Cunningham, Marshall, Neal, 1981]. Авторадиографически обнаружено также содержание в них (у крысы, мыши, кошки, голубя, кролика, морской свинки) других аминокислот (предположительно нейромедиаторов), таких как таурин, глицин, глутамат, аспарат, глутамин [Cunningham, Miller, 1976; Pourcho, 19 7; Voaden et al., 1977]. В то же время биохимический анализ мюллеровских клеток черепахи показал, что эти глиальные клетки не синтезируют и не аккумулируют ацетилхолин, ГАМК. и катехоламины при инкубации с радиоактивными метками [Sarthy, Lam, 1978]. Однако мюллеровские волокна содержат ферменты, необходимые для инактивации некоторых нейропередатчиков, удержания кислотно-щелочного равновесия и обеспечения стабильного функционирования сетчатки путем удаления продуктов метаболизма (углекислого газа и аммиака). Получены также некоторые сведения об участии этих глиальных клеток сетчатки в регуляции ионного окружения нейронов [Mori, Miller, Tomita, 1976b; Karwoski, Proenza, 1978; Van Harreveld, 1982].
В электрофизиологических экспериментах с применением внутриклеточной метки проционовым желтым доказано, что мюллеровские клетки генерируют медленный компонент ЭРГ и, следовательно, участвуют в электрогенезе сетчатки [Miller, Dowling, 1970; Mori, Miller, Tomita, 1976a; Бызов, 1979]. Потенциал покоя этих клеток очень высок (до 80 мВ) по сравнению с нервными клетками сетчатки, а входное сопротивление мало за счет большой протяженности их цитолеммы. Деполяризационный ответ мюллеровских клеток возникает в результате увеличения внеклеточной концентрации ионов калия, которые выделяются из нейронов во время их активности [Mori, Miller, Tomita, 1976bj. При этом в мюллеровские клетки переходят из межклеточных щелей ионы калия и они деполяризуются. Интересно, что внеклеточно потенциалы мюллеровских волокон (медленный компонент ЭРГ) регистрируются лишь в толще внутреннего синаптического слоя, т. е. в районе основного источника ионов калия: их выделяют субсинаптические мембраны многочисленных синапсов этого слоя. Недавно получен новый факт гетерогенности плазмолеммы мюллеровского волокна [Kreutzberg, Hussain, 1982]: электронно-микроскопически у белых мышей, крыс, монгольских песчанок и золотистых хомячков обнаружена высокая активность 5'-нуклеотидазы на мембране наружного отдела мюллеровской клетки, а на тяжах ее, расположенных во внутренних слоях сетчатки, фермент не найден вообще.
Топографические особенности распределения клеток Мюллера в плоскости сетчатки до сих пор почти не исследованы По наблюдениям D'este et al. [1983], в сетчатке лягушек и жаб мюллеровские клетки более многочисленны в периферических отделах сетчатки, чем в центральных. Имеются сведения о различиях в их строении (у человека) в районе оптического нерва и на периферии сетчатки: вблизи Ora serrata они короче и шире, а латеральные ветви их редуцированы, в центральных участках эти клетки имеют типичное строение [Uga, 1974].
Таким образом, полученные к настоящему времени данные об особенностях структурно-функциональной организации мюллеровских клеток указывают на активное их участие в совместной с нейронами деятельности сетчатки глаза позвоночных животных. Обращает на себя внимание структурная, биохимическая и физиологическая асимметрия этих клеток которые, с одной стороны, являются связующим звеном сетчатки по всей толщине, а с другой — осуществляют индивидуальное взаимодействие с различными клеточными элементами сетчатки в ее Дифференцированных слоях.
В отношении эволюционных изменений структуры мюллеровских клеток систематических исследований в литературе мы нашли. Однако рассмотрение классических зарисовок Ramon У Cajal [1972] позволяет сделать вывод о значительно большей разветвленности, большей тонкости и изяществе внутренних отделов мюллеровских волокон в сетчатке птиц (куриных), чем у всех других изученных им видов (рыб, амфибий, рептилий, млекопитающих).
Астроциты (синонимы: астроцитарная глия, микроглия). Впервые астроциты были описаны в сетчатке высших позвоночных животных и человека [Ramon у Cajal, 1972; Polyak, 1941; Wolter, 1955; и др.]. Есть сведения об отсутствии их в сетчатке рыб [Шибкова, 1971] и наличии в сетчатке амфибий [Калинина, 1983а]. В сетчатке млекопитающих и человека была изучена ультраструктурная организация глиальных клеток этого типа [Hogan, Feeney, 1963; Shakib, Ashton, 1966; Ikui, Uga, Kohno, 1976; Biissow, 1980; и др.]. Сравнительно недавно выполнены (с применением нескольких методик импрегнации серебром) исследования строения, распределения и численности астроцитарпой глии у обезьян [Ogden, 1978; 1983]. Типичной особенностью асгроцитов центральной нервной системы и, в том числе сетчатки, являются длинные маловетвящиеся отростки, часть из которых примыкает к стенкам небольших сосудов [Wolter, 1955]. Клетка и ядро при импрегнации серебром по нейрофибриллярным методикам имеют овальную и полигональную форму, слабо окрашены. В цитоплазме и ядре содержится небольшое количество хроматина, типичного ядрышка не обнаруживается.
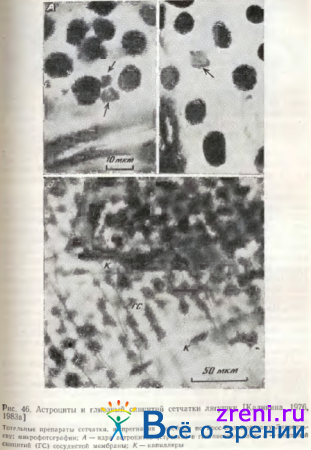
В ганглиозном слое сетчатки лягушки астроциты имеют самые мелкие ядра (5-10 мкм) полигональной формы (рис. 46, А).
Какой-либо пространственной регулярной близости к телам нейронов эти клетки не обнаруживают. Плотность распределения астроцитов в центральной зоне ганглиозного слоя, в районе сосочка зрительного нерва, в среднем в 23 раза выше, чем на периферии [Калинина, 1983а]. Концентрация астроцитов в центральной зоне сетчатки также наивысшая у млекопитающих и человека [Ramon у Cajal, 1972; Dogiel, 1894; Wolter, 1955], а число астроцитов коррелирует с толщиной слоя нервных волокон сетчатки, в котором разветвляются их отростки [Ogden,1978,1983; Biissow, 1980]. По цитологическим критериям ретинальные астроциты могут быть отнесены к протоплазматическим; в интраокулярном участке зрительного нерва мышей, кошек и обезьян найдены также фиброзные астроциты [Omlin, Bischoff, Spycher, 1978; Biissow, 1980; Massa, 1982]. Эти последние Biissow [1980] относит к специализированной глии, тесно связанной со зрительным первом. По-видимому, это так называемые леммоциты [Rodieck, 1973].
Светооптические методы позволяют различать в центральной нервной системе протоплазматические и волокнистые (фиброзные) астроциты, однако электронно-микроскопически в перикарионе и в отростках обеих разновидностей обнаружены тонкие фибриллы, так называемые глиофибриллы диаметром 7—9 нм [Eng et al., 1971]. Фибриллы могут объединяться в пучки различной толщины и длины. Иммуногистохимически исследовано распределение маркерного белка ФКБГ в сетчатке человека и обнаружена его локализация в телах и отростках астроцитариой глии в ганглиозном слое [Molnar et al., 1984].
Гистохимические исследования показывают, что у млекопитающих отношения между астроцитами, капиллярами и нейронами в сетчатке подобны таковым в центральной нервной системе. Очевидно, астроциты участвуют в поддержании ионного и осмотического постоянства среды, осуществляют активный транспорт ионов и метаболитов. Мидзуно [1964] впервые удалось выявить активный транспорт АТФазы астроцитами, расположенными во внутреннем ядерном слое. Сходство в строении и функциях мюллеровских клеток и астроцитов наводит на мысль о единородстве этих клеток. Небольшое количество астроцитов по сравнению с другими типами глиальных клеток в сетчатке [Калинина, 1983а j, а также по сравнению с этим отношением в центральной нервной системе, может быть объяснено тем, что их функции выполняют специализированные астроциты сетчатки— клетки Мюллера [Polyak, 1941; Мидзуно, 1964; Magalhaes, Coimbra, 1972; Bignami, Dahl, 1979].
Астроглиальные клетки найдены также в хиазме и оптическом тракте, описаны разновидности их по характеру ветвления отростков [Liss, 1956; Turner, Glaze, 1978]. Астроциты, так же как и мюллеровские клетки, направляют рост аксонов зрительного нерва при регенерации [Bohn, Reier, Sourbeer, 1982]. Интересно, что в зрительном нерве хвостатых амфибий найдены все разновидности глиальных клеток центральной нервной системы: астроциты, олигодендроциты и микроглия [Blunt et al., 1967; Stensaas, 1977]. За внутренней поверхностью внутренней пограничной мембраны сетчатки позвоночных животных и человека расположен слой сосудистой мембраны сетчатки [Wolter, 1956; Шнбкова, 1970; Калинина, 1976]. Он представлен синцитиальным пластом звездчатых глиальных клеток, поддерживающих микрокапиллярную систему (рис. 46, Б). Нейроглиальное происхождение их пока не доказано, функции также не исследованы.
Олигодендроциты. В сетчатке позвоночных животных эти глиальные клетки располагаются в слое ганглиозных клеток [Мидзуно, 1964; Stone, 1965; Шибкова, 1970, 1971а; Калинина, 1983а], а также в зрительном нерве [Maturana, 1960; Blunt, Wendel-Smith, Baldwin, 1965; Hirose, Bass, 1973; и др.].
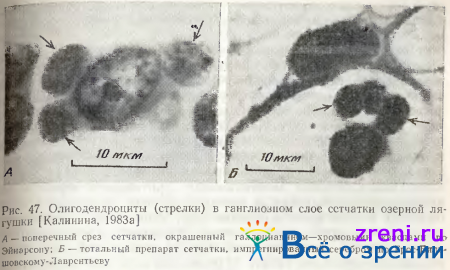
Олигодендроциты — самые мелкие клетки ганглиозного слоя. Форма клетки и ядра округлая, реже овальная. На поперечных срезах сетчатки, окрашенных галлоцианином, у них обнаруживается очень узкий ободок цитоплазмы. Ядрышко небольшое, расположено в центре ядра. Хроматин часто образует кольцевое скопление вокруг ядрышка. Для клеток этого типа характерно расположение группами (по 2—3 клетки) в непосредственной близости от крупных нейронов (рис. 47).
Размеры ядер этого типа клеток, так же как н у крупных нейронов, сателлитами которых они являются, достоверно больше на периферии сетчатки, чем в центральной н средней зонах. Птотность распределения олигодентроглии и численное соотношение с другими клетками сетчатки также коррелирует с закономерностями пространственного размещения крупных нейронов: доля их среди клеток других типов ганглиозного слоя увеличивается к периферии почти в 10 раз [Kalinina, 1976; Калинина, 1983а]. Цитофотометрически обнаружено также согласованное изменение содержания РНК в этой сателлитной глии и крупных нейронах ганглиозного слоя сетчатки лягушки в результате стимуляции мелькающим светом [Калинина, 19836]. 30-дневная световая депривация взрослых крыс приводит к снижению количества РНК в перинейрональой глии ганглиозного слоя сетчатки и сохранению этой реакции при последующем освещении и стимуляции [Малинаускайтe, Певзнер, 1976]. Полученные с помощью цитофотометрического анализа данные об изменениях нуклеиновых кислот в нейронах и их глиальных сателлитах подтверждают современные представления о единой функционально-метаболической системе нейрон-нейроглия [Певзнер, 1972, 1979].
По-видимому, олигодендроциты, расположенные в ганглиозном слое, не способны к миелогенезу. Общеизвестно, что аксоны ганглиозных клеток, направляющиеся по поверхности сетчатки к слепому пятну, лишены миелиновой оболочки, и лишь в зрительном нерве определенная часть аксонов (в зависимости 0т вида животного) получает миелиновую оболочку. Кроме того, было показано, что после локального повреждения слоя нервных волокон сетчатки мышей наблюдается спраутинг (разрастание) аксонов, который авторы объясняют отсутствием в сетчатке миелинообразующих клеток, при распаде которых образуются продукты, тормозящие регенерацию аксонов [МсСоnnell, Berry, 1982].
Методами радиоавтографии, световой и электронной микроскопии было установлено спиральное обволакивание отростками олигодендроцитов (подобно Шванновским клеткам) пучков аксонов зрительного нерва лягушки, мыши, крысы, обезьяны и формирование миелиновой оболочки вокруг аксонов [Maturana, 1960; Peters, 1964; Minckler, McLean, Tso, 2976; Tennekoon ct al., 1977; Black, Forster, Waxman, 1982; и др.]. У амфибий процесс миелинизации аксонов ганглиозных клеток происходит главным образом после метаморфоза [Киселева, 1981].
У млекопитающих (кошка) миелинизация зрительного нерва начинается перед рождением и достигает уровня взрослых особей на 6—8-й неделе после рождения [Ng, Stone, 1982]. Миелогенез в оптическом нерве крысы первые три недели идет синхронно с митотической пролиферацией и дифференциацией олигодендроглии [Hirose, Bass, 1973]. Изучен паттерн гистохимической активности энзимов в зрительном нерве млекопитающих в ходе миелинизации и ультраструктурные особенности недифференцированных олигодендроцитов, обсуждается участие олигодендроглиальных клеток различной степени зрелости в миелогенезе и роль аксонов в запуске этого процесса [Vaughn, 1969; Tennekoon et al., 1977; Cook, Chatti, Wishiewski, 1974; Wender et al.,1979,1980; Bohn, Friedrich, 1982; и др.]. Миелинизация зрительного нерва в постнатальном онтогенезе взаимосвязана с совер-шенствованием функции зрительного анализатора в целом [Дмитриева, 1979]. Таким образом, олигодендроглия сетчатки и оптического нерва имеет тссные топографические и биохимические отношения с нервными клетками. В настоящее время олигодендроглия довольно интенсивно исследуется параллельно с процессом познания взаимоотношений глиальной клетки и миелинизированиого нервного волокна в других отделах нервной системы [Сотников, 1976; Ходоров, 1979; Friedrich, Mugnaini, 1983; и др.].
Микроглия (микроглиоциты). Впервые микроглия была описана во внутреннем синаптическом слое, а также в зрительном нерве, в сетчатке человека, обезьяны, кошки, кролика и голубя [Lopez-Enriquez, 1926; Marchesani, 1926; Dubois, 1934]. Спустя значительное время она была найдена в наружном синаптическом слое сетчатки млекопитающих [Vrabec, 1953, 1970]. Однако многие авторы не отличали ее от безаксонных горизонтальных клеток и астроцитов (Boycott, Hopkins [1981]).
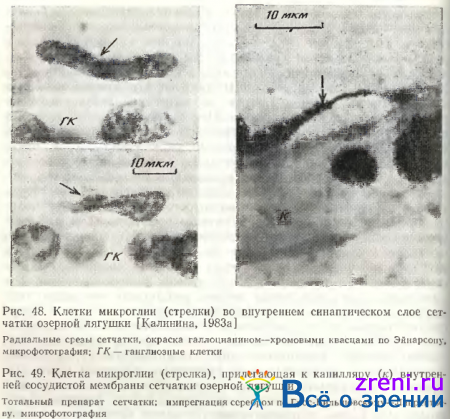
Микроглиальные клетки развиваются из мезенхимы и являются гистиоцитами центральной нервной системы [Авцын, Ильина, 1961]. Это определяет их строение и функции. У низших позвоночных микроглиальные клетки не имеют тонких отростков, ядра у них вытянутой, треугольной веретенообразной и валикообразной формы, реже округлые [Eckmiller, Steinberg, 1981; Калинина, 1983а]. У млекопитающих отростки микроглиоцитов напоминают дендриты горизонтальных клеток [Cammermeyer, 1970; Vrabec, 1970; Boycott, Ilopkins, 1981]. Нередко отростки и сами клетки примыкают к капиллярам, образуя «капиллярную ножку» (см., например, в сетчатке кошки [Boycott, Hopkins, 1981). В ганглиозном слое у всех позвоночных микроглиоциты часто являются сателлитами нейронов, а отростки посылают к капиллярам. При окрашивании галлоцианином и пиронином сетчатки лягушки у микроглиальных клеток четко выделяется интенсивно окрашенный узкий ободок цитоплазмы, повторяющий конфигурацию ядра. В ядре часто содержатся 2—3 ядрышка и превышающие их по размерам глыбки нуклеопротеидов (рис. 48).
Особенно отчетливо эти структуры выявляются при окрашивании сетчатки люминесцентными красителями (например, акридиновым оранжевым) и рассматривании под люминесцентным микроскопом. Интенсивность свечения этих клеток превосходит все остальные. Границы клеток всегда ясно очерчены, однако края неровные. Клетки могут достигать больших размеров, до 30 мкм в длину. Па тотальных препаратах сетчатки, когда можно наблюдать все ядро этих клеток целиком, видны амебовидные выросты, которые могут свидетельствовать о способности к передвижению. В электронном микроскопе эти клетки легко идентифицируются но отложению металла, маленькому ядру с выраженным хроматином, лизосомами и липофусциновым гранулам, длинным узким цистернам гранулярной эндоплазматической сети, расположенной обычно вокруг ядра, аппарату Гольджи [Kohno, Inomata, Tanigucki, 1982].
Эти характеристики присущи всем микроглиальным элементам центральной нервной системы. По поверхности сетчатки микроглия разбросана по одиночке или встречается небольшими группами от перипапиллярной области до Ora serrata, отсутствуя лишь в fovea [Vrabec, 1970; Kohno, Inomata, Tanigucki, 1982; Калинина, 1983а]. На периферии сетчатки лягушки (в частности) микроглиоциты расположены плотнее, чем в других зонах. На поверхности обеих пограничных мембран и за ними регулярно встречаются макрофаги [Wolter, 1960; Vrabеc, 1970; Eckmiller, Steinberg, 1981; Brackevelt, 1982], однако вопрос о том, могут ли они быть отнесены к микроглиальным клеткам, пока не решен.
Функции микроглии сетчатки до сих пор фактически не исследованы. По происхождению, форме, топографии и по аналогии с гистиоцитами центральной нервной системы они фагоцитирующие и переваривающие клетки. Для сетчатки низших позвоночных и некоторых млекопитающих такие подвижные клетки-санитары особенно важны, так как кровеносные капилляры не проникают у них внутрь сетчатки, а образуют лишь сосудистую мембрану на внутренней ее поверхности. Нами неоднократно наблюдались клетки микроглии, плотно прилегающие к капиллярам этой сосудистой сети (рис. 49).
По современным представлениям о структуре и функциях глиальных клеток сетчатки, наиболее полно исследованные мюллеровские клетки являются неотъемлемым компонентом сетчатки глаза. Деятельность их не сводится лишь к опорной и трофической роли. Мюллеровские клетки, несомненно, участвуют в поддержании гомеостаза сетчатки, регулируют ионный состав окружающей нейроны среды, направляют рост нервных отростков, участвуют в репаративных процессах. Таким образом, их роль в сетчатке полифункциональна. Удивительная асимметрия в строении и функциях этих нейроглиальных клеток, несомненно, должна привлечь внимание цитологов и нейрофизиологов. Мюллеровские клетки могут служить удобной экспериментальной моделью для выяснения принципиальных вопросов нейроглиальных взаимоотношений в центральной нервной системе.
Олигодендроглия и астроглия исследованы в меньшей степени, чем клетки Мюллера. Их взаимоотношения с нейронами сетчатки пока еще мало понятны. Не ясно, взаимодействует ли одна и та же ганглиозная клетка одновременно и с астроцитом, и с олигодендроцитом, какова роль этих элементов в метаболизме нервных клеток, могут ли они служить хранилищем резервных макромолекул (например, РНК), возможно ли передвижение клеток глии, их ядер и отростков при функциональных нагрузках, в чем специфика деятельности разных типов клеток.
Достижения гистохимии и, в частности, иммуногистохимии последних лет открывают большие возможности для исследования глиальных элементов сетчатки. Возможность с помощью антигенных спектров отличать нейроны от глиальных клеток [Michailovic, Hydcn, 1969], использование функциональных маркеров в этих целях, например гликолитического фермента энолазы [Marangos et al., 1979], открывают перспективу четкой идентификации нейронов и глии. Обнаружение специфического белка астроцитов (ФКБГ) и получение моноклональных антител к нему [Bignami, Dahl, 1976; Pruss et al., 1981; Molnar et al., 1984] могут расширить возможности исследования функций астроцитарной глии.
Дальнейшее развитие микроэлектродной техники и электрофизиологии в целом, несомненно, дадут возможность более детального исследования роли глиальных клеток в электрических процессах сетчатки. Представляют большой интерес информационные взаимодействия нейронов сетчатки с глией, например данные о том, что ацетилхолин выполняет функцию медиатора в системе нейрон—нейроглия, участвует в передаче информации от нейронов к глии [Алексидзе, 1974; Мустафин,1979], могут быть положены в основу исследования взаимодействия мюллеровских волокон и нейронов внутренних отделов сетчатки. Необходимы также дальнейшие исследования топографии разновидностей клеток глии по поверхности сетчатки, их процентного соотношения в эволюционном ряду позвоночных животных.
----
Статья из книги: Нейроны сетчатки | Е.Г. Школьник-Яррос, А.В. Калинина



Комментариев 0