Физиология зрительной рецепции (Часть 1)

Содержание:
Описание
Общие свойства сенсорной системы
Сенсорной системой называют часть нервной системы, состоящую из сенсорных рецепторов, нервных путей, передающих информацию в мозг, и частей мозга, которые перерабатывают эту информацию. Работа любой сенсорной системы начинается с восприятия рецепторами внешнего физического или химического стимула, его трансформации в нервные сигналы.
Сенсорная система выполняет следующие основные операции:
- обнаружение и различение сигнала,
- его преобразование и передачу,
- кодирование признаков,
- детектирование признаков,
- опознание образов.
Сенсорная трансдукция. Обнаружение и первичное различение сигналов обеспечивается рецепторами - специализированными клеткам!, воспринимающими сигналы определенной модальности и преобразующими их из физической или химической форм в форму нервного возбуждения. Преобразование энергии внешнего раздражения в рецепторный сигнал и называется трансдукцией сенсорного сигнала.
Этот процесс включает в себя три основных этапа:
- взаимодействие сенсорного стимула, т.е. кванта света (зрение), молекулы пахучего или вкусового вещества (обоняние, вкус) с рецепторной белковой молекулой или механической силы (слух, вестибулярная система, осязание) с мембраной рецепторной клетки;
- усиление сенсорного сигнала и его передачу внутри рецепторной клетки; и, наконец,
- увеличение или уменьшение проводимости клеточной (плазматической) мембраны рецепторной клетки (т.е. открывание или блокирование находящихся в ней ионных каналов), что приводит к деполяризации или гиперполяризации этой мембраны. Рецепторным потенциалом, независимо от того, это де- или гиперполяризация, называется изменение потенциала на клеточной мембране рецепторной клетки.
Абсолютная чувствительность специализированных рецепторных клеток сенсорной системы к адекватным стимулам предельно высока. Фоторецепторная клетка (палочка) может быть возбуждена всего одним поглощенным квантом света, обонятельная клетка - всего одной молекулой пахучего вещества, например, феромона - пахучего сигнала для насекомого.
Ограничение избыточности информации. Информация, поступающая от рецепторов, могла бы очень быстро насытить все информационные резервы мозга. Поэтому сенсорная система пропускает в центральные, мозговые отделы сигналы лишь о начале и конце раздражения (временное преобразование). В случае зрительной рецепции - о предъявлении и исчезновении светового стимула.
Адаптация - общее свойство сенсорных систем - проявляется в снижении абсолютной и повышении дифференциальной чувствительности. Адаптационные процессы начинаются на уровне рецепторов, охватывая затем все нейронные уровни сенсорной системы. Когда действие постоянного раздражителя (света) прекращается, абсолютная чувствительность восстанавливается (темноват адаптация в случае зрения).
Зрительная система. Зрительная система поставляет мозгу более 90% всей сенсорной информации. Зрительный процесс начинается в фоторецепторах с проекции изображения на сетчатке. На пути к фоторецепторам свет проходит через несколько прозрачных оптических сред глаза - роговицы, хрусталик, стекловидное тело, а затем через все слои сетчатки.
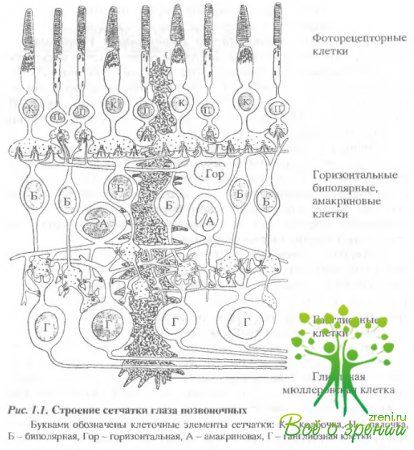
Сетчатка - это сложно организованная, многослойная структура, состоящая из слоя фоторецепторных клеток - палочек и колбочек и нескольких видов нервных клеток (рис. 1.1).
За слоем фоторецепторов расположен первый (наружный) синаптический слой. Рецепторный сигнал передается от рецепторов в первом синапсе следующим за ними нервным клеткам - биполярным и горизонтальным. Далее, за слоем этих клеток, расположен второй широкий внутренний синаптический слой. Сигналы от биполярных клеток передаются в синапсах этого слоя ганглиозными и амакриновым клеткам. В свою очередь, ганглиозные клетки, образующие последний клеточный слой сетчатки, по своим длинным аксонам передают информацию в виде нервных импульсов в подкорковые и корковые области зрительной системы. Горизонтальные и амакриновые клетки не принимают участия в прямом пути передачи зрительной информации от рецепторов к ганглиозным клеткам, но они играют важнейшую роль в процессах передачи и переработки информации на соответствующих уровнях сетчатки. Сетчатка, по существу, представляет собой сложный нервный центр или "часть мозга, помещенную в глаз".
Рассмотрим клеточную организацию слоев сетчатки, начиная от пигментного эпителия, который находится в теснейшей анатомической связи с фоторецепторными клетками сетчатки.
Спой пигментного эпителия образован эпителиальными клетками, содержащими, помимо обычного набора органелл, также пигментные гранулы - меланосомы, придающие пигментному эпителию почти черный цвет, и липофусциновые гранулы (содержащие "пигмент старости). Многочисленные отростки клетки пигментного эпителия плотно облегают наружные сегменты фоторецепторов
Пигментный эпителий играет решающую роль в ресинтезе (регенерации) зрительного пигмента, в фагоцитозе ' отработанных" обломков наружных сегментов фоторецепторов - палочек и колбочек, в обеспечении сетчатки кислородом и необходимыми веществами, наконец, в защите сетчатки, в первую очередь ее фоторецепторов, от опасности светового повреждения
Слой фоторецепторов (палочек и колбочек) примыкает к пигментному эпителию. В сетчатке глаза человека, например, около 6-5-7 млн колбочек и 110 -5-125 млн палочек. При этом центральная ямка сетчатки приматов и человека (fovea centralis) содержит только колбочки (до 140 тыс. на 1 мм2), к периферии сетчатки число колбочек уменьшается, а палочек - возрастает; на периферии сетчатки находятся уже только палочки. Палочки почти на два порядка чувствительнее к свету, чем колбочки. Колбочки обеспечивают дневное (фотопическое) и цветовое зрение, палочки - сумеречное (скотопическое).
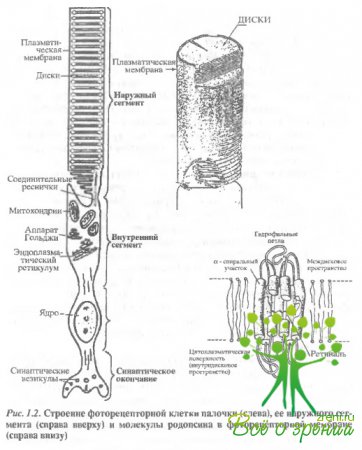
Фоторецепторные клетки - это вытянутые в длину палочки и колбочки, состоящие из наружного сегмента, внутреннего сегмента, соединительной ножки, ядерной части с крупным ядром и пресинаптического окончания (рис. 1.2).
Фоторецепторы сетчатки позвоночных, в отличие от беспозвоночных, обращены своими светочувствительными наружными сегментами от света (как было сказано, они прилегают к клеткам пигментного эпителия). Поэтому на пути к наружным сегментам свет проходит через все нервные слои сетчатки. Эта особенность устройства глаза позвоночных связана, вероятно, с необходимостью эффективного обеспечения как сложного биохимического (темнового) процесса регенерации зрительного пигмента, так и процесса непрерывного обновления наружного сегмента и фагоцитоза его обломков пигментным эпителием.
Наружный сегмент фоторецептора содержит от нескольких сот (у дневных животных) до нескольких тысяч (у животных, обитающих при низких освещенностях) фоторецепторных дисков. Наружный сегмент палочки, как правило, намного длиннее, чем колбочки.
Фоторецепторный диск образован двумя мембранами, соединенными по краям. Мембрана диска - это типичная биологическая мембрана, образованная липидным бислоем, в который погружены молекулы белков. Особенностью фоторецепторной мембраны диска позвоночных является ее низкая вязкость, подобная вязкости оливкового масла. Поэтому молекулы белка испытывают в ней быструю вращательную и более медленную латеральную диффузию.
Наружный сегмент фоторецептора соединен с внутренним модифицированной ресничкой, в которой имеется девять пар фибрилл по периферии, но отсутствуют две центральные. В палочке, как правило, диски отделены от клеточной (плазматической) мембраны, они как бы '"плавают" внутри цитоплазмы наружного сегмента и вместе с тем строго ориентированы перпендикулярно длинной оси клетки. Ориентация дисков в наружном сегменте обеспечивается цитоскелетом.
В колбочке, как правило, диски не замкнуты; они представляют собой впячивания плазматической мембраны наружного сегмента, и, следовательно, внутридисковое пространство "диска" колбочки - это внеклеточное пространство между ее наружным сегментом и отростками клетки пигментного эпителия
Внутренний сегмент содержит метаболический аппарат клетки, в том числе большое скопление митохондрий, обеспечивающих энергетические потребности фоторецептора, и аппарат Гольджи, принимающий участие в активном синтезе белка. Обновление фоторецепторных мембран наружного сегмент а палочки происходит примерно за две недели, в колбочках обновление происходит медленнее.
Ядерная часть фоторецепторной клетки содержит крупное ядро.
Пресинаптическое окончание фоторецептора (так называемые ножка колбочки и сферула палочки) содержит синаптическую ленту, вокруг которой локализовано множество синаптических пузырьков, содержащих нейромедиатор (глутамат).
↑ Механизмы фототранедукции
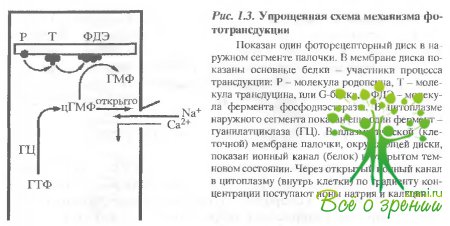
Общее преоставление о механизме фототранедукции. Механизм фототранедукции обеспечивает преобразование и усиление первичного светового сигнала почти в миллион раз и представляется в настоящее время следующим образом (рис. 1.3).
Квант света поглощается молекулой родопсина б, точнее ее хромофорной группой 11-цис-ретиналем, что приводит к его изомеризации в полностью-транс-форму. Эта реакция происходит менее чем за 200 фемтосекунд, является первой и единственной фотохимической реакцией в зрении Изомеризация ретиналя вызывает конформационную перестройку белковой части молекулы (опсина). Конформационно измененный родопсин приобретает способность взаимодействовать со следующим белком, а именно с G-белком или, как он называется а зрительной клетке, транедуцином (Т). Активированный трансдуцин, в свою очередь, активирует следующий белок - фермент фосфодиэстеразу (ФДЭ), который с высокой скоростью гидролизует низкомолекулярный внутриклеточный передатчик - циклический гуанозинмонофосфат (цГМФ;. Падение в цитоплазме зрительной клетки концентрации свободного цГМФ приводит к изменению поляризации ее клеточной мембраны, а именно к ее гиперполяризации. Гиперполяризационный электрический потенциал и представляет собой фоторецепторный сигнал; который передается в первом синапсе сетчатки следующим нервным клеткам - биполярным и горизонтальным.
Таким образом, цепочка процессов: родопсин-трансдуцин-фосфодиэстераза представляет собой каскад ферментативных реакций, обеспечивающих усиление (размножение) светового сигнала в 105-106 раз. Ключевым событием в восстановлении исходного темновою состояния зрительной клетки является активация фермента гуанилатциклазы (ГЦ), функция которого - синтезировать цГМФ из ГТФ
Более подробно современные представления о механизмах фототрансдукции изложены ниже.
Структура фоторецепторов и свойства зрительного пигмента родопсина. В сетчатке глаза позвоночных содержатся два типа фоторецепторных клеток - палочки и колбочки. Функции этих двух типов фоторецепторов различны. Палочки работают при очень низких (от 1 до 10 000 квантов на палочку) освещенностях: чувствительность же колбочек гораздо ниже, они работают при средние и высоких интенсивностях света и осуществляют восприятие цвета Палочки и колбочки различаются по форме и структуре Соотношение числа палочек и колбочек у разных видов животных сильно различается. Так, например, в сетчатке рыб, обитающих на больших глубинах, где освещенности небольшие, преобладают палочки, в то время как сетчатки животных, обитающих в условиях высоких освещенностей, например многих птиц, грызунов (белки), содержат преимущественно колбочки.
Кроме морфологических особенностей, палочки и колбочки различаются содержащимися в них зрительными пигментами.
Наружный сегмент. Рассмотрим подробнее структуру и биохимический состав наружного сегмента. Наружный сегмент палочки (НСП) имеет цилиндрическую форму. Диаметр его у разных видов животных варьирует в пределах 1-6 мкм, длина - в пределах 10-50 мкм. Структурно наружный сегмент палочки представляет собой стопку плотно упакованных замкнутых мембранных образований - фоторецепторных дисков, содержащих большое количество зрительного пигмента родопсина. Диски морфологически и электрически отделены от плазматической мембраны палички по всей длине наружного сегмента. Образуются диски в базальной части наружного сегмента как впячивания плазматической мембраны. Вновь образовавшиеся диски не отделены от плазматической мембраны, но в процессе формирования они отделяются и замыкаются таким образом, что наружная сторона цитоплазматической мембраны оказывается обращенной внутрь диска. "Диски" колбочек, в отличие от палочек, в онтогенезе не отделяются от плазматической мембраны и представляют собой просто складки цитоплазматической мембраны по всей длине наружного сегмента колбочки. Наружный сегмент колбочки в несколько раз короче наружного сегмента палочки и имеет коническую форму.
Наружные сегменты фоторецепторных клеток постоянно обновляются. По мере формирования новых дисков в базальной части наружного сегмента на апикальном конце идет постоянное отщепление и фагоцитоз старых дисков. В ходе этого процесса диск передвигается вдоль фоторецептора. Поэтому в базальной части палочки находятся диски с вновь сформированными мембранами, а по мере удаления от места формирования диски "стареют". В колбочках вновь образованные мембраны быстро перемешиваются со старой мембраной, и диски не перемещаются вдоль оси колбочки по мере старения. Скорость обновления фоторецепторных мембран измерена для разных видов животных. Она варьирует от 0,9 мкм в день для палочек лягушки до 2,7 мкм в день для колбочек ящерицы. Полное обновление палочки лягушки происходит за 55-80 дней, а палочек кошки и колбочек кошки, ящерицы и белки - за 5-7 дней.
Фоторецепторный диск представляет собой два мембранных бислоя дисковидной фермы, соединенных по краю диска. Диски ориентированы перпендикулярно продольной оси палочки. Расположение дисков строго периодично. Расстояние между центрами соседних дисков составляет 300 А, зазор между дисками - 150 А, толщина фоторецепторной мембраны - 60-70 А, расстояние между мембранами внутри диска - 10-30 А. Количество фоторецепторных дисков в одной палочке варьирует у разных животных от 500 до 2000.
Мембрана фоторецепторного диска состоит примерно на 40% из липицов и на 60% - из белка. Более 80% липидов фоторецепторной мембраны составляют липиды с полиненасыщенными жирнокислотными остатками (около 70% из них составляют фссфатидилэ-таноламин и фосфатидилхолин). Содержание холестерина в мембране очень низкое (около 2%). Этим обусловлена низкая вязкость (2 Пз) мембраны. Коэффициент латеральной диффузии молекулы родопсина в плоскости мембраны составляет 0,5 мкм/с, постоянная времени вращательной релаксации - 20 мкс.
Зрительные пигменты - мембранные белки, локализованные в фоторецепторной мембране. Они состоят из гликопротеиновой части (опсина) и хромофорной. Опсины фоторецепторных клеток различных типов и видов беспозвоночных и позвоночных животных, а также человека различаются (во всяком случае, в неконсервативных участках опсина), в то время как хромофорная часть у всех зрительных пигментов одинаковая - это 11-цис-изомерная форма ретиналя,, (альдегида витамина А,) или ретикаля2 (альдегида витамина А,). Хромофоры могут быть двух типов - 11 цисретиналь, и 11-цис-ретиналь2. Ретиналь2 отличается от ретиналя, наличием одной дополнительной двойной связи в б - иононовом кольце. В первом случае зрительные пигменты попадают в класс родопсинов, во втором - в класс порфиропсинов, спектры поглощения которых, как правило, расположены в более длинноволновой области спектра, нежели у родопсинов. Широкий разброс положения максимумов спектров поглощения зрительных пигментов от ультрафиолетовой области (?макс= 360 нм) до красной (?макс= 620 нм) определяется составом аминокислотных остатков опсина и их расположением относительно 11 –цис-ретиналя в хромофорном центре молекулы. Так, например, в палочках сетчатки человека содержится пигмент родопсин с максимумом спектра поглощения ?макс = 500 нм, а в трех типах колбочек (сине-, зелено- и красночувствительных) содержится соответственно три типа зрительных пигментов с максимумами спектров поглощения в синей (420 нм), зеленой (531 нм) и красной (558 нм) областях видимого спектра. Красный колбочковый пигмент часто называют иодопсином.
↑ Преобразование света в зрительной клетке и генерация фотоответа
Все процессы, происходящие в зрительной клетке, приводящие к генерации на ее мембране фототока, по их пространственной локализации можно условно подразделить на два относительно независимых процесса. Первый происходит в междисковом пространстве цитоплазмы клетки. Он включает в себя фото-возбуждение родопсина, взаимодействие его с трансдуцином, активацию и соответственно деактивацию фосфодиэстеразы и гуанилатциклазы. Заканчиваются эти процессы изменением концентрации цГМФ в цитоплазме зрительной клетки. Условно все эти процессы можно назвать фотоферментативными. Второй этап происходит непосредственно на плазматической мембране зрительной клетки и включает в себя, по существу, только два процесса: взаимодействие цГМФ со специфическими цГМФ-регулируемыми каналами и регуляцию концентрации внутриклеточного кальция через Na+/C2+/К+ - обменник. Именно на втором этапе происходят изменения внутриклеточного потенциала, которые и являются сенсорным сигналом. Условно процессы, происходящие на втором этапе, можно назвать биоэлектрохимическими. Связь между фотоферментативными и биоэлектрохимическими реакциями осуществляется только через изменение концентрации внутриклеточного кальция. Такое условное разделение в сложном механизме фототрансдукции облегчало их изучение и соответственно облегчит нам их изложение.
Фотоферментативные реакции также можно разделить на два этапа: активацию и деактивацию. Активационные процессы приводят к уменьшению концентрации цГМФ в клетке, а деактивационные - к восстановлению его исходной концентрации.
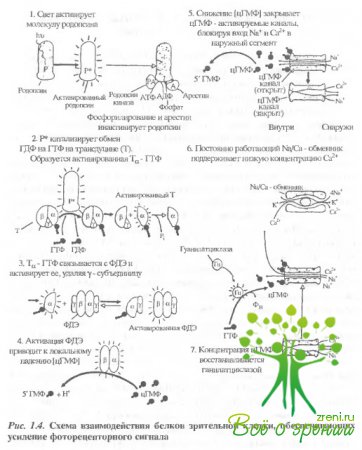
Активация. Активационная часть каскада фототранедукции представляет собой ряд последовательных реакций. При поглощении кванта света молекула родопсина переходит в активное состояние. Возбужденный родопсин активирует транедуцин. Трансдуцин, в свою очередь, связывается с фосфодиэстеразой, сильно повышая ее гидролитическую активность в отношении цГМФ Каталитическая активность комплекса трансдуцин/фосфодиэстераза приводит к быстрому падению внутриклеточной концентрации цГМФ. Это вызывает закрытие цГМФ-чуствительных мембранных катионных каналов. В результате мембрана гиперполяризуется, что приводит к высвобождению медиатора фоторецепторной клеткой.
Активация родопсина является первым этапом каскада гранедукции. Поглощение фотона вызывает изомеризацию хромофора 11 –цис-ретиналя в плотностью – транс – форму и запускает цепь последовательных темповых реакций в родопсине - фотолиз родопсина.
Фотолиз родопсина приводит к образованию активированного фотопродукта, который, в свою очередь, активирует G-белок зрительной клетки трансдуцин (рис. 1.4).
Показано, что этик; активированным фотопродуктом является метародопсин II, причем для образования активированной формы существенно депротонирование Шиффова основания родопсина. Трансдуцин (T), периферический белок с молекулярной массой около 80 кДа, состоит из трех субъединиц - Т?, Т? и Т? Я образовании стабильного комплекса между субъединицами и их последующей диссоциации большую роль играет А1а-23. Сам трансдуцин является гетеротримером. Трансдуцин содержится в палочке в количестве 1/10 по отношению к родопсину. В темноте с Т? связана молекула ГДФ. В результате освещения активированный родопсин связывается с трансдуцином и катализирует замену ГДФ на ГТФ. Затем комплекс диссоциирует на родопсин, Т? -ГТФ и Т?? Одна молекула метародопсина II за время своей жизни успевает катализировать около 500 таких реакций.
Непосредственное измерение скорости активации трансдуцина проводилось физическими и бихимическими методами, тем не менее полной ясности на сегодняшний день нет.
Исследования, проведенные методом инфракрасного светорассеяния при насыщающей концентрации показали, что активация трансдуцина проходит со скоростью 700-1000 с-1. С другой стороны, оценки, основанные на биохимических методах, таких как измерение ГТФ связывания с нитро- целлюлозными фильтрами, дали существенно меньшие значения. В работах были получены величины скорости активации трансдуцина порядка 100 Ранее считалось, что такие низкие значения скорости активации могли быть следствием разрушения наружного сегмента палочки и растворения некоторых клеточных компонент при проведении биохимических экспериментов Однако в последних исследованиях было показано, что степень разрушения внешнего сегмента палочки не влияет на наблюдаемую скорость активации трансдуцина родопсином. Таким образом, причина несоответствия наблюдаемых разными методами скоростей активации трансдуцина остается неясной.
После активации молекула трансдуцина связывается с фосфодиэстеразой, обеспечивая полную активацию эффектора при стехиометрическом соотношении 2:1. Образование такого комплекса сильно стимулирует гидролитическую активность фосфо-диэстеразы Фосфодиэстераза (ФДЭ) - фермент, катализирующий гидролиз цГМФ, присутствует в клетке в количестве 1/50-1/100 по отношению к родопсину. В инактивированном состоянии ФДЭ представляет собой комплекс из трех субъединиц, ФДЭ, ФДЭ? и ФДЭ?, с молекулярными массами соответственно 88, 84 и 110 кДа в бычьих НСП и 95, 94 и 130 кДа - в лягушачьих. ФДЭ? содержит 858 остатков, ФДЗ соответственно - 87. Одна из этих субъединиц, ФДЭ?, ингибирует фосфодиэстеразную активность фермента. Взаимодействие ФДЭ с Т?-ГТФ приводит к отщеплению ингибиторной субъединицы ФДЭ. Установлено, что ключевым во взаимодействии с Т? является участок 24-45, включающий остатки Arg и Lys.
Освободившаяся от ФДЭ? ФДЭ?? обладает высокой каталитической активностью, позволяющей гидролизовать до 2000 молекул пГМФ в секунду. Таким образом, результатом описанного ряда ферментативных реакции является гидролиз около 500 0СЭ молекул цГМФ на 1 поглощенный фотон.
Проведенные сравнения показали близкие значения скоростей образования комплексов Р*-Т и Т-ФДЭ при фотоотыте. Это говорит о быстроте протекания реакции между трансдуцином и фосфодиэстеразой.
Гидролитическая активность фосфодиэстеразы приводит к быстрому падению внутриклеточной концентрации цГМФ. Ранее скорость этого процесса характеризовалась соотношением Ккат/Км = 7 х 106 М-1, (где Ккат - максимальная скорость гидролиза цГМФ одной субъединицей при насыщающей концентра/щи субстрата, а Км - константа Михаэлиса). На основе этих данных был предложен метод количественного расчета скорости активации фосфодиэстеразы (и соответственно трансдуцина). Используя полученную эмпирически зависимость мембранного тока от концентрации цГМФ, авторы определили скорость падения концентрации цГМФ из кинетики нарастания электрического фотоответа. Далее, из приведенного выше значения Ккат/Км была оценена скорость активации каталитических субъединиц фосфодиэстеразы, которая составила -5000 с-1. Полученное таким образом значение позволяло считать результаты экспериментов по светорассеянию более реальными, нежели результаты биохимических экспериментов.
Однако ряд новых данных свидетельствует о том, что скорости активации трансдуцина и фосфодиэстеразы все-таки могут быть ниже, чем поедполагалось ранее Так, последние оценки константы Михаэлиса ФДЭ (около 10 мкМ) оказались существенно ниже используемых в работе. При учете значения Ккат равным 2200 с-1 на одну субъединицу, соотношение Ккат/Км окажется равным 2 х 108 М-1 с-1. При внесении соответствующей поправки в модель, получим новое значение скорости активации прю. что хорошо согласуется с результатами биохимических экспериментов.
Итак, последние исследования вносят некоторые изменения в кинетическую картину каскада. Вероятно, скорость активации трансдуцина ниже, чем считалось ранее, а каталитическая активность ФДЭ, напротив, выше, чем предполагалось.
Последний этан процесса активации - это закрытие цГМФ- зависимых катионных каналов в плазматической мембране в ответ на падение внутриклеточной концентрации цГМФ.
То, что ЦГМФ является основным непосредственным регулятором светочувствительной проводимости плазматической мембраны палочки, не вызывает сомнений. Ряд данных свидетельствует о том, что цГМФ является не единственным регулятором проводимости каналов в плазматической мембране. АТФ, АДФ и цАМФ, трансдуциг. и фосфодиэстераза также могут прямо регулировать проводимость активируемых цГМФ-каналив, однако никаких данных, указывающих на то, что такой механизм реально задействован в процессе фототрансдукции, нет.
Концентрация цГМФ, обеспечивающая открытие половины максимального числа каналов, равна 10-40 мкМ, и эта величина превосходит предполагаемую внутриклеточную концентрацию свободного цГМФ, равную 5 мкМ. А так как коэффициент Хилла для взаимодействия ц1 МФ с каналами имеет значение от 2 до 3, то относительно небольшое изменение концентрации цГМФ вызывает значительное изменение тока, протекающего через каналы
В работах было показано, что взаимодействие между цГМФ и соответствующими мембранными каналами занимает несколько миллисекунд. Таким образом, процесс активации фотоответа лимитируется не временем ответа каналов, а скоростью падения концентрации цГМФ и, следовательно, определяющими реакциями при кинетическом рассмотрении активационного каскада являются активация трансдуцина родопсином и гидролиз цГМФ фосфодиэстеразой.
Итак, описанный выше каскад активационных реакций позволяет добиться высокой степени усиления входящего сигнала. При этом каждая фотоизомеоизация родопсина приводит к уменьшению вводного тока на 105 или даже более катионов.
Такое существенное усиление сигнала обеспечивается благодаря трем процессам каскада трансдукции.
- каждая возбужденная молекула родопсина активирует множестве молекул транедугина;
- каждый активный комплекс трансдуцин/фосфодиэстераза вызывает гидролиз большого числа молекул цГМФ;
- на падение концентрации цГМФ отвечает множество специфичных каналов, при етом каждый канал в открытом состоянии позволяет втекать катионам внутрь клетки с достаточно большой скоростью.
Деактивация. Под термином "деактивация" будем понимать совокупность реакций, приводящих к восстановлению мембранного потенциала клетки.
[banner_centerrs]
{banner_centerrs}
[/banner_centerrs]
Деактивация обеспечивается тремя основными процессами
- а) выключением активной формы родопсина;
- б) выключением активного комплекса трансдуцин/фосфоди-эстераза;
- в) восстановлением начальной концентрации цГМФ и соответственно открытием специфических каналов.
Время жизни активного продукта фотолиза родопсина – метародопсина ІІ (МІІ*) - составляет несколько минуя, поэтому для превращения МІІ* в неактивный продукт (т.е. продукт, который не активирует трансдуцин) необходим специальный механизм. Такими процессами в фототрансдукции являются фосфорилирование родопсина и связывание специфического белка - арестина. В темновом состоянии родопсин является гликопротеидом: к остатку треонина, локализованному на цитоплазматической поверхности, присоединены две олигосахаридные цепи. Освещение родопсина приводит к дополнительному фосфорилированию Этот процесс носит гетерогенный характер, В родопсин включается от 2 до 8 сахарных остатков. Родопсин фоссрорилируется специфической родопсинкиназой. Это фермент с молекулярной массой 62 кДа. При освещении фосфорилируются два остатка - Треонин -340 и Серин-342, оба локализованы в С-концевом пептиде
Следует отметить, что и при возбуждении даже единичных молекул родопсина при однофотонных засветках воспроизводимость кинетики фотоответов очень высока и практически не варьирует. Это означает, что механизм деактивации должен обеспечивать такую невариэбелъность
Какими же молекулярными механизмами обеспечивается высокая стабильность фотоответов. Очевидно, что критическим звеном воспроизводимости фотоответа является первый этап каскада усиления, т.е. время жизни активной формы родопсина, и важно понять, как стабилизируется время жизни отдельных молекул родопсина. Оказалось, что эта задача решается за счет многоступенчатого механизма деактивации родопсина. Установлено, что С-концевой остаток молекулы родопсина содержит множественные сайты фосфогшлирования (6 у мыши и 7 у быка). Последние физиологические эксперименты на трансгенных мышах показали, что активированный родопсин может фосфорилироваться на всех 6 сайтах во время нормальной деактивации.
Таким образом, хотя каждая отдельная реакция фосфорилирования является стохастичкой и невоспроизводимой, в целом время жизни активного родопсина оказывается достаточно стабильным.
Фосфорилирование родопсина частично предотвращает связывание Т-ГТФ. По-видимому, главную роль в этом процессе играют электростатические взаимодействия. Однако полностью ингибировать процесс активации трансдуцина фосфорилирование родопсина не может. Фосфорилирование влияет лишь на константу связывания родопсина с Т-ГДФ, но не влияет на процесс активации трансдуцина и переход Т-ГДФ в Т-ГТФ.
С фосфорилированным родопсином связывается другой тканеспецифический белок фоторецепторной клетки - арестин. Это белок с молекулярной массой 48 кДа, который связывается преимущественно с фосфорилированным родопсином, препятствуя его взаимодействию с трансдуцином. Аресгин итибирует дефосфорилирование фотолизированного родопсина, но не влияет на фосфорилирование темнового. Таким образом, вместе оба эти процесса приводят к инактивации трансдуцина.
То, что арестип играет ключевую роль в инактивации, показано и в электрофизиологическом эксперименте. При регистрации фотоответов палочек сетчатки трансгенных мышей, у которых отсутствовал арестин, было установлено, что фотоответ в этом случае сильно затянут во времени.
↑ Роль кальция в механизме фототрансдукции
Фоновый подсвет уменьшает чувствительность фоторецепторной клетки в соответствии с законом Фехнера. Этот феномен, известный как световая адаптация, исследовался, в частности, при регистрации фотоответов палочек и колбочек при фоновом подсвете. Фоновый подсвет приводил к изменениям в параметрах фотоответа зрительных клеток, в частности к ускорению фотоответа и уменьшению его амплитуды. В основе этого явления лежит изменение внутриклеточной концентрации свободного кальция. В том случае, когда внутриклеточные изменения кальция были сведены к минимуму, клетки теряли способность к световой адаптации.
Введение кальциевого буфера ВАРТА в палочку приводило к изменению световой чувствительности и времени восстанозления фотоответа, что также подтверждает то, что именно кальций играет ключевую роль в световой адаптации и механизме восстановления светового сигнала.
Изменения концентрации внутриклеточного кальция. Согласно кальциевой гипотезе, предложенной в 1970 г., роль медиатора в палочке играют ионы Ca2+. Предполагалось, что диски являются кальциевым депо, в котором в темноте концентрация кальция гораздо выше, чем в цитоплазме Освещение вызывает высвобождение Са2+ из дисков, причем время, необходимое для выхода Са2+, должно быть сравнимо со временем электрофизиологического ответа палочки, а количество его должно быть достаточным, чтобы заблокировать более 100 каналов на изомеризацию, т.е. обесцвечивание одной молекулы родопсина должно вызывать высвобождение более 100 ионов Са2+. Однако было установлено, что концентрация кальция при освещении не возрастает, а уменьшается. Так, измерения внутриклеточной концентрации кальция с помощью акварина показали, что она, по разным оценкам, составляет 0,6-0,22 мкМ. При освещении эта величина уменьшалась до неизмеримой с постоянной времени 0.5-1,6 с. Минимальная концентрация внутриклеточного кальция может быть оценена теоретически на основании уравнения Ходжкина в предположении, что основным элементом, поддерживающим внутриклеточную концентрацию кальция, является Na+/Са2+/К+-обменник. Такая оценка дает величину 1,8 х 10-10, хотя это можно считать только нижним пределом возможной концентрации. Реально при освещении концентрация кальция падает, по-видимому, до 140 нМ. Сильное освещение вызывает экстракцию внутриклеточного кальция обменником со скоростью 1,7 х 106-2 х 107 ионов в секунду.
Оценки показывают, что внутриклеточное содержание кальция в наружном сегменте значительно больше, чем его внутриклеточная концентрация. Это означает, что большая часть кальция находится в связанном состоянии. Общее содержание кальция в наружном сегменте палочки составляет 0,2-1 моль Са2+/моль родопсина. Небольшая часть кальция находится во внутридисковом пространстве и может быстро обмениваться с цитоплазмой.
Наружный сегмент фоторецептора содержит два типа кальций-связывающих центров, различающихся по аффинности Роль низко аффинных центров играет, по-видимому, фосфати-дилсерин. Кроме того, кальций связан с несколькими кальций-связывающими балками в цитоплазме. Так, рекаверин содержит несколько кальций-связывающих центров. Сильным кальций-связывающим белком является арестин, концентрация которого в наружном и особенно во внутреннем сегменте фоторецептора достаточно высока. Под действием света концентрация арестина в наружном сегменте возрастает
Na+/Са2+/К+-обменник. Удаление кальция из наружного сегмента фоторецептора осуществляется Na+/Ca2+/K+ -обменником. Если бы выведение кальция осуществлялось только за счет Nа+/Са2+-обмена, то градиента ионов натрия было бы недостаточно для поддержания внутри клетки необходимой низкой концентрации кальция (как уже отмечалось, эта концентрация ниже, чем обычно встречается в клетках). Поэтому обменник в фоторецепторной клетке использует также и градиент ионов калия. Такой тип обмена уникален и не встречается в других клетках.[sup][/sup]
Зависимость обмена от концентрации натрия носит сигмолдный характер с коэффициентом Хилла 2-2,3. Это означает, что процесс кооперативный, и для работы обменника необходимо связывание, по крайней мере, грех ионов натрия. Процесс обмена специфичен и может быть активирован только ионами натрия.
Обменник локализован только в плазматической мембране с плотностью 200-4.50 мкм~2. Его молекула представляет собой одиночную полипептидную цепь с молекулярной массой 220 кДа. В темноте обменный ток составляет 1 пА, что соответствует переносу 1,7 х 107 ионов кальция в секунду. Таким образом, одна молекула обменника переносит примерно 300- -600 ионов кальция в секунду. В основном регуляция обмена осуществляется путем изменения ионной концентрации внутри клетки, однако есть данные, что обменник взаимодействует с ЦН-каналом.
Влияние кальция на механизм фототранедукции. Как обсуждалось, кальций непосредственно не участвует в процессе генерации фототока, но играет регуляторную роль в работе фоторецепторной клетки. Долгое время предполагалось, что кальций может как ингибировать фосфодиэстеразу, так и активировать гуанилатциклазу (ГЦ) В электрофизиологических экспериментах было показано, что изменение внутриклеточной концентрации кальция призодит к увеличению темнового тока, и этот эффект сопряжен с ингибированием ГЦ. Уменьшение концентрации кальция от 200 до 20 нМ приводит к мвадцатт,кратному увеличению активности гуанилатциклазы. Процесс активации - кооперативный и характеризуется коэффициентом Хилла 3,9. Активация гуанилатциклазы кальцием происходит при участии активируемого кальцием белка.
С другой стороны, электрофизиологические эффекты кальция могут быть, в принципе, объяснены и прямым его действием на процесс фототранедукции Так, введение в цитоплазму наружного сегмента палочки Са7+-содержащего буфера ВАРТА не влияет на фазу нарастания сигнала, но существенно удлиняет время его восстановления. Этот эффект интерпретировался как влияние Са2+ на время жизни одного компонента каскада фототранедукции (активированного родопсина, транедуцина или фосфодиэстеразы). В фоторецепторах лягушки 1 мкм Са2+ увеличивал активируемую светом активность ФДЭ на 50%.
При исследовании формирования комплексов родопсин-транедуцин, проведенных по измерению светорассеяния в растворах изолированных белков, было также показано, что кальций влияет на время жизни комплексов.
Роль кальция в восстановлении фотоответа. Процесс восстановления темнового тока в фоторецепторе (восстановление фотэответа) связан с закрытием ЦН-каналоз, вызванным увеличением концентрации цГМФ. Стехиометрия процесса примерно такова- ГЦ и ФДЭ присутствуют в клетке в эквимолярных количествах, в темноте ФДЭ гидролизует 0,8 молекул цГМФ/с, и при насыщающем освещении эта величина возрастает до 5000. В темноте ГЦ синтезирует 1 молекулу цГМФ/с, и эта скорость увеличивается в 10 раз при уменьшении концентрации кальция. Принимая среднее значение Км для фосфодиэстеразы ~1 мМ и концентрацию цГМФ в клетке 2 мкМ, получим, что скорость гидролиза цГМФ при максимальном освещении составляет 0,3 мМ цГМФ/с. Аналогичная величина для синтеза нГМФ гуанплатциклазой при низком содержании кальция составляет 0,23 мМ цГМФ/с. Таким образом, активности ФДЭ и ГЦ примерно одинаковы как в темноте, так и при освещении, и процесс восстановления фототока не может быть обусловлен только активацией ГЦ, а должен быть сопряжен с дезактивацией ФДЭ за времена, характерные для фазы восстановления фототока (~с)
Гуанилатциклаза. Выше мы рассмотрели реакции, ингибирующие процесс фототрансдукции и таким образок; прекращающие гидролиз цГМФ в клетке. Ключевым ферментом, обеспечивающим восстановление фотоответа, является ГЦ Содержание ГЦ в наружном сегменте составляет 1-5% (1 молекула ГЦ на [00 молекул родопсина) Очищенная ГЦ представляет собой белок с молекулярной массой 112 кДа) и активностью 100- 700 нмоль/мин/мг белка. Это соответствует гидролизу 0,2- 1,3 молекул цГМФ/с.
В различных клетках встречаются три типа ГЦ водорастворимая, мембрансвязанная и ассоциированная с цитоскелетом. В работ е 1 Ц важную роль играет ее ассоциация с аксонемами. Поскольку большая часть ГЦ связана с микротоубочками цитоскелета, она очень трудно стабилизируется. Для эффективной работы ГЦ необходимо наличие в HCII активной пирофосфатазы (пирофосфат, образующийся при гидролизе ГТФ, является ингибитором активности ГЦ) Действительно, в HCII была обнаружена значительная активность пирофосфатазы. Оказалось, что пирофосфатаза НСП является кальций-чувствительным ферментом, и это обеспечивает дополнительную обратную связь между входящим током и активностью ГЦ
Большая часть цГМФ в фоторецепторе находится в связанном состоянии Действительно, только 1-2% ЦН-каналов в клетке открыто в темноте, что соответствует свободной концентрации цГМФ 1-4 мкМ Общая же концентрация цГМФ в клетке составляет 50-60 мкМ
↑ Цитоскелетная организация сроторецепторной клетки
Механизм ограничения диффузии медиатора в фоторецепторной клетке не ясен. Можно предположить что в клетке существуют какие-то структуры, затрудняющие диффузию в продольном направлении. С другой стороны, поскольку все процессы синтеза протекают во внутреннем сегменте, должна существовать эффективная система транспорта веществ из внутреннего сегмента в наружный. Так, например, основная часть гуанилатциклазы в палочке связана с аксонемой.
Микротрубочки аксонемы протягивается от базальной части почти на всю длину палочки у млекопитающих и на 2/3 ее длины у лягушки. Субстрат гуанилатциклазы - ГТФ - синтезируется во внутреннем сегменте палочки, в митохондриях, поэтому для эффективного восстановления концентрации после гидролиза ГТФ должен быть транспортирован из внутреннего сегмента с большой скоростью.
Вдоль наружного сегмента транспортируются не только нуклеотиды, но и более крупные молекулы. Так, показано, что арестин в темноте в большой концентрации содержится во внутреннем сегменте палочки. При освещении значительная часть его переходит в наружный сегмент. С другой стороны, ионы Са2+, введенные во внутренний сегмент, по-видимому, не транспортируются в наружный, поскольку такая инъекция не оказывает влияния на ток палочки, хотя инъекция Са2+ в наружный сегмент подавляет ток.
Таким образом, движение одних веществ в палочке затруднено, в то время как другие переносятся весьма эффективно, т.е. в палочке должна существовать избирательная система транспорта веществ из внутреннего сегмента в наружный. В других клетках, например, в нейронах в системе аксонального транспорта, такими активными переносчиками веществ, по-видимому, явлются цитоскелетные структуры.
Морфологическое изучение цитоскслетной организации фоторецепторов началось в конце 70-х годов прошлого века. В работах изучали распределение актина и тубулина во внутренних сегментах палочек и колбочек методом микроскопии тонких срезов. Используя ингибиторы сборки цитоскелета, авторы показали, что цитоскелетные структуры внутренних сегментов играют важную роль в механизме ретиномоторных движений фоторецептороз. Применение электронной микроскопии и глубокого травления позволило обнаружить и частично идентифицировать ряд элементов цитоскелета в НСП. Иммунофлуоресцентное окрашивание показало, что в базальной части НСП локализованы фодрин, актин, микротрубочки и кальмодулин. Все они прокрашиваются в виде отдельных полосок, берущих начало в цилиуме и протягивающихся в наружный сегмент. Актин интенсивно прокрашивается в чашевидных выступах и в цилиуме, а также в цитоплазме под вновь образованными дисками. По всему НСП окрашивается примембранный актин. Функциональная роль этих структур неизвестна. Исходя из их локализации, было высказано предположение, что очи играют определенную роль в образовании новых дисков и обновлении мембраны. Наличие кальмодулина и кальмодулин-зависимого кросс- сшивателя фодрина предполагает участие Са2+ в этом процессе. Есть данные, что микрофиламенты необходимы для отщепления дисков на апикальном конце палочки.
Вещества, разрушающие актиновые филаменты, ингибировали отщепление дисков in vitro. Вещества, разрушающие микротрубочки, напротив, активировали отщепление дисков, но в специфических условиях при низкой концентрации бикарбоната в культуральной среде. Роль микротрубочек г, отщеплении дисков не ясна. Предполагалось, что длина цилиарных микротрубочек может определять соответствующее положение на оси НСП для отщепления дисков. Однако было показано, что длина цилиарных микротрубочек в НСП лягушки обычно тишь немного превышает 1/2 длины НСП и вряд пи влияет на расположение места нормального отщепления дисков. Дистальный конец НСП, в отличие от базального, содержит кластеры необычных, похожих на микротрубочки филамечтов. Эти филаменты, длиной около 25 нм, протягиваются вдоль оси фоторецепторной клетки под плазматической мембраной пучками по 4-6 филаментов. Антителами к микротрубочкам эти филаменты не окрашиваются. Кроме того, в палочке обнаружено множество коротких филаментов, которые не удалось идентифицировать биохимически.
Тонкие филаменты длиной около 15 нм, соединяющие между собой диски, расположены регулярно, через 14 нм. Филаменты, соединяющие диски с плазматической мембраной, имеют разветвленную структуру, их длина достигает 30 нм. По-видимому, биохимически эти два типа филаментов отличаются друг от друга. Обнаружены также внутридисковые филаменты.
Добавление Mg2+ -ATФ к суспензии НСП с разрушенными плазматическими мембранами вызывает рост филаментов из этих НСП. Рост филаментов проявлялся в уменьшении околоинфракрасного рассеяния в суспензии НСП. Этот рост филаментов ингибировался ванадатом и дициклокар-бодиимидом и был нечувствителен к колхицину, колцемиду и цитохалазинам В и D.
При исследовании цитоскелета колбочек во внутренних сегментах была обнаружена развитая сеть микротрубочек, актиновых и промежуточных филаментов. По-видимому, они участвуют в темповом удлинении и светоиндуцированном сокращении колбочек. В наружных сегментах колбочек цитоскелетные структуры не обнаружены.
Функциональная роль цитоскелетных структур фоторецепторной клетки, о которых к настоящему времени накоплено достаточное количество морфологических данных, до сих пор практически не изучалась. Между тем, локализация цитоскелетных структур и их способность связывать и транспортировать вещества предполагают возможность их участия в механизмах трансдукции и адаптации зрительной клетки.
Статья из книги: Молекулярные механизмы зрительной рецепции | Каламкаров Г.Р., Островский М.А..


Комментариев 0