Механизмы фотоповреждения сетчатки и пигментного эпителия и системы защиты от опасности такого повреждения
Содержание:
Описание
Сетчатка- это единственная часть нервной системы, доступная свету. Известно, что избыток света способен привести к ее повреждению. Согласно эпидемиологическим данным, существует корреляция между интенсивностью и спектральным составом света, с одной стороны, и с развитием ряда глазных заболеваний, в частности, такого распространенного, как старческая макулярная дегенерация сетчатки, с другой.
Таким образом, свет в зрении выполняет не только функцию носителя информации, но представляет собой также и фактор риска, в первую очередь - для сетчатки. Поэтому в ходе эволюции органов зрения и у беспозвоночных, и у позвоночных совершенствовались две тесно связанные друг с другом функциональные системы: собственно фоторецепции и защиты от опасности светового повреждения.
Световое повреждение достаточно подробно описано у животных и человека. Обычно рассматриваются два типа светового повреждения: во-первых, как результат длительного, хронического воздействия света на сетчатку и, во-вторых, как следствие хотя и непродолжительного, но интенсивного воздействия на нее. В первом случае речь идет об относительно низких уровнях освещенностей и, что существенно, - о максимуме спектра действия в области 500 нм, совпадающем со спектром поглощения родопсина. Во втором случае максимум спектра действия фотоповреждения находится в коротковолновой области спектра: синий свет оказывается примерно в 50 раз эффективнее, нежели зеленый или тем более красный.
В основе механизмов светового повреждения сетчатки и пигментного эпителия лежат процессы фотосенсибилизированного свободнорадикального окисления. Как известно, эффективность реакции сенсибилизированного фотоокисления определяется тремя факторами: собственно фотосенсибилизатором, субстратом окисления и кислородом. В сетчатке, в первую очередь в ее фоторецепторных клетках, а также в клетках пигментного эпителия все три фактора присутствуют в полной мере. Остановимся подробнее на этих факторах.
↑ Фотосенсибилизаторы
Ими могут служить как эндогенные, так и экзогенные окрашенные соединения. К эндогенным фотосенсибилизаторам сетчатки и пигментного эпителия, в первую очередь, относятся ретиналь и продукты его превращения.
Ретинальпредставляет собой один из эффективных природных сенсибилизаторов. Как видно из таблицы, его сенсибилизирующая активность лишь вдвое ниже, чем у такого классического фотосенсибилизатора, как рибофлавин.
Фотосенсибилизированное ретиналем окисление может идти как по пути физической сенсибилизации с участием кислорода, так и по пути химической сенсибилизации. Это было показано нами в модельной системе, а именно было охарактеризовано фотосенсибилизированное ретиналем окисление трипсина и цистеина.
Ретиналь в наружном сегменте фоторецептора высвобождается из молекулы родопсина на последней стадии его фотолиза в результате гидролиза ковалентной связи Шиффова основания, и затем в виде свободного полностьютранс-ретиналя при определенных обстоятельствах может накапливаться в фоторецепторной мембране. Например, такая ситуация вполне реальна в фоторецепторной клетке старческой сетчатки.
Еще опаснее, если в фоторецепторной мембране наружного сегмента накапливается не сам ретиналь, а его еще более фототоксичный продукт превращения - бисретинилиден-фосфатидилэтаноламин. Этот продукт, в свою очередь, может переноситься затем из фоторецепторов сетчатки в клетки пигментного эпителия и там превращаться в следующий продукт - бис-ретинилиден-этаноламин (обозначаемый в англоязычной литературе как А2Е). Этот продукт представляет собой основной флуорофор линофусцинозых гранул.
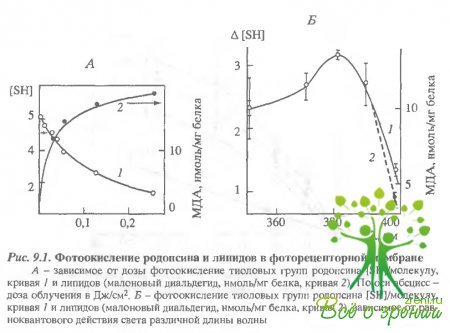
Изучая природу эндогенного сЬотосенсибилизатора при окислении молекулярных компонентов фоторецепторной мембраны, мы, во-первых, исследовали зависимость скорости их окисления от дозы облучения (рис. 9.1, А) и, во-вторых, спектр действия фотоокисления (рис. 9.1, Б). Объектом исследования в этих опытах служили предварительно обесцвеченные видимым светом образцы суспензии наружных сегментоз палочек.
Иными словами, фоторецептерные мембраны содержали уже не сам родопсин (?макс = 500 нм), а продукт его обесцвечивания видимым светом - метародопсин II (?макс= 380 нм) или уже высвободившийся полностью транс-ретиналь (?макс = 380 нм). Добавление к такой обесцвеченной суспензии экзогенного ретиналя приводит к пропорциональному увеличению числа фотоокисленных тиоловых групп белка. Уменьшение же концентрации ретиналя в обесцвеченной суспензии (суспензия предварительно обесцвечивалась в присутствии НАДФН с последующим отмыванием пиридиннуклеотида) соответственно уменьшает количество окисленных SН-групп. Из этих опытов следовало, что ретиналь способен выступать в качестве сенсибилизатора фотоокисления белкового компонента (родопсинг) фоторецепторной мембраны. Подобные результаты были получены и в отношении липидов этой мембраны.
В этой же работе удалось определить зависимость окисления белков и липидов фоторецепторной мембраны от длины волны облучающего света. Суспензию наружных сегментов фоторецепторов облучали равноквантовыми потоками света разной длины волны в течение 30 мин и затем наблюдали как накопление конечного продукта окисления липидов - малонового диальдегида (МДА), так и уменьшение числа свободных SН-групп белка (см рис. 9.1, Б). Наиболее выраженное фотоокисление и белков, и липидов наблюдается в области 380 нм. Иными словами, спектр действия их окисления находится в той же области, что и спектр поглощения свободного ретиналя (или метародопсина II).
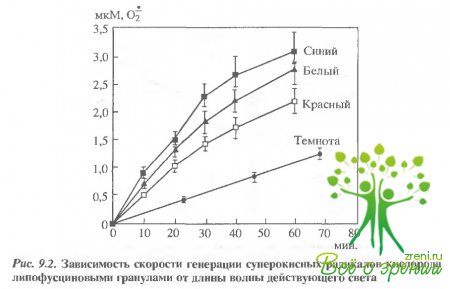
Липофусциновые гранулы (или "пигмент старости") представляют собой желтоватые флуоресцирующие включения внутри клеток пигментного эпителия. Они образуются и накапливаются в результате неполной деградации фагоцитированных обломков наружных сегментов фоторецепторов - фагосом. Считалось, что липофусциновые гранулы являются безвредным балластом, накапливающимся в постмитотических клетках по мере старения организма. Оказалось, однако, что при действии света они способны генерировать активные формы кислорода - суперокисные анион-радикалы и синглетный кислород. Спектры действия генерации этих активных форм кислорода совпадают: короткиволновая часть спектра гораздо эффективнее, нежели средне- и длинноволновая. На рис. 9.2 показана зависимость накопления суперокисных анион-радикалов от длины волны облучения суспензии липофусциновых гранул. Липофусциновые гранулы, выступая в роли сенсибилизаторов фптоокисления, способны стимулировать окисление липидов (докозагексаеновой и линоленовой кислот) и кардиолипиновых липосом.
ФлавиныОТНОСЯТСЯ к другим эндогенным фотосенсибилизаторам, содержание которых в сетчатке и пигментном эпителии достаточно велико. К ним относятся рибофлавин и НАДН.
Предшественник гемоглобина - протопорфирин-1Х – это еще один потенциально опасный фотосенсибилизатор, также поглощающий свет в синей области спектра. Находясь в доступных свету хориокапиллярах, он может стать причиной фотодегенеративных процессов.
Лекарства,как и другие экзогенные фотосенсибилизаторы, попадающие в доступные свету структуры глаза, в первую очередь сетчатку и пигментный эпителий, а также окрашенные продукты метаболизма могут представлять опасность как фотоповреждающие агенты. Экзогенные фотосенсибилизаторы особенно опасны для афакичного, а также нормального детского глаза, хрусталик которого пропускает не только видимый, но, частично, и ультрафиолетовый свет.
↑ Субстраты фотоокисления
Молекулярные компоненты фоторецепторной мембраны представляют собой, можно сказать, идеальные субстраты для реакции фотосенсибилизированного окисления. Как и любая биологическая мембрана, фоторецептооная мембрана диска состоит из липидного бислоя и пронизывающих его мембранных белков. Основным интегральным белком этой мембраны является родопсин: на его долю приходится до 95-98% всех интегральных белков. В состав оставшихся 2-5% входит белок большой
молекулярной массы (220 кДа), ответственный за активный перенос свободного транс-ретиналя из фоторецепторного диска. Этот белок, так называемый ATP-binding cassette transporter, или ABCR, находится в "петле" диска (подробнее об этом белке см. ниже). Основными фосфолипидами фоторецепторной мембраны являются фосфатидилхолин, фосфатицилэтаноламин и фосфати-дилсерин. Уникальным является жирнокислогный состав этих фосфолипидов: более 60% - это полиненасыщенные жирные кислоты, причем на долю длинноцепочечной докозагексаеновой (С22:6) кислоты приходится около 75%. Благодаря этому фоторецепторная мембрана имеет исключительно низкую вязкость, равную, примерно, 2 пуазам (это вязкость оливкового масла). Такая вязкость обеспечивает довольно быструю вращательную и более медленную латеральную диффузию родопсина и других белков в этой мембране.
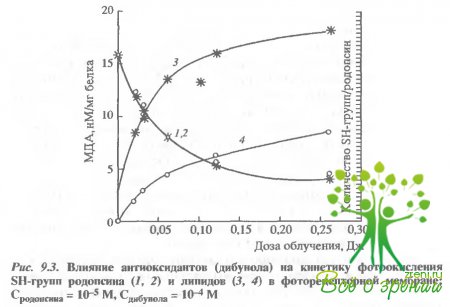
Фотосенсибилизированное окисление белков и липидов фоторецепторной мембраны идет параллельно и практически независимо. Действительно, добавление известного ингибитора перекисного окисления липидов - 2,6-ди-трет-бутилокситолуола (дибунола) полностью предотвращает фотоокисление липидов в этой мембране и лишь частично снижает скорость окисления тиоловых групп белка (рис. 9.3).
Системы окисления белка и липидов по-разному реагируют и на изменение содержания кислорода в среде инкубации: окисление белка к нему гораздо менее чувствительно. Окисление же липидов идет с большей легкостью с участием активных форм кислорода. Интересно сопоставить в этой связи квантовые выходы фотоокисления родопсина и его обесцвечивания: квантовый выход фотоокисления белка около 0,04, а фотообесцвечивания родопсина 0,7, т.е. почти на порядок выше. Это объясняет, почему физиологические интенсивности света не становятся для сетчатки повреждающими.
Следствием фотоокисления родопсина и липидов в фоторецепторной мембране являются:
образование внутри- и межмолекулярных дисульфидных связей ("сшивок"), образование необратимых белковых агрегатов, подвижность которых в мембране крайне низка; потеря способности окисленного и агрегированного родопсина к регенерации как in vitro, так и in vivo.
В нашей работе впервые были найдены методические подходы к модификации SH-групп родопсина в мембране фотоповрежденного родопсина. Однако в дальнейшем этот подход привел к обнаружению функционально важной светоиндуцированной конформационной перестройки молекулы родопсина на стадии метародопсина II, позволяющей ему взаимодействовать с другими балками каскада фоготранедукции.
В этой же работе 1981 г. было показано, что длительное освещение суспензии фоторецепторных мембран (75 мин, 105 л к) приводит:
- к заметному замедлению вращательной подвижности спин- меченного белка (?С[/sub]/?С0[/sub]) (при этом анализ спектра ЭПР-метки свидетельствует именно об агрегации молекул белка, во всяком случае о том, что расстояние между ними не превышает 20-30 А), к уменьшению числа свободных SH-групп до 35% от исходного значения,
- к существенному накоплению продуктов переписного окислении липидов (до 30 нмолей МДА/лг белка),
- к образованию олигомеров родопсина, как это следовало из картины электрофореза (при этом доля мономерной фракции уменьшалась, а доля димеров, тримеров и спигомерной фракции, остающейся на старте, возрастала).
Было также показано, что агрегация родопсина при повреждающем действии света на фоторецепторную мембрану происходит главным образом за счет образования межмолекулярных дисульфидных связей между "гидрофобными" SH-группами родопсина.
Анализ поведения спиновых зондов, введенных в липидный бислой фоторецепторной мембраны, показал, что микровязкость мембраны при фотоокислении ее компонентов несколько уменьшается, при этом подвижность липидов в ней увеличивается. Скорее всего это является следствием "сегрегации" родопсина в мембране в результате образования его олигомеров.
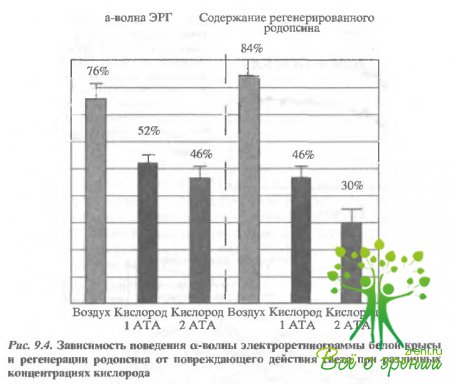
Необратимая агрегация родопсина в мембране, вызванная повреждающими дозами света, приводит к потере его нативных свойств и нормальной функциональной активности. Чувствительным те г том на нативность зрительного пигмента является его способность к регенерации при добавлении экзогенного 11- цис-ретиналя. И в опыта:17 in vitro на суспензии фоторецепторных мембран, и в опытах in vivo при облучении глаза белой крысы было показано, что способность родопсина к регенерации уменьшается, а нормальная электрическая активность сетчатки - электроретинограмма - подавляется или исчезает (рис. 9.4).
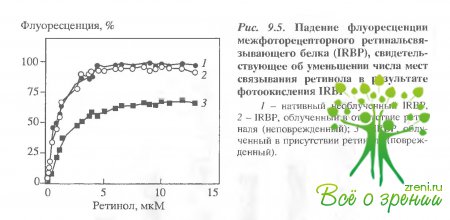
Помимо родопсина, ретиналь выступает фотосенсибилизатором окисления и повреждений ретинальсвязывающих и ретиналь-переносящих белков - ключевых белков зрительного цикла К важнейшим из них относится ABCR (см. выше) и водорастворимый межсЬоторецепторный ретиналь/ретинол-переносящии белок (iRBP). Нами было показано, что при действии света в полосе поглощения ретиналя. т е. в ближней ультрафиолетовой области (к = 380 нм), белок IRB? повреждается: часть его цистеиновых и ароматических аминокислотных остатков окисляется и, что самое важное, снижается его способность связывать ретинол На рис. 9.5 показано уменьшение числа мест связывания ретинола фотоповрежденным IBRP.
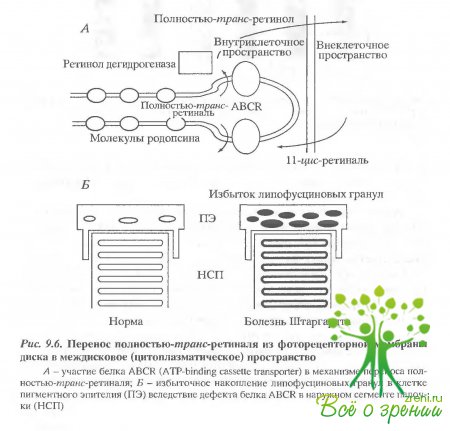
Специфичный для фоторецепторной клетки мембранный белок, активно переносящий (с затратой энергии АТФ) полностью-транс-ретиналь из фоторецепторной мембраны диска в междисковое цитоилазматическое пространство, это так называемый ABCR, или ATP-binding cassette transporter (рис. 9.6, А). Полностью-транс-ретиналь, перенесенный ABCR. восстанавливается ферментом ретинол-дегидрогеназой в полностью-транс-ретиналь, который затем переносится во внеклеточное пространство.
ABCR оказался крайне чувствителен к фотоповреждению, вызванному ретиналем как фотосенсибилизатором. Как и в случае родопсина, молекулярным механизмом повреждения ABCR является его агрегация, однако не за счет образования дисульфидных связей. Фотоповреждение этого белка, обладающего также АТФазной активностью, приводит к пот ере способности ретиналя стимулировать эту ферментативную активность.
Интересно, что ABCR гораздо чувствительнее к фотоповреждению, нежели другие мембранные белки фоторецепторной мембраны, а именно: родопсин, ?-субъединица трансдуцина, белок цГМФ-регулируемого ионного канала плазма гической мембраны наружного сегмента или такие периферические белки фоторецепториой мембраны, как родопсиновая киназа и арестин. Важным для патогенеза дегенеративных заболеваний сетчатки следствием повреждения ABCR является уменьшение или потеря этой его способности активно удалять из фоторецепторной мембраны диска свободной транс-ретиналь, высвободившийся в результате фотолиза родопсина. Это приводит к накоплению транс-ретиналя в мембране и последующему взаимодействию двух его молекул с фссфатидилэтаноламином. Образовавшийся таким образом бис-ретиналиден-фосфатидкл-этаноламин, вероятно, сам по себе фототоксичен, но что более существенно, он служит предшественником основного фототоксичного флуорофора липофусциновых гранул - А2Е. Показано, что одно из известных наследственных дегенеративных заболеваний сетчатки - болезнь Штаргардта - связана с дефектом ABCR, приводящим, в конечном свете, к избыточному накоплению липофусцинивых гранул в клетках пигментного эпителия (рис. 9.6, Б).
Кислородявляется третьим необходимым участником реакции фотоокисления. Как нами было показано в опытах на крысах, гипероксия и особенно гипербарическая оксигенация усугубляют повреждающее действие света на сетчатку: как на способность регенерации родопсина в ее зрительных клетках, так и на ее электрическую активность. Следует при этом отметить, что существует градиент повреждения наружного сегмента фоторецепторной клетки: ее дистальная часть, содержащая "старые" диски, намного чувствительнее к такому повреждению, нежели проксимальная. Во-первых, это может объясняться накоплением молекулярных дефектов в "старых" дисках, свидетельством чему может служить градиент уменьшения количества способных к титрованию SH-групп вдоль наружного сегмента. Во-вторых, это может быть связано с большей концентрацией кислорода в дистальной части наружного сегмента по сравнению с проксимальной. Действительно, если в области дистальной части (верхушка наружного сегмента) напряжение кислорода Ро2составляет около 100 мм ртутного столба, и это эквивалент но концентрации кислорода в артериальной крови, то в области проксимальной части (на границе с внутренним сегментом) Ро2 составляет всего лишь около 10 мм ртутного столба в темноте и около 30 м ртутного столба на свету. Во внутреннем сегменте, как известно, содержится большое скопление митохондрий, которые являются основными потребителями кислорода в зрительной клетке.
↑ Системы зашиты структур глаза от фотоповреждения
Итак, сочетание света, кислорода, окрашенных сенсибилизаторов и легко окисляющихся субстратов (липидов и белков) создает реальную угрозу для возникновения и развития в сетчатке и пигментном эпителии фотодеструктивных процессов. Этот парадокс зрения, когда свет выступает и носителем информации, и потенциально опасным повреждающим фактором, был решен в ходе эволюции формированием, наряду с системой фоторецепции, достаточно надежной системы защиты от опасности фотоповреждения. Эта многоуровневая система включает несколько линий:
- обновление фотооецепторных мембран, комплекс эндогенных антиоксидантов,
- механизм максимально быстрого удаления свободного ретиналя из зрительной клетки,
- систему оптических фильтров глаза, в которой ключевую роль играет хрусталик, желтеющий у приматов и человека с возрастом.
Естественно, любые нарушения в этой системе приводят к возрастанию риска светового повреждения. Например, в фоторецепторной клетке старческой сетчатки реальна ситуация, как уже говори тогда, когда в ее наружном сегменте накапливается или свободный ретиналь, или, что гораздо опаснее, еще более фототоксичный продукт его превращения - бисретинилиден-фосфатидил- этаноламин (А2Е-РЕ). Этот продукт транспортируется затем в клетку пигментного эпителия и уже там превращается в бис-ретиноидный аддукт (А2Е), который включается в состав липофусци-новых гранул как один из ее основных флуорофоров.
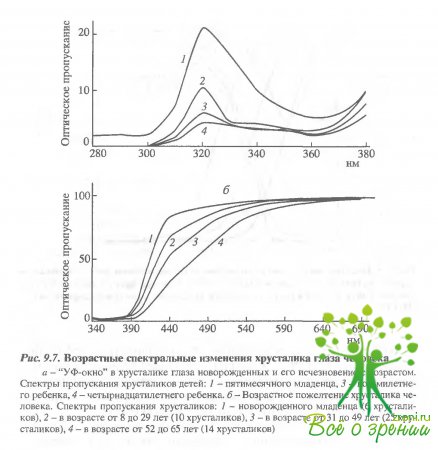
Поскольку и ретиналь, и его бис-ретиноидный продукт (А2Е), как и ряд других окрашенных соединений, поглощают в коротковолновой (синей) области спектра, то окрашенные оптические среды глаза правомерно рассматривать как светофильтры, отсекающие эту опасную для сетчатки часть спектра. В этом отношении возрастное пожелтение хрусталика глаза человека представляет собой один из эффективных физиологических способов оптической защиты сетчатки от опасности фотоповреждения. Следует отметить, что хрусталик глаза новорожденного обладает повышенным пропусканием для ультра фиолетового света, так называемым УФ-окном (рис. 9.7, а), С возрастом (примерно к 15 годам) это "окно" исчезает, и затем в течение жизни происходит постепенное пожелтение хрусталика, наиболее выраженное в старческом возрасте (рис. 9.7, б).
Более того, показано, что катарактальный хрусталик, существенно ухудшая качество изображения на сетчатке, вместе с тем предотвращает развитие некоторых форм дегенерации сетчатки,
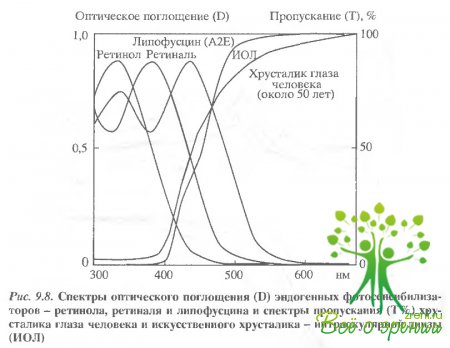
в том числе старческой макулярной дегенерации. Поэтому хирургическое удаление хрусталика при катаракте имеет своим побочным следствием для афакичного глаза многократное повышение риска повреждения сетчатки ультрафиолетовым и синим светом. Исходя из этих представлений, нами еще в середине 80-х годов был разработан и внедрен в клиническую практику новый окрашенный искусственный хрусталик (интраокулярная линза - ИОЛ). Подобно естественному хрусталику пожилого человека, этот желтоватый искусственный хрусталик полностью отсекает ультрафиолетовую, и, в значительной мере, коротковолновую (фиолетово-синюю) часть видимого спектра. Важно отметить при этом, что нормальное цветовосприятие пациента с имплантированным желтоватым хрусталиком не нарушается. На рис. 9.8 сведены спектры поглощения основных эндогенных фотосенсибилизаторов - ретинола, ретиналя, липофусцина, а также спектры пропускания хрусталика глаза пожилого человека и нашего желтоватого искусственного хрусталика.
Видно, что и хрусталик глаза пожилого человека, и желтоватый искусственный хрусталик в значительной мере отсекают коротковолновую часть видимого спектра, в которой поглощают опасные для сетчатки фотосенсибилизаторы. К сожалению, эффективных и безопасных лекарственных средств - антиоксидантов, способных предотвратить фотоповреждение сетчатки, пока не найдено.
Статья из книги: Молекулярные механизмы зрительной рецепции | Каламкаров Г.Р., Островский М.А..




Комментариев 0