Лазеркоагуляция сетчатки при сосудистой патологии глаза
Содержание:
Описание
↑ Что такое лазерное излучение. основы его взаимодействия с тканью
Прежде чем начать разговор об использовании лазеров в офтальмологии необходимо хотя бы в самых общих чертах рассмотреть принцип работы оптических квантовых генераторов и охарактеризовать электромагнитное излучение (ЭМИ), генерируемое этими типами источников света. Знание особенностей «лазерного излучения» позволит понять эффекты, возникающие в биологических тканях в результате взаимодействия с ними электромагнитного излучения.
Тот факт, что человеческий глаз видит и различает цвета от фиолетового до красного, говорит о том, что часть спектра ЭМИ, называемая видимый свет проходит через среды глаза и достигает фоторецепторов. Поглощаясь молекулами зрительных пигментов, свет дает начало сложной цепи фото- и биохимических процессов, которые, в конце концов, вызывают в коре головного мозга ощущение света.
Большинство окружающих нас источников света (солнце, огонь, лампы накаливания, газосветные лампы, люминесцентные лампы и т.д.), излучают так называемый полихроматический свет - смесь электромагнитных излучений разной длины волны - от ультрафиолета до инфракрасного света.
Попадающее в глаз ЭМИ, взаимодействует не только с фоторецепторами, но и со всеми без исключения структурами, через которые прошли кванты излучения.
Характер этого взаимодействия и его внешние проявления зависят от длины волны излучения и оптических характеристик облучаемых тканей. Так как все перечисленные выше источники света фактически излучают смесь квантов с разной длины волны в разных пропорциях, возникающие эффекты проявятся только в тех тканях, которые поглотили определенные кванты ЭМИ. Биологические проявления будут обусловлены собственной энергией квантов и суммарным количеством полученной энергии.
В январе 1960 года, практически одновременно в США и СССР, были созданы первые работающие образцы оптических квантовых генераторов (ОКГ). Русское слово ЛАЗЕР является транслитерацией английской аббревиатуры LASER, расшифровывающейся как "Light Amplification by Stimulated Emission of Radiation" - "усиление света при помощи вынужденного испускания" [35].
Как видно из названия, данное устройство генерирует кванты электромагнитного излучения в видимой области спектра.
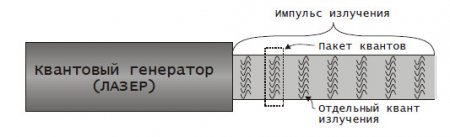
Излучение, которое генерирует большинство лазеров, относится к оптическому диапазону, т.е. это видимый свет, ИК или ФУ излучение. Каждый лазер, за небольшим исключением, как правило, генерирует ЭМИ в узкой полосе спектра, т.е. монохроматическое ЭМИ (монохроматический свет). Это излучение, помимо монохроматичности, характеризуется еще двумя особенностями - пространственной и временной когерентностью. Смысл этих особенностей лазерного излучения становится понятным из Рисунок 1.
Под пространственной когерентностью понимается совпадение плоскости расположения электрической и магнитной составляющих ЭМИ для каждого кванта в импульсе излучения. Под временной когерентностью понимается совпадение фаз каждого из квантов в импульсе. Эти свойства лазерного излучения, позволяют формировать очень узкие, мало расходящиеся в пространстве пучки излучения. Плотность энергии в таких пучках очень высока. Кроме того, такой пучок можно сфокусировать в пятно, размер которого практически может составлять половину длины излучаемой лазером волны. При этом плотность энергии, сфокусированной в пятно такого размера, возрастает до огромных величин.
Описанные выше особенности излучения лазеров позволяют применять его в самых различных областях, в том числе в медицине и в офтальмологии в частности.
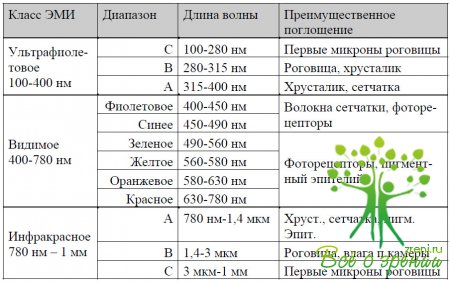
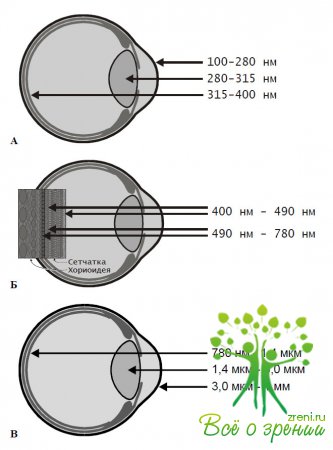
Не все части спектра ЭМИ проникают до фоторецепторного слоя сетчатки (см. Таблица 1, Рисунок 2). Структуры глаза представляют собой серию последовательных спектральных фильтров, поглощающих или пропускающих определенные компоненты падающего света [35].
Атомы и молекулы поглощают световую энергию избирательно, вследствие чего структуры глаза могут: 1) пропускать свет без поглощения; 2) рассеивать его с минимальным поглощением; 3) поглощать кванты света.
Биологическое действие светового излучения проявляется только если излучение поглощено.
• - УФ - С и ИК - С поглощаются роговицей (см Таблица 1);
• - 315-400 нм (УФ - А) - хрусталиком (см Таблица 1);
• - 400-1400 нм (видимый и ИК - А) - проходят внутрь и поглощаются сетчаткой и хориоидеей (см Таблица 1).
Кванты коротковолновой области ЭМИ (УФ) возбуждают электроны в атомах и молекулах, с последующим разрушением молекулы или ионизацией атомов молекул. Кванты длинноволновой части спектра ЭМИ (видимое и ИК излучение) приводит к усилению колебаний всей молекулы, и как следствие повышает температуру ткани подвергшейся облучению. Для денатурации белка повышение температуры должно составлять 10°С - 25°С выше нормальной температуры. Если ткань получает более высокий уровень энергии, то она может разрушиться.
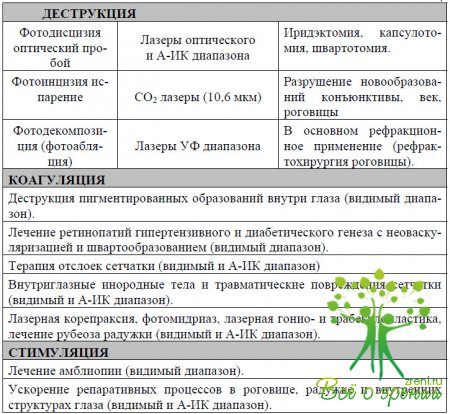
Лучевое воздействие может быть обратимым и необратимым. В зависимости от механизма воздействия ЭМИ на ткани существует несколько направлений применения лазеров в офтальмологии (Таблица 2). Эффекты, возникающие при облучении структур глаза, будут сильно зависеть от того, насколько быстро будет происходить поглощение ЭМИ, на какой площади и на какую глубину.
[banner_centerrs] {banner_centerrs} [/banner_centerrs]
Фотодеструкция (фотодисцизия) - «электрооптический пробой» ткани высокой энергией в малом объеме. Типичными представителями, реализующими данный вид взаимодействия ЭМИ с тканями, являются лазеры на стекле с Неодимом и YAG лазеры, работающие в режиме гигантского импульса, генерирующие ЭМИ с длиной волны 1,06 мкм. При воздействии короткого импульса (порядка 1*10-7сек 1х10-9сек) на ткань в очень малом объеме (~ 50*50 мкм - 100 х 100 мкм) образуется плазма приводящая к возникновению ударной волны и микроразрыву ткани. Этот вид взаимодействия ЭМИ с тканью широко используется в офтальмологии для дисцизии пленчатой катаракты, лазерной ири-дэктомии, синехио- и швартотомии.
Фотоиспарение и фотоинцизия. Этот тип взаимодействия ЭМИ с тканями реализуется в основном при использовании СО2 лазера (длинна волны 10,6 мкм). ЭМИ такой длины поглощается в основном молекулами воды в поверхностных слоях вещества. Эффект возникающий при поглощении - в основном термический, практически без явлений ионизации. СО2 лазеры являются источниками излучения высокой мощности, от десятков до сотен ватт. Большая длина волны этого лазера не позволяет получить достаточно узкий пучок излучения, а поглощение этого излучения сопровождается значительным нагревом окружающих тканей. Все это делает СО2 лазер мало пригодным для работы непосредственно на глазном яблоке, но в «большой» хирургии устройства этого типа широко известны как «Лазерные скальпели», которые позволяют совершать бескровные разрезы кожи и мышечных тканей и выжигать (испарять) поверхностно расположенные новообразования.
Фотоабляция (фотодекомпозиция). Используются эксимерные лазеры с длинной волны 193 нм - 351 нм. В связи с тем, что ЭМИ этого диапазона поглощаются первыми микронами ткани, а кванты с такой длиной волны имеют очень высокую энергию, практически весь объем ткани, в котором произошло поглощение ЭМИ, переходит в ионизированное состояние, сопровождающееся разрушением молекул белков и воды. Полученная этими молекулами в процессе поглощения ЭМИ энергия настолько высока, что ее хватает не только для разрушения молекул, но и для сообщения их осколкам такой скорости теплового движения, которая оказывается достаточной, чтобы они вылетели с поверхности облученной ткани. Фактически, происходит помикронное испарение ткани. Этот эффект используется для проведения рефрактохирургических вмешательств на роговице при миопии и астигматизме. Суть этой процедуры сводится к испарению центральной части роговицы, с целью придания ей такой кривизны и, следовательно, преломляющей силы, которая будет соответствовать передне-заднему размеру оперируемого глаза.
Лазеркоагуляция - термическое повреждение структур без ионизации и явлений «оптического пробоя» ткани. Способ воздействия на ткани реализован в основном с помощью лазеров оптического диапазона (400 нм - 780 нм). Реже используются лазеры, излучающие в А-ИК диапазоне (780 нм - 1,4 мкм). Применяемая мощность составляет, как правило, от десятых долей до полутора ватт. Время воздействия - от сотых долей секунды до десятков секунд. Так как видимый и А-ИК диапазоны ЭМИ практически без потерь проникают через роговицу, хрусталик, стекловидное тело и полностью поглощаются пигментным эпителием сетчатки и пигментом сосудистой оболочки, лазеры данного типа используют при лечении диабетической ретинопатии, нарушениях кровообращения в сосудах сетчатки, хорио-ретинальных дистрофиях, отслойке сетчатки, внутриглазных новообразованиях, глаукомы. Перспективно применение лазеров ИК диапазона с длинной волны 1,54 - 2,9 мкм для хирургии роговичного астигматизма и гиперметропии. ЭМИ с такой длины волны поглощаются стро-мой роговицы, приводя к значительному, на десятки градусов, подъему температуры в участке, поглотившем излучение.
Лазерстимуляция. Обычно используют гелий-неоновый лазер, длина волны 630 нм, но также возможно применение любого другого лазера видимого диапазона. Длина волны излучения лазера, применяемого для стимуляции, должна быть такой, чтобы вызывать в основном только термическое воздействие, без ионизации молекул ткани. Мощность излучения должна быть такой, чтобы ткани не нагревались выше порога коагуляции. В связи с тем, что для стимуляции используется весьма малая плотность энергии (3-10 мВт/см ), длительность воздействия излучения на ткани должна составлять несколько минут (3-10 мин). В зависимости от того, насколько высокую энергию несет квант ЭМИ, молекула ткани, поглотившая его, может повысить скорость своего теплового движения или изменить пространственную конфигурацию. Каждый из этих процессов приводит к повышению подвижности и реакционной способности молекулы. Таким образом, низкоэнергетическое ЭМИ, поглощенное тканями, способствует активации обменных процессов. Применение лазерстимуля-ции наиболее оправдано при травмах, дистрофиях роговицы, макулодистрофи-ях, кровоизлияниях в переднюю камеру и стекловидное тело.
На современном этапе развития офтальмологии под лазеротерапией в основном понимают 3 основных направления:
- Коагуляцию тканей;
- Испарение и оптический пробой тканей;
- Стимуляцию;
Большая часть лазерных вмешательств на органе зрения имеет своей целью коагуляцию тканей различных отделов глаза. Цель коагуляции - нанесение дозированного по площади, глубине и степени ожога с последующим превращением коагулированной ткани в рубцовую соединительную ткань. Превращаясь в рубец, ткань:
- Теряет свою дифференцировку;
- Сокращается в объеме;
- Уплотняется и упрочняется;
- Требует меньшего количества кислорода и метаболитов.
↑ Общий обзор показаний к лазерному лечению
Как и любой другой метод лечения, лазеротерапия имеет свой круг показаний и противопоказаний. Сразу необходимо отметить, что в силу минимальности своего воздействия на организм в целом и легкой переносимости процедуры для лазеротерапии практически не имеется противопоказаний связанных с общим состоянием пациента.
Как видно из приведенного выше перечня доступных для лазеротерапии патологий список этот довольно велик и легко может быть продолжен. На практике же чаще всего врачу приходится сталкиваться со следующими состояниями, при которых лазеротерапия показана и может быть весьма эффективна [35]:
Предшествующие отслойке сетчатки состояния:
• Периферические витреоретинальные дегенерации, ретинальные кисты, витреоретинальные тракции.
• Немые разрывы сетчатки или разрывы с плоской отслойкой сетчатки вокруг них.
• Вколоченные в сетчатку инородные тела и небольшие ранения сетчатки внутриглазными инородными телами в заднем полюсе глаза без отслойки или с небольшой плоской отслойкой.
• Центральная атеросклеротическая хориоретинопатия.
• Диабетическая ретинопатия.
• Ретинопатии после сосудистых катастроф.
Эффективность и показания лазеротерапии в многой степени зависят от сроков, стадии и собственно вида заболевания. Также, немаловажно соблюдение следующих условий:
• Возраст, допускающий проведение данной процедуры.
• Хорошее состояние преломляющих и проводящих сред глаза.
• Хорошее общее состояние и адекватный настрой пациента.
В случаях наличия у пациента предотслоечных состояний или плоских локализованных отслоек сетчатки эффективность лечения высока и часто позволяет избежать хирургических манипуляций. В остальных же случаях под эффективностью процедуры понимается:
• замедление прогрессирования заболевания,
• достижение стабилизации состояния,
• и несколько реже - улучшение зрительных функций.
С точки зрения применения фотокоагуляции удобнее расклассифицировать патологию сетчатки следующим образом [35]:
• Патология центральных отделов.
Макулодистрофии вследствие расстройства кровообращения в хориокапиллярной пластинке.
- с неосложненной отслойкой пигментного эпителия.
- с отслойкой пигментного эпителия, осложненной неоваскуляризацией и геморрагиями.
- с отслойкой пигментного эпителия, осложненной деструкцией слоя пигментных клеток.
- с отслойкой пигментного эпителия, осложненной развитием рубцовой ткани.
Макулодистрофии вследствие преимущественного растройства кровообращения ретинальной капиллярной сети.
- с отеком внутренних слоев сетчатки.
- с отеком и интраретинальными геморрагиями.
- с кистообразованием и разрывами внутренних слоев сетчатки.
Диабетическая ретинопатия
• Экссудативная форма
- Стадия I - сосудистые изменения (неравномерность калибра вен, их расширение, извитость, микроаневризмы).
- Стадия II - ретинальные изменения (мягкие и твердые экссудаты, отек сетчатки, ретинальные геморрагии).
- Стадия III - ретинальные отложения (отек макулярной области со снижением зрения, отек ДЗН, экссудативная отслойка сетчатки, интра и преретинальные геморрагии).
• Пролиферативная форма
- Стадия I - локальные проявления ретинальной перипапиллярной не-оваскуляризации, не сопровождающиеся развитием глиальной ткани.
- Стадия II - выраженная ретино- и папилло-витреальная неоваскуляри-зация, сопровождающаася развитием опорной глиальной ткани и ретинальными изменениями.
- Стадия III - фиброз и ретракция стекловидного тела, отслойка сетчатки, кровоизлияния в стекловидное тело.
• Геморрагическая (ювенильная) форма.
- Стадия I - сосудистые изменения с отдельными очагами неоваскуля-ризации и локальными преретинальными кровоизлияниями.
- Стадия II - витреальная неоваскуляризация с преретинальным фиброзом и частыми кровоизлияниями в стекловидное тело.
- Стадия III - тотальный гемофтальм, не поддающийся рассасывающей терапии, сопровождающийся ретинальными изменениями.
• Посттромботическая ретинопатия.
• Острая фаза (до 2х мес. после тромбоза). Имеет много общего с признаками экссудативной диабетической ретинопатии.
• Хроническая фаза (более 2х мес после тромбоза). Имеет много общего с признаками пролиферативной диабетической ретинопатии.
Вопрос о показаниях к лазеркоагуляции при макулодистрофиях и в настоящее время является предметом дискуссий в научной литературе. С одной стороны, известно, что отслойка нейроэпителия в макулярной области может со временем прилегать самостоятельно или после консервативной терапии. Исходя из этого факта в ряде работ призывают к коагуляции только после безуспешной консервативной терапии или при частых рецидивах заболевания. С другой стороны, очевидно, что даже длительная консервативная терапия макулопатий не всегда обеспечивает выздоровление, а самостоятельное прилегание наступает далеко не так часто, о чем свидетельствуют неоднократные случаи обращения больных через несколько месяцев и даже лет после начала заболевания. Именно у этой категории больных редко удается получить повышение остроты зрения после коагуляции, несмотря на полное прилегание нейроэпителия, так как в фоторецепторах наступают необратимые изменения.
Безопасность лазерной методики, надежность, хорошие исходы и значительное сокращение сроков лечения позволяют рекомендовать лазеркоагуляц-цию для лечения макулопатий в ранние сроки. Лазеркоагуляцию при неосложненной экссудативной отслойке пигментного эпителия целесообразно рекомендовать только после безуспешной консервативной терапии и лишь в случаях когда отслойка расположена эксцентрично по отношению к fovea. При осложненной отслойке пигментного эпителия показания к лазеркоагуляции значительно шире, так как в этих случаях не приходится рассчитывать на успех консервативной терапии. К сожалению, положительное влияние лазеркоагуляции на течение макулопатии у таких больных чаще может определить только врач, но не больной, который судит о успехе лечения прежде всего по повышению остроты зрения, а его в этих случаях удается добиться не часто. Лечение только медикаментозными средствами оправдано в случаях отсутствия технической возможности ее проведения.
Терапевтическое действие лазеркоагуляции при диабетических поражениях глазного дна обосновано следующими фактами и наблюдениями собранными различными офтальмологами в разное время:
• Фотокоагуляция, выключая ишемизированную часть сетчатки, понижает ее общую потребность в кислороде и таким образом предотвращает выработку ишемизированной сетчаткой вазопролиферативных факторов, приводящих к развитию ретинальной неоваскуляризации. В этом плане целесообразна прицельная коагуляция неперфузируемых зон.
• Гибель части капилляров и уплотнение оболочек глаза после коагуляции усиливают кровоток в более крупных сосудах, уменьшают отек сетчатки.
• Лазеркоагуляция способствует формированию новых путей оттока из сетчатки за счет образования хориоретинальных шунтов, существование которых экспериментально доказано.
Имеющиеся в литературе сведения и собственный опыт применения фотокоагуляции при диабетической ретинопатии свидетельствуют о том, что фотокоагуляция не может рассматриваться как метод радикального лечения диабетической ретинопатии, но на сегодняшний день она является единственным методом, дающим хотя бы у части больных надежду на длительное сохранение зрительных функций. Применяться она должна преимущественно в I и II стадиях заболевания (см. классификацию выше) и достаточно решительно в виде прицельной коагуляции при экссудативной форме и в панретинальном виде в сочетании с фокальной при пролиферативных формах диабетической ретинопатии.
Как уже было описано выше, посттромботические поражения сетчатки во многом напоминают таковые при экссудативной и пролиферативной формах диабетической ретинопатии, и в соответствии с этим есть много общего в механизме действия фотокоагуляции при окклюзии вен и диабетической ретинопатии.
В свете имеющихся в литературе сведений рекомендация раннего применения лазеркоагуляции во всех случаях ретинальной венозной окклюзии, в том числе и ветви центральной вены сетчатки представляется недостаточно аргументированной. По отношению к больным с окклюзией отдельных ветвей ЦВС более обоснована осторожная позиция. К коагуляции не стоит прибегать в ранние сроки окклюзии, т.к. даже резкое понижение остроты зрения еще ничего не говорит о прогнозе. В последующем коагуляция в ограниченном объеме может быть использована лишь при значительном вовлечении в процесс макулярной области. При окклюзии ЦВС показания к фотокоагуляции должны ставиться более широко, так как она, вероятно, является единственным пока средством профилактики вторичной неоваскулярной глаукомы. Прибегать к панретинальной фотокоагуляции следует не позднее 2х мес. после окклюзии, так как имеются данные, что позднее этого срока фотокоагуляция не предотвращает развитие неоваскуляризации. В течение этого срока (2 мес.) глаз несколько адаптируется к новым условиям кровообращения, рассасывается часть ретинальных геморрагий и создаются более благоприятные условия для фотокоагуляции.
↑ Лазерное лечение диабетической ретинопатии
В последние десятилетия отмечается резкий рост заболеваемости сахарным диабетом, особенно в промышленно развитых странах. Ежегодно число больных сахарным диабетом увеличивается на 5-7%, а каждые 10-15 лет - удваивается. По данным ВОЗ, во всех странах мира насчитывается около 100 млн. больных сахарным диабетом и примерно столько же не выявлено [5, 6, 18]. Слепота у больных сахарным диабетом наступает в 25 раз чаще, чем в общей популяции (ВОЗ, 1987) [30].
Офтальмологический аспект проблемы связан не только с участием окулистов в ранней диагностике и контроле за течением сахарного диабета, но и с задачей профилактики возникновения и повышения эффективности лечения такого тяжелого и распространенного проявления болезни, как диабетическая ретинопатия [9, 27, 26]. Несмотря на то, что диабетическая ретинопатия была впервые описана более века назад, в 1885 году, до сих пор она остается одним из заболеваний, диагностика и лечение которых сопряжены с большими трудностями.
Диабетическая ретинопатия является основной причиной слепоты у пациентов 25-74 лет, при этом у 70-90% больных сахарным диабетом отмечаются начальные признаки поражения сетчатки, выявить которые при офтальмоскопическом исследовании практически невозможно [21].
Распространенность диабетической ретинопатии, частое сочетание ее с гипертензивными изменениями и высокий уровень инвалидизации заставляет задумываться о разработке новых методов обследования больных, этиологических и патогенетических факторах, способствующих развитию и прогрессированию заболевания, а так же новых лечебных методик.
↑ ЛАЗЕРКОАГУЛЯЦИЯ ПРИ САХАРНОМ ДИАБЕТЕ
Первые исследования по применению лазеркоагуляции на аргоне для лечения сосудистых заболеваний сетчатки были выполнены F.L'Esperance в 1969 году [21, 36]. После выпуска серийных лазеров в 1971 году началось распространение этого метода лечения в разных странах мира, и через 6 лет было сделано 1500 лазеркоагуляций. В настоящее время лазеркоагуляция, несомненно, является основным и наиболее эффективным методом лечения диабетической ретинопатии [36].
Предполагают, что терапия должна быть начата до клинических проявлений. При проведении лазеркоагуляции стабилизация процесса отмечается в 67% случаев [21, 31, 38].
Популярность аргоновых лазеров объясняется тем, что они генерируют излучение непрерывно, что позволило получать длительности воздействия от 0,01 с и более. Лазеры излучают на длинах волн 0,488 и 0,514 мкм, которые совпадают со спектром абсорбции гемоглобина. Однако, синяя составляющая излучения аргонового лазера (^=0,488 мкм) лимитирует его использование в макулярной области так как желтый пигмент ее интенсивно поглощает синее излучение и экранирует глубже лежащие слои глазного дна. Максимальное выделение тепла и ожог ткани происходят, таким образом, не в слое пигментного эпителия, а в самой сетчатке, вызывая повреждение ее нервного слоя в этой зоне [35].
Для работы в макулярной области перспективным считают использование красной составляющей криптонового лазера непрерывного излучения, который имеет на выходе 1,5 Вт в желтой (^=0,568 мкм), 1,5 Вт в зеленой (^=0,531 мкм) и 3,5 Вт в красной (^=0,674 мкм) части спектра. Высокая мощность дает основание считать его «идеальным» лазером для офтальмологии, поскольку каждая из этих волн полезна для коагуляции определенных структур. Перспективными считаются также лазеры на гранате с перестройкой длины волны на вторую гармонику, которые могут работать и в импульсном, и в непрерывном режиме, а также лазеры с перестраиваемой длиной волны [35].
Одни авторы считают, что трофическое действие аргонлазеркоагуляции обусловлено ее способностью превращать гипоксическое состояние сетчатки в аноксическое, кроме того, в результате уменьшения массы энергопотребляющей нервной ткани в лучших условиях питания оказывается остальная часть сетчатки. Другие исследователи связывают лечебный эффект воздействия аргонового лазера с его непосредственным положительным влиянием на трофику сетчатки [21, 28].
Имеются экспериментальные работы некоторых авторов по изучению действия аргонлазеркоагуляции на сетчатку. Показано, что при параметрах излучения: 100-200 мВт, диаметре светового пучка 100-200 мкм, времени воздействия 0,1 с - термическая энергия высвобождается на уровне пигментного эпителия, образуются дефекты в виде дезинтеграции клеток, разрывов межклеточных связей и появления между ними свободных межклеточных пространств. Во внутренних слоях ретины по ходу лазерного пучка возникают каналообразные расширения межклеточных пространств, которые активизируют ток интерстициальной жидкости и создают условия для более интенсивного обмена между двумя бассейнами кровоснабжения сетчатки. На это также указывает прохождение декстрана (после его внутривенного введения) из хориокапилляров в субретинальное пространство [8, 41].
Представленные данные мы сочли наиболее доказательными в механизме терапевтического действия лазеркоагуляции. Действительно, чем выжигать гипотетический вазоформативный фактор, захватывая обширные зоны сетчатки, возможно, более действенным может явиться нормализация тока интерстициальной жидкости, связанная с устранением барьерной функции пигментного эпителия; что и привело нас к разработке методики "щадящей" лазеркоагуляции сетчатки.
Имеются два основных метода лечения - панретинальная и фокальная лазеркоагуляция [21]. Основной задачей панретинальной лазеркоагуляции является предупреждение или регрессия неоваскуляризации. Считается, что этот метод выполняет следующие задачи: редукция или деструкция зон ретинальной гипоксии; сближение сетчатки с хориокапиллярным слоем; деструкция зон микроинфарктов и плохо перфузируемых капилляров; деструкция патологических сосудистых комплексов и сосудов с повышенной проницаемостью. Принцип, рекомендуемый авторами - коагуляция должна захватывать всю поверхность сетчатки, за исключением папилло - макулярного пучка и макулярной зоны, расстояние между коагулятами не должно быть больше 1/2-3/4 их диаметра. Диаметр коагулятов от 100 до 200 мкм, увеличивается до 500 мкм при продвижении к периферии [21].
При проведении фокальной лазеркоагуляции рекомендуется наносить коагуляты диаметром 100 - 200 мкм при сосудистых аномалиях в парамакуляр-ной зоне (коагулировать микроаневризмы, интраретинальные шунтированные комплексы) на расстоянии не менее 1/2 ПД. Также рекомендуют проводить ла-зеркоагуляцию новообразованных сосудов с диаметром коагулятов от 50 до 200 мкм, в зависимости от локализации очага неоваскуляризации [21].
Авторами отмечается наличие довольно большого числа осложнений при лазерной коагуляции сетчатки, которые могут затрагивать практически все структуры глазного яблока. Например, в сетчатке лазерное лечение может вызвать множественные повреждения сетчатки, сопровождаться появлением кровоизлияний, отслойкой сетчатки, развитием кистовидного отека макулы, нарушением перфузии диска зрительного нерва; что проявляется снижением остроты зрения, появлением дефектов поля зрения и ночной слепотой [21]. К одним из наиболее тяжелых осложнений лазеркоагуляции относят отслойку сетчатки, чаще встречающуюся при панретинальной лазерной коагуляции [20].
Анализ мировой литературы показывает, что на сегодняшний день существует множество обоснованных, но порой противоречивых взглядов на развитие диабетических изменений сетчатки и конъюнктивы глаза. Исследованы практически все звенья патогенеза микроангиопатий и найдена связь между ними. В отечественной и зарубежной литературе авторами признано, что наиболее действенными мерами профилактики и лечения ретинопатии является компенсация течения сахарного диабета, коррекция нарушений всех видов обмена и лазеркоагуляция сетчатки. Однако, неуклонный рост этой патологии, прогрессирование диабетической ретинопатии, развивающейся почти у 70% больных и в 6-8% приводящей к инвалидности, заставляют задумываться о разработке новых лечебных методик.
↑ МЕТОДИКА ПРОВЕДЕНИЯ ЛАЗЕРКОАГУЛЯЦИИ
В клинике глазных болезней СГМУ проведена экспериментально клиническая работа, целью которой являлась разработка способа лазерного лечения диабетической ретинопатии, учитывающего роль изменений осмотического давления крови у больных сахарным диабетом в развитии диабетической ангиопатии. Пигментный эпителий сетчатки, находящийся на пути движения тканевой жидкости, замедляет выравнивание трансмурального осмотического давления крови в обменных сосудах сетчатки при резком увеличении концентрации глюкозы в крови. Это создает отрицательное гидравлическое давление в ткани сетчатки, перерастяжение обменных сосудов и появление микроаневризм. В результате проведенных исследований патогенетически обоснована и внедрена в практику методика «щадящей» лазеркоагуляции. Щадящая лазерная перфорация пигментного эпителия сетчатки без выключения остальных ее элементов дает хороший прогностический эффект у больных с диабетической ретинопатией без побочного влияния на ее функциональное состояние. Выявлено и подтверждено клиническими наблюдениями, что ведущими факторами в механизме лечебного действия "щадящей" лазеркоагуляции является создание окон в пигментном эпителии для облегчения движения тканевой жидкости.
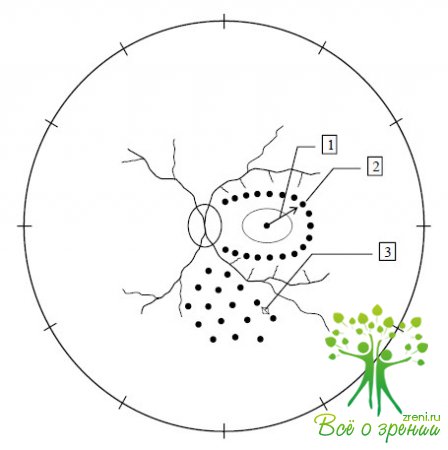
«Щадящая» лазеркоагуляция проводится с использованием зеленой составляющей спектра излучения офтальмологического аргонового лазера VISULAS-2 OPTON в условиях медикаментозного мидриаза. Нанесение лазерных коагулятов осуществляется через панфундуслинзу или трехзеркальную линзу Гольдмана после предварительной поверхностной инстилляционной анестезии 0,5% раствором дикаина. На первом этапе выполняется барраж макулярной зоны в виде подковы, раскрытой в сторону ДЗН. Коагуляты наносятся на расстоянии не менее 2500 мкм от центральной ямки. Режим работы следующий:
• мощность - 140-300 мВт;
• время экспозиции - 0,04-0,2 сек;
• диаметр лазерного луча в фокальной плоскости - 100 мкм;
• количество аппликаций - 20-30.
Барраж выполняется в режиме единичных вспышек. Затем лазер переводится в автоматический режим работы и проводится коагуляция остальных отделов сетчатки, за исключением папилло-макулярного пучка. Используются вышеприведенные параметры излучения. Всего наносится 400-450 аппликаций, расположенных друг от друга на расстоянии 1500 мкм (Рис. 1).



Комментариев 0