Современные методы лечения больных с синдромом «сухого глаза»

Описание
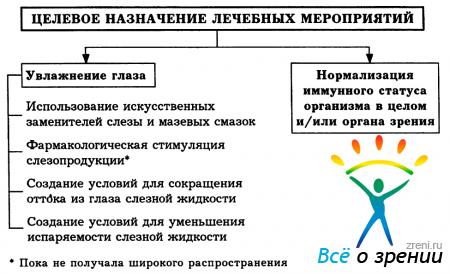
Терапия больных с рассматриваемой патологией органа зрения представляет весьма сложную и все еще достаточно далекую от оптимального решения задачу. В целом, она имеет этиологическую и симптоматическую направленность. Пациенты с синдромальным роговично-конъюнктивальным ксерозом должны получать «базовое» лечение у специалистов соответствующего профиля, а симптоматическое - у офтальмолога. Курация же больных с симптоматическим ССГ практически полностью возлагается на офтальмолога.Характер и объем потенциально возможной местной терапии представлен на схеме 2.
Схема 2. Направленность лечебных мероприятий, проводимых больным с синдромом «сухого глаза»
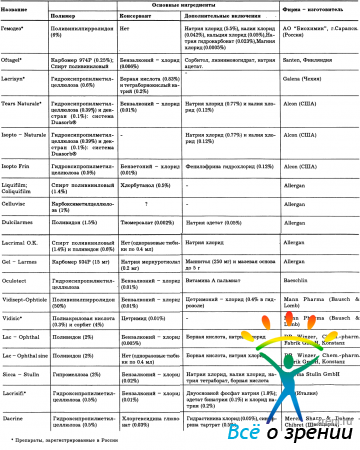
Из нее видно, что в основном она получает развитие за счет использования консервативных средств, арсенал которых в последние годы заметно расширился. Пожалуй, главным достижением здесь стало появление серии препаратов, призванных протезировать нативную слезную пленку - так называемые «искусственные слезы». В химическом отношении они представляют собой водные растворы гидрофильных биологически инертных полимеров (производные метилцеллюлозы, поливиниловый спирт, поливинилпирролидон, хондроитин-сульфат и многие другие) с включением различных консервантов и неорганических солей (см. приложение 6).
Приложение 6. Характеристика некоторых фармакологических препаратов, используемых в качестве «искусственной слезы».
Для достижения желаемого эффекта упомянутые препараты ежедневно инсталлируют в больной глаз с периодичностью до 6 раз в сутки. Терапия проводится перманентно на протяжении многих лет жизни пациента. Предпринимаются, правда, попытки пролонгировать действие «искусственных слез» путем включения их активного начала в оболочку из другого полимера (примером могут служить препараты типа Lacrisert). Однако такие лекарственные формы пока мало распространены в нашей стране.
Введенная в конъюнктивальную полость «искусственная слеза» образует на поверхности глазного яблока достаточно стабильную пленку, включающую в себя и компоненты нативной слезной жидкости, если продукция последней еще сохранена. На протяжении определенного времени она частично или полностью выполняет функции нативной слезной пленки. Кроме того, повышенная вязкость «искусственной слезы» препятствует ее быстрому оттоку из конъюнктивальной полости, что также является благоприятным фактором.
Первоначально в качестве «искусственных слез» были использованы увлажняющие растворы биологического происхождения, известные еще со времен античности. Гиппократ рекомендовал с этой целью сок дикого огурца, а также печень быка, замоченную в меде. Перед сном за веки рекомендовалось закладывать гусиный жир и яичный белок, ароматизированный розовой водой. Примечательно, что в настоящее время препараты, содержащие розовую воду, выпускают французские фирмы Merck Sharp & Dohme - Chibret и Fisons под названиями, соответственно, Dacryoserum и Ophtalmine, которые используются для промывания глаз с целью снятия утомления и придания им «свежести».
Начиная с XIX века в качестве «искусственной слезы» стали использовать водные растворы поваренной соли, раствор Рингера, водные растворы глицерина и различные масла. В начале XX века получил некоторое распространение уже раствор Локка, содержащий желатин (цит. по Holly F. J., 1989). И лишь несколько десятилетий назад в терапии ССГ стали отдавать предпочтение природным полимерам, а именно: сыворотке аутокрови, сухой плазме и др.). Однако в связи с технологическими трудностями их получения, высокой себестоимостью и, главное, недостаточной эффективностью, они были затем успешно заменены искусственными полимерами. Среди последних наибольшее значение приобрели метилцеллюлоза и ее производные. Следует однако отметить, что эти полимеры обладают и некоторыми недостатками: задерживают регенерацию эпителия роговицы, раздражают поврежденные ткани, а также способствуют (в больших концентрациях) обтурации слезоотводящих путей. К последнему побочному эффекту особенно чувствительны пациенты с легким ксерозом, протекающим на фоне гиперлакримии. Тем не менее, перечисленные выше недостатки упомянутых химических соединений компенсируются их высоким терапевтическим эффектом.
Значительно меньшими побочными действиями обладает поливиниловый спирт. Его водные 1.4-3.0% растворы практически не токсичны и не раздражают ткани глаза и даже способствуют заживлению их ран. К сожалению, этот препарат обладает способностью быстро загустевать и образовывать на ресницах сухие сгустки. К этому свойству поливинилового спирта безразличны далеко не все больные и часть из них по указанной причине прекращает его инстилляции.
Наряду с рассмотренными, в качестве полимерной основы искусственных слез используются и другие вещества -
- полиакриловая кислота,
- гиалуронат натрия,
- декстран и многие другие.
Как уже отмечалось ранее, полимерное соединение является основным, но не единственным ингредиентом искусственных слез (см. приложение 6). В целях предотвращения грибковой и микробной обсемененности в их состав вводят различные консерванты: бензалконий-хлорид, хлорбутанол, хлоргексидин и др. В настоящее время рассматривается вопрос о токсических свойствах бензалконий-хлорида и некоторых других консервантов. В частности, они существенно ограничивают возможности применения некоторых искусственных слез у больных, носящих мягкие контактные линзы. Пропитывание линзы препаратами такого рода способствует и пролонгированию их токсического действия на ткани глаза.
Для поддержания постоянства величины pH (в пределах 7.2-7.5), электролитного состава и осмолярности (150-300 мосм/л), на уровнях, максимально приближенных к норме, в состав искусственных слез входят также различные микроэлементы и буферные системы. Как показывает опыт, все рассмотренные выше препараты позволяют одновременно восполнить и недостающий объем жидкости в конъюнктивальной полости, и повысить стабильность слезной пленки. Поэтому их можно с успехом использовать при лечении больных со всеми патогенетическими разновидностями ССГ.
Перечень наиболее известных зарубежных препаратов «искусственной слезы» приведен в приложении 6. Среди них в нашей стране разрешены к применению гелевые препараты Офтагель (фирма Santen) и Видисик (Bausch & Lomb), препараты низкой вязкости Слеза натуральная (Alcon) и Лакрисифи (Sifi), а также препарат средней вязкости Лакрисин (Spofa).
В связи с тем, что импортные препараты «искусственной слезы» отличаются сравнительно высокой стоимостью и к тому же длительное время были малодоступными, нами (совместно с проф. Волковым В. В. и Гладких А. Ф.) на протяжении ряда лет производился поиск их отечественных аналогов. В частности, были апробированы растворы, предназначенные для внутривенного введения и содержащие уже упомянутые гидрофильные полимеры. Среди них наиболее эффективными оказались Гемодез и Полиглюкин, изготовленные на основе 6% - поливинилпирролидона и 6% раствора декстрана. Как показала практика, эти препараты также можно успешно использовать в качестве искусственной слезы.
Вместе с тем, в целях повышения клинической эффективности, композиция гемодеза была модифицирована. На основании проведенных нами совместно с Ю. А. Никитиной исследований (1997-1998), был разработан отечественный препарат «искусственной слезы» Лакривит на основе поливинилпирролидона. Этот препарат дополнительно содержит муколитический агент и оригинальный полимерный консервант катапол. Организованные НТФФ «Полисан» (С-Петербург) исследования показали, что препарат эффективен при лечении кроликов с экспериментально вызванным ССГ, причем на фоне отсутствия побочных эффектов. Получены также и положительные результаты лечения им же больных с упомянутой патологией органа зрения. Промышленный выпуск и широкое клиническое внедрение Лакривита, несомненно, не только повысит эффективность лечения больных с ССГ, но и сделает его доступным для широких масс населения нашей страны.
[banner_centerrs] {banner_centerrs} [/banner_centerrs]
Установлено, что уже с 3-5 дня систематических инстилляций рассмотренных препаратов значительно возрастает, а в ряде случаев даже нормализуется, стабильность слезной пленки. Одновременно уменьшается выраженность субъективных признаков заболевания, несколько позже - и объективных. В дальнейшем функциональные и клинические показатели таких больных стабилизируются.
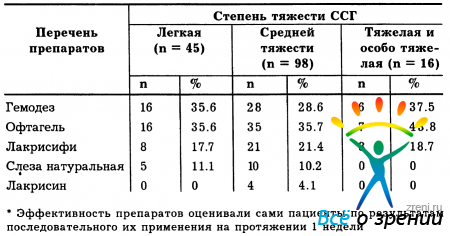
Проведенный нами сравнительный анализ эффективности наиболее доступных препаратов «искусственной слезы» показал, что как по субъективным, так и объективным критериям явно в лучшую сторону выделяются Офтагель (фирма Santen) и Видисик (фирма Bausch & Lomb) [Астахов Ю. С., Олисова И. А., 2002]. Далее за ним в этом плане следуют Лакрисифи, Слеза натуральная и, наконец, Гемодез (Лакривит). В отношении же компенсации только субъективных признаков ксероза более эффективными оказались Гемодез (Лакривит), Офтагель и Лакрисифи. Заметно меньшим клиническим эффектом обладают Лакрисин и Полиглюкин. Отсюда понятно, что большинство пациентов с ССГ, основываясь на субъективных ощущениях, отдают предпочтение Офтагелю и Гемодезу, несколько реже - Лакрисифи и Слезе натуральной. Наименее же предпочтительным препаратом «искусственной слезы» оказался Лакрисин (табл. 8).
Таблица 8. Оценка эффективности использованных для лечения больных с синдромом “сухого глаза” (n = 159) различных препаратов*
Данные литературы и наш опыт показывают, что эффективность лечения больных инстилляциями искусственной слезы напрямую зависит от тяжести роговично-конъюнктивального ксероза. Легкая его клиническая форма достаточно хорошо компенсируется 4-кратными закапываниями упомянутых препаратов с низкими показателями вязкости (Гемодез, Лакрисифи, Слеза натуральная) или более вязкого Офтагеля (до 3 раз в день).
При ксерозе средней степени тяжести лечение лучше начинать с инстилляций Офтагеля (3-4 раза в день). Если в итоге эффект окажется недостаточным, то терапию следует усилить за счет применения одного из препаратов низкой вязкости. Общее число инстилляций в таких случаях может достигнуть 6-8 в течение дня.
В комплексной терапии тяжелого роговично-конъюнктивального ксероза целесообразны частые закапывания составов «искусственной слезы» с низкой вязкостью (Гемодез, Слеза натуральная, Лакрисифи) или, вместо них, уже упомянутого Офтагеля.
Проведенными нами в последний год исследованиями установлена также эффективность в лечении больных, главным образом, с тяжелым роговично-конъюнктивальным ксерозом гелевого препарата Видисик (Baucsh & Lomb). Частота инстилляций этого препарата приблизительно соответствует таковой при назначении Офтагеля.
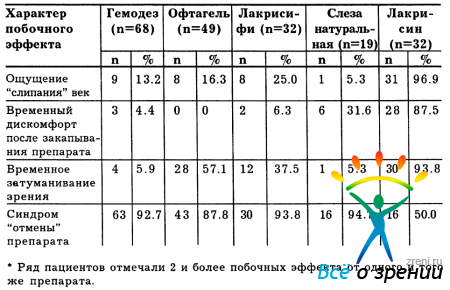
Среди побочных эффектов изученных препаратов необходимо отметить следующие: ощущение «слипания» век (более характерно для Лакрисина, реже, для Лакрисифи и Офтагеля) и временный дискомфорт в виде чувства «инородного тела», возникающий сразу же после инстилляций вязкого Лакрисина или, в меньшей степени, Слезы натуральной. Кроме того, некоторые пациенты отметили временное затуманивание зрения сразу после закапывания Лакрисина, а также Офтагеля и Лакрисифи. Однако эти явления вскоре исчезают на фоне учащенных мигательных движений век. Характерен также так называемый синдром «отмены» препарата, который проявляет себя возобновлением функциональных и клинических симптомов ССГ (табл. 9).
Таблица 9. Основные побочные эффекты, отмечаемые пациентами, при использовании препаратов типа “искусственная слеза”*
Он присущ практически всем исследуемым препаратам, но легко купируется возобновлением их инстилляций.
В целом, искусственные слезы достаточно эффективны в лечении ССГ и служат в нашей стране, пожалуй, наиболее доступными средствами терапии этой патологии. Конкретный выбор их целесообразно производить путем последовательных пробных инстилляций различных препаратов в течение 2-3 суток. В итоге пациент самостоятельно, руководствуясь субъективными ощущениями, определяет наиболее приемлемые для него капли и частоту их инстилляций. При этом он должен знать, что показанием к повторному закапыванию лекарства служит возобновление субъективных проявлений ССГ, купированных предыдущим его введением в конъюнктивальную полость. Сведения о «передозировке» препаратов «искусственной слезы» пока отсутствуют. В то же время следует иметь в виду, что слишком частые (свыше 5 раз в день) инстилляции «искусственных слез» закономерно способствуют вымыванию из конъюнктивальной полости остатков нативной слезной жидкости. Поскольку последняя имеет большое функциональное значение для метаболизма роговицы, в таких случаях целесообразно назначение гелевых препаратов «искусственной слезы» (Офтагель или Видисик), требуемая частота инстилляций которых обычно не превышает 4-5 раз в день.
При отсутствии ожидаемого терапевтического эффекта целесообразно предложить пациенту сочетание двух препаратов с различной вязкостью, ориентируясь на изложенные выше сведения.
Одновременно с препаратами «искусственной слезы» в терапевтических целях находят также широкое применение так называемые глазные «смазки» [Lubricants], напоминающие своей консистенцией глазную мазь. Препараты этой группы (Lacrilube, Dualube, Duratears и др.), подобно мази, следует закладывать за веки перед сном, а в тяжелых случаях - и днем, в расчете на их действие в течение нескольких часов. «Смазки» безусловно показаны пациентам с лагофтальмом любого генеза, а также при жалобах больного на невозможность открыть глаза утром, когда вследствие склеивания за ночь конъюнктивы век с роговицей при открытии глазной щели возникают роговичные эрозии. В качестве их заменителей можно использовать индифферентные глазные мази (например, левомицетиновую), гели (Корнерегель, Актовегин, Солкосерил), а еще лучше - глазную мазевую «основу» (равную смесь вазелина и ланолина), практически не вызывающую аллергии. Однако употреблять их можно только перед сном, так как при открытой глазной щели мазь снижает стабильность слезной пленки.
Наряду с задачей протезирования нативной слезной пленки, в лечении роговично-конъюнктивального ксероза получают использование также стимуляторы слезопродукции и муколитические средства (см. схему 2). Однако показания к их назначению в настоящее время довольно ограничены. В частности, стимулятор секреции слезы Эледоизин, нашедший использование за рубежом, эффективен лишь при условии существования резервных возможностей слезопродукции. Вторым существенным ограничением к широкому применению служит его высокая стоимость. Попытки же использовать в указанных целях холиномиметики (пилокарпин и др.), вовсе не оправдали возлагаемых на них надежд.
Весьма ограниченное использование получили и муколитические средства, предназначенные для растворения слизистых «нитей» и «глыбок» с последующим формированием «слизистой» слезной пленки. Однако эти средства эффективны лишь при сохраненной продукции муцинов, которая имеет место далеко не во всех случаях. Кроме того, Бромгексин, оказавшийся наиболее выгодным муколитическим препаратом, обладает выраженными раздражающими свойствами. Правда, ему свойственен также и стимулирующий слезопродукцию эффект. В последние годы в рассматриваемом отношении начато использование инстилляций в конъюнктивальную полость 10-20% раствора ацетилцистеина (Lemp М. А., 1994). Однако мы пока еще не можем дать окончательную оценку эффективности терапии этого вида. Складывается впечатление, что она в целом эффективна, однако в связи с раздражающими свойствами большинства муколитических препаратов должна проводиться под обязательным «прикрытием» препаратов «искусственной слезы».
Приведенные выше данные свидетельствуют о том, что арсенал терапевтических средств, широко применяемых сегодня для увлажнения глаза из «дополнительных источников» в целях лечения ССГ, достаточно велик. Однако в случае недостаточной их эффективности на первый план могут выступить уже хирургические методы лечения рассматриваемого синдрома, также основанные на дополнительном увлажнении глаза.
Первая операция рассматриваемого плана была предложена еще В. П. Филатовым и В. Е. Шевалевым в 1951 году. Она предусматривала пересадку стенонового протока околоушной слюнной железы непосредственно в конъюнктивальную полость. Однако в связи с технической сложностью и, главное, травматичностью, эта операция сегодня уже практически утратила свое значение. Создаваемый же искусственно таким путем «синдром крокодиловых слез» требовал повторных вмешательств, направленных на уменьшение секретирующей функции околоушной слюнной железы. Кроме того, проблема тяжелого трахоматозного рубцового ксероза, требовавшего данного оперативного пособия, в настоящее время не имеет прежней актуальности. Тем более, что синдром Съегрена, сопровождающийся наиболее тяжелым глазным ксерозом, одновременно протекает и со снижением секреции околоушных слюнных желез.
В то же время в последние годы все большее распространение стала получать операция пересадки в конъюнктивальную полость подъязычных малых слюнных желез (Murube J. et al., 1998-2001). Авторы сообщают о хорошей приживаемости малых слюнных желез в своде конъюнктивы и об их высокой функциональной способности. Так, ими были успешно прооперированы 3 больных с синдромом Съегрена, и 1 - с пемфигусом. Не принесла лишь ожидаемых результатов операция, произведенная больному с синдромом Стивенса-Джонса. У остальных же пациентов отмечено выраженное повышение стабильности прероговичной слезной пленки и общей «слезопродукции» и исчезновение неприятных субъективных ощущений. По-видимому, это операция заслуживает более широкого клинического применения.
Одно из новых и очень важных направлений в терапии больных с ССГ предусматривает создание временных или постоянных условий для сокращения оттока слезной жидкости из конъюнктивальной полости. Эта задача решается сейчас с помощью различных средств как манипуляционного, так и чисто хирургического характера.
Наиболее простым, а потому и широко распространенном способом создания препятствия к оттоку слезы по естественным путям является обтурация слезных канальцев или слезных точек. Благодаря этому, в конъюнктивальной полости задерживается нативная слеза, восстанавливается ее осмолярность и в какой-то мере нормализуется метаболизм конъюнктивы и роговицы. В частности, исследованиями R. M. Willis et al. (1987) установлено, что через 2 и более лет после окклюзии слезных канальцев постепенно увеличивается плотность бокаловидных клеток Becher’a конъюнктивы. Рядом авторов в различные сроки после процедуры также отмечено уменьшение площади прокрашивания роговицы и конъюнктивы витальными красителями, а также уменьшение выраженности объективных признаков ксероза [Gilbard J. P. et al., 1989; Fayet В. et al., 1990 и др.]. Что же касается стабильности слезной пленки и субъективных симптомов ССГ, то тенденция к их нормализации обычно становится явной уже в первые дни после окклюзии слезных точек или канальцев. Кроме того, рассматриваемая процедура также способствует пролонгации эффекта закапанной в глаз искусственной слезы, что позволяет существенно сократить частоту ее инстилляций, а иногда и вовсе прекратить их.
До настоящего времени нет единого мнения о показаниях к окклюзии слезоотводящих путей. Безусловно, эта процедура показана больным с выраженным снижением основной слезопродукции (результат пробы по Ширмеру менее 5мм/5 мин, а по Джонес - 2мм/5 мин и ниже) или с тяжелыми изменениями роговицы (ее истончение или изъязвление, нитчатый кератит). В последнем случае окклюзия необходима даже при незначительном снижении основной секреции слезы (результат пробы по Джонес - 8мм/5 мин и ниже).
Перед проведением процедуры окклюзии слезных точек или канальцев необходимо убедиться в проходимости у осматриваемого больного носослезного протока. Если он закрыт и имеются признаки скрыто протекающего хронического дакриоцистита (отсутствие слезостояния и отделяемого характерны для дакриоцистита при ССГ), то она может спровоцировать развитие флегмоны слезного мешка.
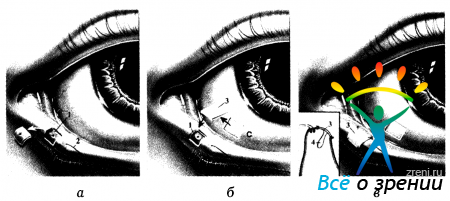
Первоначально для длительной обтурации слезоотводящих путей использовали желатиновые и коллагеновые имплантаты (Foulds W., 1961; Patel S. и Grierson D., 1994; рис. 32),
Рис. 32. Схема интубации слезных канальцев левого глаза коллагеновыми имплантатами.
цианакрилатные клеи (Patten J., 1976). Однако они оказались малоэффективными. Теперь за рубежом в качестве имплантатов стали успешно использовать жесткие силиконовые полимерные пробочки-обтураторы (Freeman J. M., 1975; Herrick R., 1992 и др.), которые вводят в слезные точки или канальцы с помощью специальных проводников.
Существует несколько моделей долгосрочных полимерных обтураторов слезоотводящих путей, среди которых наибольшее распространение получили две:
- пробочки-обтураторы слезных точек
- и обтураторы слезного канальца различных моделей.
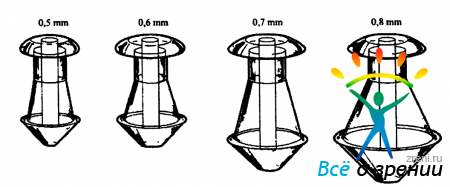
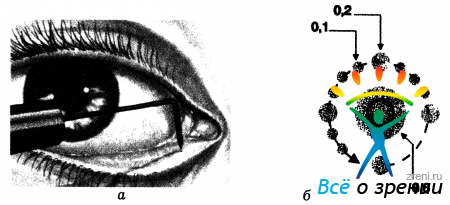
Каждая пробочка, изготавливаемая из силикона (рис. 33),
Рис. 33. Пробочки-обтураторы слезных точек различного размера, производимые фирмой «Eagle Vision».
с помощью специального проводника фиксируется своим расширенным рабочим концом в ампуле слезного канальца, перетяжкой - в устье слезной точки. Наружная часть ее в виде «крышечки» прикрывает сверху слезную точку. Обтураторы такого типа не сложно имплантировать, а при необходимости - и удалять (рис. 34).
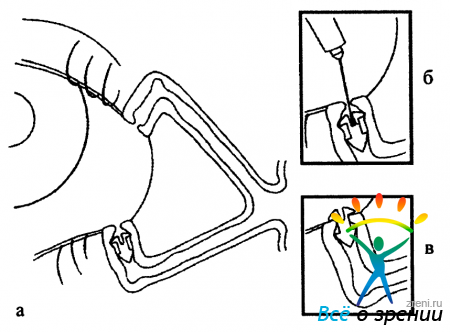
Рис. 34. Этапы репозиции обтуратора нижней слезной точки. а- положение обтуратора, сместившегося в просвет нижнего слезного канальца; б и в- захват дислоцированного обтуратора «иглой-гарпуном» и установка его в правильное положение.
Недостатком их является то, что упомянутая «крышечка» часто травмирует как ткань самой слезной точки, так и прилегающую конъюнктиву века и даже роговицу. В результате у пациентов могут возникать на этой почве различные осложнения, обычно в виде эрозии роговицы и гранулематозных разрастаний у слезного сосочка. Кроме того, возможна
и дислокация обтураторов в просвет канальца, сопровождающаяся иногда разрывом его стенки. Эта проблема оказалась столь актуальной, что M. R. Piccone (2000) даже предложил специальный инструмент для их извлечения и репозиции (см. рис. 34).
Силиконовые обтураторы для слезных канальцев (наиболее распространены изделия фирмы Lacrymedics, рис. 35)
Рис. 35. Силиконовые обтураторы фирмы Lacrymedics (США) различного размера.
предназначены для введения в горизонтальную их часть. Процедура имплантации изделий этого типа достаточно проста и обычно не сопровождается развитием существенных осложнений (рис. 36).
Рис. 36. Основные этапы блокирования нижнего слезного канальца обтуратором производства фирмы Eagle Vision. а- введение обтуратора в вертикальную часть слезного канальца; б- окончательное положение обтуратора.
После обтурации слезных точек или канальцев, выполненной по той или иной методике, у всех пациентов развивается выраженное слезостояние, а нередко - и слезотечение. О такой «плате» за лечение основной патологии они должны быть заранее предупреждены.
С целью оценки ожидаемого эффекта от планируемой долгосрочной обтурации слезоотводящих путей, R. S. Herrick (1992-1994) рекомендует первоначально вводить в оба слезных канальца коллагеновые пробки, которые самостоятельно рассасываются через 4-7 дней. Если в течение этого срока отмечается заметный клинический эффект, в них вводят уже силиконовые пробки (сначала - в верхний, а при недостаточном эффекте - и в нижний). Необходимость постоянной обтурации нижнего слезного канальца определяют описанным уже выше способом, но после повторного временного закрытия его коллагеновой пробкой. Последовательность выполнения основных процедур по окклюзии слезных канальцев по методике R. S. Herrick (1992-1994) представлена на рис. 37.
Рис. 37. Схема поэтапного блокирования слезных канальцев временными и постоянными обтураторами фирмы “Lacrimedics, Inc. а - временная обтурация обоих слезных канальцев; б - постоянная обтурация верхнего и временная - нижнего слезного канальца; в -постоянная обтурация обоих слезных канальцев.
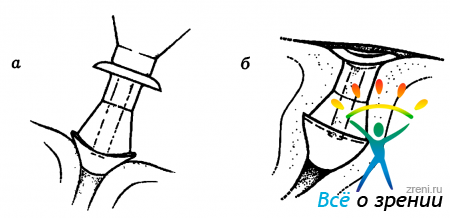
Существуют и хирургические способы обтурации слезоотводящих путей. Среди них весьма эффективной и относительно малотравматичной является операция конъюнктивального покрытия слезной точки, предложенная испанским офтальмохирургом J. Murube Del Castillo (1986-1996). Свободный лоскут конъюнктивы автор предлагает брать с бульбарной конъюнктивы (рис. 38).
Рис. 38. Основные этапы операции конъюнктивального покрытия нижней слезной точки. а- первый этап вмешательства - иссечение над слезной точкой лоскута ткани в форме квадрата(1). Нижнее веко оттянуто с помощью шва-держалки (2). б- второй этап той же операции. Из конъюнктивы глазного яблока иссечен трансплантат (3) для замещения дефекта ткани над слезной точкой, в- третий этап той же операции. Трансплантат (3) перенесен в подготовленное “ложе” и подшит к его краям четырьмя швами. Вход в вертикальную часть слезного канальца (4) закрыт.
Наш опыт выполнения такой операции свидетельствует о высокой ее эффективности при лечении больных с тяжелым роговично-конъюнктивальным ксерозом на почве синдрома Съегрена. При этом мы модифицировали технику операции, исключив всякое иссечение ткани, а слезную точку закрывали легким натяжением предварительно мобилизованного лоскута тарзальной конъюнктивы.
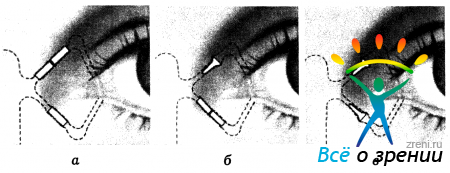
Практически не получили клинического распространения операции, заключающиеся в эксцизии слезного канальца [Sysi R., 1949], хирургической «эктропионизации» нижней слезной точки (Murube J., 1986), «точечной» тарзорафии [Murube J., 1995], сшивания хрящей век в месте локализации слезных точек и др. Эффективность этих операций не компенсирует их травматичности и необратимости. В техническом отношении более приемлемыми выглядят методы закрытия слезных канальцев путем их перевязки или коагуляции слезных точек, в том числе лазерной (рис. 39).
Рис. 39. Способы постоянного блокирования слезной точки. а - диатермокоагуляция; б- лазерная коагуляция. Цифрами отмечены размеры лазерных коагулятов (мм), нанесенных вокруг слезной точки (обозначена кружком).
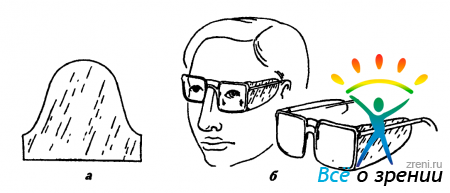
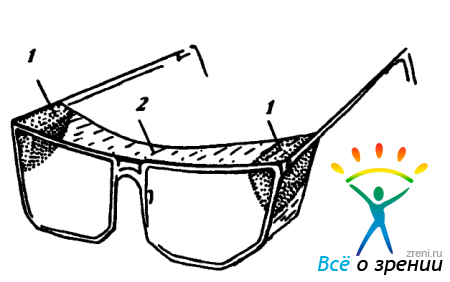
Наряду с уже рассмотренными направлениями терапии, в лечении ССГ определенное значение имеют и мероприятия, способствующие уменьшению испаряемости слезной пленки. В частности, этого эффекта можно достигнуть путем дневного ношения герметизирующих очков (напоминают очки-консервы). В их конструкцию дополнительно введена плотная водонепроницаемая панель, которая крепится к оправе и плотно прилегает к коже лица (рис. 40).
Рис. 40. Герметизирующие очки, а- боковая панель, прикрепляющаяся к наружной части оправы; б- вид очков на лице пациента.
Кроме того, к внутренней поверхности этой панели может быть прикреплена губчатая ткань, предназначенная для периодического увлажнения водой (рис. 41).
Рис. 41. “Увлажняющие” очки (по Tsubota К., 1994). 1- увлажняющая губка; 2- козырек.
В результате глаз оказывается в своеобразной «влажной камере», что также уменьшает испаряемость слезной пленки. При необходимости закапывания в конъюнктивальную полость лечебных препаратов такие очки, естественно, снимают. Подобного типа защитное средство можно изготовить и самостоятельно, используя в качестве основы очки для плаванья.
Наряду с использованием средств и методов, направленных на увлажнение глаза (см. схему 2), в лечении больных с ССГ широко используют и целый ряд средств (главным образом, лекарственных) другой направленности.
В последние годы в комплексном лечении больных с ССГ все большее значение приобретает иммунокорригирующая терапия, позволяющая нормализовать иммунный статус как всего организма больного, так и непосредственно тканей слезных желез, роговицы и конъюнктивы. Разумеется, это благоприятно сказывается на итоговых результатах проводимой терапии.
Из большого перечня иммуномодуляторов наиболее доступными в нашей стране являются
- левамизол (декарис),
- тималин
- и тимоген.
Следует отметить, что при наличии изменений роговицы, конъюнктивы или век дистрофического, воспалительного или иного характера, необходимо одновременно проводить и соответствующую симптоматическую терапию. В частности, в подобных случаях хорошо зарекомендовали себя инстилляции в конъюнктивальную полость витаминных и аминокислотных препаратов (тауфон, катахром и др.), применение стимулирующих регенераторные процессы в роговице и конъюнктиве гелей корнерегеля, актовегина и солкосерила, местное и системное использование антиметаболитов.
У больных с хроническим мейбомиевым блефаритом, сопровождающимся ССГ на почве патологии липидного слоя слезной пленки, хорошо зарекомендовал себя следующий комплекс лечебных процедур. После обработки свободных краев век спирт-эфирной смесью, производят массаж век, путем прижатия их хрящей конъюнктивальными поверхностями друг к другу по всей площади (рис. 42).
Рис. 42. Этап пальцевого массажа мейбомиевых желез век левого глаза.
Затем свободные края век вновь обрабатывают спирт-эфирной смесью, удаляя при этом выдавленный из мейбомиевых желез секрет. Завершают процедуру смазыванием свободных краев век антисептическим раствором. При демодекозной этиологии блефарита в указанных целях используют раствор фосфакола (армина, физостигмина, эзерина, эхотиофата иодида и др.) или одного из сильных антисептиков. Курс лечения включает 10 таких процедур, выполняемых ежедневно или через 1 день. В настоящее время фирмой Eagle Vision для обработки век у больных с блефаритом даже выпускается специальный набор, содержащий соответствующие гигиенические средства. На фоне успешного лечения блефарита и нормализации функции мейбомиевых желез закономерно повышается стабильность слезной пленки. Происходит это за счет утолщения ее липидного слоя (Korb D. R., Greiner J. V., 1994 и др.).
Одновременно с проведением симптоматической терапии целесообразно закапывание «искусственных слез». Они пролонгируют эффект перечисленных лекарственных средств и «смягчают» их возможное раздражающее действие. Искусственные слезы необходимо инстиллировать сразу же после применения упомянутых препаратов, назначенных по традиционным схемам.
В отдельную группу медикаментозных средств следует отнести так называемые протекторы эпителия роговицы [Tsubota К., 1994], среди которых наибольшее значение получили препараты витамина А. Их инсталлируют (например, препарат Augentonikum Stulln фирмы Pharma Stulln GmbH), либо закладывают в виде мази (Vitamine A Dulcis; Allergan) в конъюнктивальную полость больного глаза. Предлагаемые в аналогичных целях препараты ингибитора альдозоредуктазы и эпидермального фактора роста пока находятся в стадии разработки и практического применения не получили.
В лечении ССГ, особенно его синдромальных форм, большое значение имеют также и общеукрепляющие средства: препараты витаминов (А, В1, В2, В6, С, Е), микроэлементов (кальций, железо, магний) и др. Так, по данным Patel S., et al. (1993), только на фоне перорального применения перечисленных выше препаратов у соматически здоровых людей - добровольцев стабильность слезной пленки возросла почти вдвое.
При назначении и проведении лечения больному с ССГ необходимо одновременно выявить и, по возможности, исключить факторы внешней среды, вызывающие (или утяжеляющие) явления ССГ. Они в целом уже были рассмотрены во втором разделе книги. Необходимо, чтобы пациенты с ССГ проживали в помещениях, максимально очищенных от пыли и дыма, особенно если патогенез их заболевания связан со снижением слезопродукции или изменением pH слезы. Большие неудобства при этом возникают, когда влажность окружающего воздуха опускается ниже 50%, что часто происходит в зимние месяцы в комнатах с центральным отоплением.
Резюмируя данный раздел книги, следует подчеркнуть, что рассмотренные выше методы лечения больных с ССГ требуют в большинстве случаев комплексного применения. При этом, конечно, следует ориентироваться на степень тяжести клинического течения заболевания, а также на показатели стабильности слезной пленки. В табл. 10
Таблица 10. Лечебные мероприятия, рекомендуемые больным с различной тяжестью роговично-конъюнктивального ксероза.
представлены сведения, позволяющие дифференцированно осуществлять комплекс лечебных мероприятий таким больным.
При отсутствии положительного эффекта от перечисленных выше мероприятий и в случаях, когда в патогенезе ССГ доминирует снижение общей слезопродукции (результат пробы по Ширмер 2мм/5 мин и менее) показана пересадка в конъюнктивальную полость заинтересованного глаза малых слюнных желез.
Наличие изменений роговицы, конъюнктивы или век дистрофического, воспалительного или иного характера требует проведения одновременно с базовой и соответствующей симптоматической терапии. У больных с синдромальным роговично-конъюнктивальным ксерозом целесообразно также применение иммунокорригирующей терапии.
Контроль за проводимым лечением осуществляют, ориентируясь на показатели стабильности слезной пленки и динамику клинических симптомов ССГ. Периодичность осмотров больных определяют индивидуально, однако в первые месяцы терапии они, по возможности, должны быть еженедельными, а затем, по мере стабилизации явлений ССГ - ежеквартальными или даже ежегодными.
В заключении следует указать, что, несмотря на кажущееся многообразие методов лечения больных с синдромом «сухого глаза», рассмотренная проблема все еще далека от своего оптимального решения. В указанных целях необходима разработка новых, более действенных лекарственных средств, ориентированных на патогенетический тип ССГ, т.е. на вариант нарушения показателей слезопродукции и стабильности слезной пленки. В то же время в арсенале практического врача должны быть и доступные растворы (например, гемодез), которые до клинического внедрения отечественных препаратов «искусственной слезы» могли бы обеспечить им достойную замену.
Заключение
Проблема диагностики и лечения синдрома «сухого глаза» остается одной из весьма актуальных в современной офтальмологии. Из представленных в книге данных следует, что синдром «сухого глаза» может развиваться у людей различного возраста при ряде заболеваний глаз и всего организма.
Диагностика этой патологии органа зрения базируется (с учетом жалоб пациента и его анамнеза) на правильном анализе клинической картины развивающегося заболевания. Для ее объективизации необходим целенаправленный поиск всех известных признаков ксероза поверхностных тканей глаза с постановкой ряда проб, характеризующих функциональное состояние слезопродукции и стабильность прероговичной слезной пленки.
Для оценки основного компонента слезопродукции наиболее эффективна проба по Джонес (1966), а суммарной - по Ширмеру (1903). Рефлекторная секреция слезы определяется по разности результатов обеих проб. Стабильность прероговичной слезной пленки целесообразно оценивать пробой по Норну (1966). Все перечисленные методики просты и доступны каждому практикующему врачу. Несомненно, что активное обследование по этой схеме больных с подозрением на наличие синдрома «сухого глаза» принесет желаемый результат.
Лечение проявлений рассмотренного синдрома наиболее эффективно, когда терапевтические мероприятия осуществляются дифференцированно, то есть с учетом тяжести и патогенетической формы роговично-конъюнктивального ксероза. При этом практически все больные нуждаются в назначении препаратов типа «искусственная слеза», включая гемодез.
Дальнейший прогресс в рассмотренной области, на наш взгляд, связан с поиском новых диагностических средств, позволяющих оценивать стабильность прероговичной слезной пленки без использования инвазивных методик, а также с разработкой таких составов «искусственной слезы», которые были бы ориентированы на различные патогенетические типы синдрома «сухого глаза».
----
Статья из книги: Роговично-конъюнктивальный ксероз (диагностика, клиника, лечение) | В. В. Бржеский, Е. Е. Сомов





Комментариев 0