Лечение глаукомы

Содержание:
Описание
Патогенетические механизмы развития глаукомы имеют две точки приложения — УПК, поражение структур которого приводит к повышению ВГД, и задний отрезок глазного яблока, изменения в котором приводят к глаукомной оптической нейропатии и снижению зрительных функций.С учётом этих фактов в лечении глаукомы существуют два направления: гипотензивная терапия, которая включает медикаментозное, лазерное и хирургическое воздействия, и нейропротекторная терапия.
↑ ЦЕЛЬ
Цель гипотензивной терапии — достижение «целевого давления», которое условно соответствует снижению ВГД от исходного на 30%.
При назначении гипотензивной терапии следует учитывать такие факторы риска, как:
- возраст больного;
- состояние ДЗН (размер и глубина экскавации, наличие прорывов к краю, цвет неврального кольца);
- состояние перипапиллярной зоны (наличие глаукоматозной перипапиллярной атрофии, перипапиллярного склероза хориоидальных сосудов, полосчатых геморрагий);
- состояние поля зрения;
- отягощенная наследственность;
- системная гипотония или склонность к гипотоническим кризам, особенно ночным;
- склонность к мигреням;
- сердечно-сосудистые заболевания с расстройствами центральной гемодинамики;
- нарушение гемодинамики в бассейне внутренней сонной артерии:
- склонность к гипергликемии;
- нарушение реологических свойств крови;
- миопия средней и высокой степени тяжести.
Учитывая вышеперечисленные факторы, можно выделить три группы пациентов с разной тяжестью глаукомного процесса и разным уровнем «целевого давления».
- Больные молодого возраста с начальной стадией глаукомы без выраженного изменения ДЗН и перипапиллярной области, без наследственного фактора и сопутствующей патологии. Уровень «давления цели» соответствует 20-23 мм рт.ст. (тонометрическое давление), что должно соответствовать 30% снижению ВГД от первоначального значения.
- Больные различного возраста с развитой или далеко зашедшей стадией глаукомы, без выраженных сопутствующих заболеваний и наследственного фактора. К этой же группе следует отнести больных с начальными изменениями в поле зрения, но имеющими выраженные изменения в ДЗН или перипапиллярной зоне, а также сопутствующую патологию и неблагоприятный семейный анамнез. Уровень «целевого давления» соответствует 17-20 мм рт.ст. (тонометрическое давление), что должно соответствовать не менее чем 30% снижению ВГД от первоначального значения.
- Больные с развитой и далеко зашедшей глаукомой, с выраженными изменениями в ДЗН или перипапиллярной зоне, а также сопутствующей патологией и неблагоприятным семейным анамнезом. Уровень «давления цели» соответствует 16 мм рт.ст. и ниже (тонометрическое давление), что должно соответствовать не менее чем 35-40% снижению ВГД от первоначального значения.
Выбор метода гипотензивного воздействия следует проводить согласно следующему алгоритму:
- максимально эффективная медикаментозная терапия;
- лазерное воздействие;
- лазерное воздействие плюс медикаментозная терапия;
- непроникающая операция;
- непроникающая операция плюс медикаментозная терапия;
- традиционная проникающая фистулизирующая операция;
- проникающая фистулизирующая операция плюс медикаментозная терапия.
Переход от одного уровня к другому осуществляется при неэффективности проводимой терапии. Однако в некоторых случаях уже в начале терапии приходится прибегать к более значительному воздействию. Поэтому выбор алгоритма медикаментозного воздействия следует проводить с учётом всех особенностей каждого конкретного человека.
↑ ОБЩИЕ ПРИНЦИПЫ МЕДИКАМЕНТОЗНОЙ ГИПОТЕНЗИВНОЙ ТЕРАПИИ
В начале терапии назначают один из препаратов первого выбора, при его неэффективности следует произвести его замену на другой препарат первого выбора или назначить комбинированную терапию (препаратом первого и второго выбора или двумя препаратами первого выбора).
В случае непереносимости или противопоказаний к терапии препаратами первого выбора лечение начинают с использования препаратов второго выбора.
При назначении комбинированной терапии не следует назначать более двух препаратов одновременно. Лучше выбирать комбинированные лекарственные формы. Наиболее широко применяемые в РФ комбинированные препараты: пилокарпин, тимолол, латанопрост.
- Препараты первого выбора: тимолол, латанопрост, транопрост.
- Препараты второго выбора: пилокарпин, бетаксолол, проксодолол, бринзоламид, клонидин.
При проведении медикаментозной терапии необходимо проводить варьирование ЛС. С этой целью 2-3 раза в год в течение 1-2 мес изменяют терапию. Замену следует проводить на препарат другой фармакологической группы.
↑ ОБЩИЕ ПРИНЦИПЫ НЕЙРОПРОТЕКТ0РНОЙ ТЕРАПИИ ПЕРВИЧНОЙ ОТКРЫТОУГОЛЬНОЙ ГЛАУКОМЫ
Нейропротекторная терапия эффективна только при условии достижения "давления цели" любой из вышеперечисленных методик.
Нейропротекцию подразделяют на прямую, когда используемые препараты непосредственно защищают ретинальные ганглии и аксоны зрительного нерва, и непрямую, когда нейропротекторное действие связано с влиянием препаратов на факторы риска, ускоряющие гибель нервных клеток.
К прямым нейропротекторам следует отнести бетаксолол, ферментные антиоксиданты (супероксиддисмутаза), пептидные биорегуляторы (ретиналамин).
ЛС, оказывающие непрямое нейропротекторное действие, можно разделить на препараты первого и второго выбора. К непрямым нейропротекторам относят спазмолитики, ангиопротекторы, антагонисты кальция, ноотропные препараты, антигипоксанты (цитохром С), антиоксиданты (витамины С, Е, РР, пентагидрок сиэтилнафтохинон, метилэтилпиридинол).
↑ ЛЕЧЕНИЕ ОСТРОГО ПРИСТУПА ЗАКРЫТОУГОЛЬНОЙ ГЛАУКОМЫ
- Медикаментозная терапия.
[banner_centerrs] {banner_centerrs} [/banner_centerrs]- Пилокарпин (1% раствор) применяют по следующей схеме:
- в течение первых 2-х часов препарат закапывают по одной капле каждые 15 мин:
- в течение следующих 2-х часов препарат закапывают каждые 30 мин;
- в течение следующих 2-х часов препарат закапывают один раз в час;
- далее препарат закапывают 3-6 раз в день в зависимости от степени снижения ВГД.
- в течение первых 2-х часов препарат закапывают по одной капле каждые 15 мин:
- Тимолол (0,5% раствор) закапывают по 1 капле 2 раза в день.
- Ацетазоламид назначают внутрь по 0,25-0,5 г 2-3 раза в день.
- Кроме системных ингибиторов карбоангидразы можно использовать 1% суспензию бринзоламида 2 раза в день.
- Осмотические диуретики внутрь или парентерально (наиболее часто применяют внутрь 50% раствор глицерина в дозе 2 г/кг).
- Петлевые диуретики можно использовать внутримышечно или внутривенно при недостаточном снижении ВГД (фуросемид в дозе 20-40 мг).
- В тех случаях, когда, несмотря на проведённую терапию, ВГД не снижается, внутримышечно вводят литическую смесь:
- 1-2 мл 2,5% раствора хлорпромазина;
- 1-2 мл 2% раствора дифенгидрамина или 50 мг прометазина;
- 1 мл 2% раствора тримеперидина.
После введения смеси следует соблюдать постельный режим в течение 3-4 суток ввиду возможности развития ортостатического коллапса. - 1-2 мл 2,5% раствора хлорпромазина;
- Пилокарпин (1% раствор) применяют по следующей схеме:
- Для купирования приступа и предупреждения развития повторных приступов проводят лазерную иридэктомию.
- Если приступ не удалось купировать в течение 12-24 ч, то показано хирургическое лечение.
Лечение подострого приступа зависит от выраженности нарушения гидродинамики:
- обычно достаточно произвести 3-4 инстилляции 1% раствора пилокарпина в течение нескольких часов;
- тимолол (0,5% раствор) закапывают 2 раза в день;
- Ацетазоламид назначают внутрь по 0,25 г 1-3 раза в день;
- для купирования приступа и предупреждения развития повторных приступов проводят лазерную иридэктомию.
↑ Гипотензивное лазерное и хирургическое лечение
↑ ЛАЗЕРНОЕ ЛЕЧЕНИЕ ГЛАУКОМЫ
Лазерные методы коррекции ВГД и послеоперационных осложнений играют важную роль в комплексном лечении глаукомы. Следует отметить, что приоритет в разработке лазерных методов лечения в офтальмологии принадлежит отечественным ученым (М. М. Краснов, 1972).
Основные виды вмешательств на радужной оболочке: лазерная иридэктомия и гониопластика.
Лазерная иридэктомия — высокоэффективный и весьма безопасный метод нормализации циркуляции водянистой влаги, что необходимо при лечении закрыто- и узкоугольной глаукомы, иридохрусталикового блока. Для перфорации радужки наиболее широко применяют излучение YAG-лазера из-за наличия «взрывного» эффекта.
Методика лазерной гониопластики заключается в коагуляции периферического отдела радужки параллельно лимбу излучением аргонового лазера. Теоретическая основа метода — явление уплощения коагулированной радужки вследствие некроза, рассасывания и уплощения части стромы, что подтверждается морфологическими исследованиями.
Основные методы воздействия на УПК:
- лазергониопунктура;
- лазертрабекулопластика и её модификации;
- гидродинамическая активация оттока;
- селективная лазертрабекулопластика.
Техника лазергониопунктуры УПК, предложенная М. М. Красновым, по мнению автора, позволяла добиться образования перфорационных отверстий в трабекуле, повышающих отток внутриглазной жидкости в склеральный синус. Однако гистологические исследования выявили иной механизм активации оттока, связанный напрямую с образованием рубцовых изменений в точках лазерных аппликаций и последующей тракцией интактных участков трабекулярного аппарата.
Лазерная трабекулопластика. Дальнейшее развитие методов лазерного воздействия на трабекулу, а также появление новых типов квантовых генераторов для медицинского использования позволили разработать методику лазерной трабекулопластики по Wise, ставшую одной из наиболее часто применяемых лазерных операций при лечении глаукомы.
Особенность вмешательства состоит в том, что применяемый в данном случае аргоновый лазер имеет характеристики излучения, позволяющие добиться более «мягкого» рубцевания участков трабекулы и, как следствие, более эффективной последующей тракции. В результате трабекулопластики происходит более длительное и выраженное, по сравнению с лазергониопунктурой, снижение ВГД.
Лазерные прижигания структур УПК глаза вызывают сморщивание тканей, растяжение трабекулярного аппарата, раскрытие просвета склерального синуса и улучшение оттока внутриглазной жидкости.
Лазертрабекулопластика по Wise заключается в коагуляции трабекулы по всей окружности УПК при следующих параметрах: диаметр пятня излучения в фокальной плоскости 50 мкм, экспозиция импульса 0,1 г, мощность излучения в среднем 100 мВт. Критерий достаточного уровня мощности - образование парогазоного пузырька и появление участка депигментации в области нанесения лазерной аппликации.
Методика радиальной трабекулопластики заключается в нанесении лазерных коагулятов в один ряд от кольца Швальбе до склеральной шпоры. При этом в одном сегменте наносят всего 4-5 рядов прижиганий по 5-6 аппликаций в каждом ряду. Этот способ позволяет сохранить почти всю активную часть трабекулы, а по гипотензивной эффективности радиальная трабекулопластика превышает трабекулопластику по Wise.
Дозированная или поэтапная методика аргон-лазертрабекулопластики имеет некоторые преимущества перед стандартной техникой: лечение менее травматично, меньшая вероятность развития реактивного синдрома, послеоперационный период протекает спокойнее, объём вмешательства может быть дифференцирован в зависимости от стадии процесса и уровня офтальмотонуса.
Гидродинамическая активация оттока. В отличие от трабекулопластики, операцию гидродинамической активации оттока выполняют с помощью импульсного лазера с перфорирующим эффектом — ИАГ-лазером. Гидродинамическая активация оттока вызывает расширение межтрабекулярных пространств, удаляет пигмент и эксфолиации из толщи трабекулы, а также частично приводит к её истончению. Эффект операции проявляется и в случаях, когда повторные аргон-лазерные вмешательства не оказывают гипотензивного действия.
Селективная лазерная трабекулопластика. Короткие лазерные импульсы воздействуют на пигментированные клетки трабекулы. Вследствие большого размера пятна (400 мкм) в зону воздействия лазерного излучения попадает вся часть трабекулы, а не только проекция шлеммова канала.
Селективную лазерную трабекулопластику проводят, используя излучение Nd:YAG лазера длиной волны 532 нм, длительностью импульса 3 нс. размером светового пятна 400 мкм и энергией единичного импульса 0,6-1,2 мДж. Отсутствие термального повреждения ткани трабекулы связывают с короткой продолжительностью лазерного импульса: длительность импульса в процедуре лазерной трабекулопластики — 3 нс, что значительно короче периода термической релаксации хромофора (1 мкс) в пигментированных клетках трабекулярной сетки. Используя меньшую энергию на импульс и пятно большего размера, энергетическое воздействие на трабекулярную ткань в ходе селективной лазерной трабекулопластики составляет 1/6000 от аналогичной при аргонлазерной трабекулопластике и не сопровождается ожогом трабекулы. Эффективность снижения ВГД при селективной лазерной трабекулопластике сравнима с аргонлазерной трабекулопластикой.
Проведение селективной лазерной трабекулопластики показано пациентам с открытоугольной глаукомой, предпочтительно в начальных стадиях процесса. Наилучших результатов достигают при широких УПК с выраженной пигментацией, при эксфолиативной форме глаукомы. Возможно повторное проведение методики селективной лазерной трабекулопластики.
Абсолютное противопоказание: закрытоугольная глаукома, выраженные помутнения роговой оболочки, буллёзная кератопатия.
↑ ГИПОТЕНЗИВНОЕ ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Все основные виды хирургических вмешательств при глаукоме направлены на нормализацию повышенного ВГД. Условно их можно подразделить на несколько видов в зависимости от конкретного механизма действия и точки воздействия.
- Операции, направленные на устранение зрачкового или ангулярного блока, освобождение УПK глаза от мезодермальной ткани или гониосинехий (гониотомия, диатермогониопунктура ab interno, фильтрующая иридоциклоретракция).
- Внутренняя или наружная фистулизация шлеммова канала (трабекулоэктомия, клапанная трабекулотомия, синусотомия, непроникающая глубокая склеротомия).
- Хирургические вмешательства на цилиарном теле, способствующие угнетению продукции внутриглазной влаги (циклокриоаппликация различными охлаждающими агентами, трансконъюнктивальная проникающая циклодиатермия, лазерная контактная и бесконтактная циклокоагуляция).
↑ Устранение зрачкового или ангулярного блока
Фильтрующая иридоциклоретракция показана при органической блокаде УПК глаза.
После отсепаровки конъюнктивального лоскута выкраивают две полоски из поверхностных слоев склеры по направлению к лимбу. У основания полосок производят Т-образный проникающий разрез через все слои оболочек глаза. С помощью окончатого шпателя через второй верхний разрез склеральные полоски проводят из передней камеры в супрацилиарное пространство.
Фильтрующая иридоциклоретракция позволяет одновременно устранить блокаду УПК глаза, расширить угол и сформировать новый путь оттока внутриглазной жидкости.
↑ Фистулизация шлеммова канала
Субсклеральная синусотомия с диатермотрабекулоспазисом предназначена для улучшения лёгкости оттока внутриглазной жидкости из шлеммова канала.
После выкраивания конъюнктивального лоскута отсепаровывают к лимбу поверхностный склеральный лоскут размером 5x4 мм. Локализуют радиальным разрезом склеральный синус, затем иссекают его наружную стенку, включающую глубокие слои склеры, длиной 5 и шириной 2 мм. Кзади от склеральной шпоры пуговчатым электродом наносят два ряда диатермоприжиганий — до 8-10. При этом происходит расширение трабекулы в среднем в 1,5-2 раза. Склеральный лоскут укладывают на место, не подшивая. На конъюнктивальный разрез накладывают непрерывный шов.
Результаты операции показали её высокую степень безопасности и малую травматичность.
Непроникающая глубокая склерэктомия (НГСЭ). Разработана на основе глубокой склерэктомии С. Н. Фёдоровым, В. И. Козловым с соавт, в 1986 г. Принципиальное отличие данной методики — использование естественной проницаемости периферического участка десцеметовой мембраны для оттока внутриглазной жидкости из передней камеры глаза (рис. 33-62).
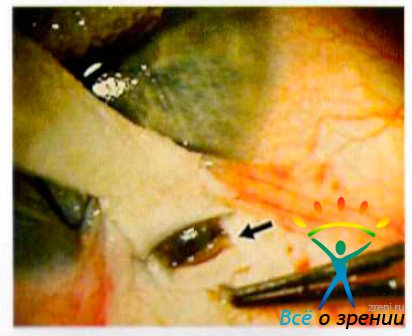
Трабекула с прилегающим участком обнаженной десцеметовой мембраны выполняет двоякую функцию: фильтрующей мембраны и естественного препятствия на пути оттока камерной влаги. Этим объясняется низкая вероятность проблем, связанных с гиперфильтрацией внутриглазной жидкости, а также возникновения воспалительных и геморрагических осложнений, характерных для традиционной хирургии открытоугольной глаукоме. Удаление глубокого склерального лоскута до круговой связки создаёт возможность оттока глазной жидкости в супрахориоидальное пространство и сосуды цилиарного тела.
Следующим этапом усовершенствования НГСЭ стал переход на микроинвазивную технологию с использованием модернизированного инструментария (Тахчиди Х., 1999). Техника микроинвазивной НГСЭ (МНГСЭ) позволяет предельно избежать повреждения ткани в зоне фильтрации и, следовательно, снизить объём рубцевания.
↑ Техника НГСЭ
Конъюнктиву вскрывают и отсепаровывают в верхнем сегменте, отступив 6 мм от лимба. Лезвием выкраивают лоскут 4-5 мм в 1/2 толщины склеры основанием к лимбу, с заходом на 1 мм в прозрачные слои роговицы. В том же направлении из подлежащих слоёв склеры формируют треугольный лоскут С иссечением склеры на вершине лоскута до поверхности цилиарного тела. Далее алмазным ножом отсепаровывают лоскут от круговой связки и иссекают вместе с наружной стенкой шлеммова канала, с освобождением лимбального края десцеметовой мембраны на 0.5-0.8 мм. Наружная стенка шлеммова канала удаляется ирис-пинцетом. Поверхностный склеральный лоскут репонируют и фиксируют к склере.
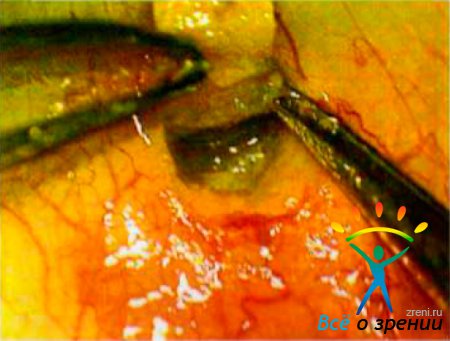
↑ Техника МНГСЭ
Разрез и отсепаровку конъюнктивы выполняют в 0.5-1 мм от лимба длиной 1-2 мм. Поверхностный склеральный лоскут размером от 1,2 до 2,5 мм формируют лезвием, сдвигая края конъюнктивы в стороны. Лоскут расслаивают по направлению к лимбу, заходя на 1 мм в прозрачные слои роговицы. Глубокий склеральный лоскут повторяет форму поверхностного. После открытия кольцевидной связки переходят к отделению стромы роговицы тупым способом, обнажая шлеммов канал и десцеметову мембрану. Для этого лимбальный участок стромы роговицы расслаивают шпателем, а углы глубокого лоскута надрезают ножницами тина Ванас (рис. 33-63).
После этого ирис-пинцетом удаляют наружные слои трабекулы, а глубокий лоскут вместе с роговичной тканью отсекают. Поверхностный склеральный лоскут репонируют.
При проведении НГСЭ либо МНГСЭ у пациентов с высоким риском развития избыточного послеоперационного рубцевания целесообразно интраоперационное применение цитостатика митомицина. Аппликации 0,4% раствора митомицина на склеральное ложе в течение 3 мин с последующим тщательным вымыванием изотоническим (0,9%) солевым раствором осуществляют непосредственно перед отсечением глубокого лоскута вместе с роговичной тканью.
Противопоказания к проведению НГСЭ и МНГСЭ: пациентам с закрытоугольной глаукомой в случаях значительных синехий в УПК глаза, глаукомы с нитреохрусталиковым блоком, а также при выраженных помутнениях оптических сред роговой оболочки, буллёзной кератопатии в сочетании с узким УПК.
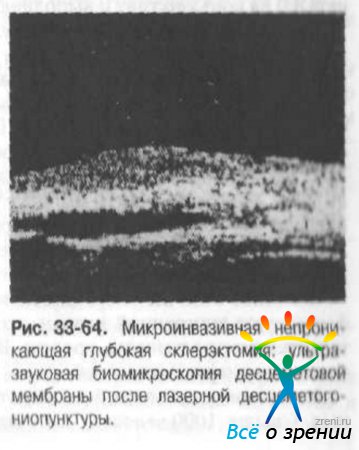
Эффективность НГСЭ (75%) и МНГСЭ (79,9%) значительно повышается за счёт усиления фильтрации десцеметовой мембраны путём проведения лазерной десцеметогониопунктуры в различные сроки после операции, достигая эффективности у 91,7-93% пациентов (рис. 33-64).
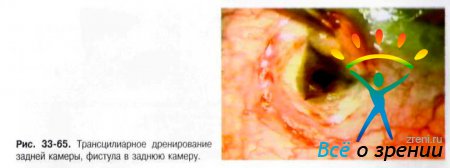
↑ Трансцилиарное дренирование задней камеры
Трансцилиарное дренирование задней камеры — принципиально новая антиглаукомная операция (Тахчиди Х. П., Иванов Д. И., 1991, патент РФ №2007151), проведение которой показано во всех случаях вторичных глауком с органической блокадой УПК, со средней или глубокой задней камерой.
Наибольшее влияние на результаты операции оказывает глубина задней камеры, которая должна быть не менее 0,4 мм.
↑ Микроинвазивная технология трансцилиарного дренирования задней камеры
Разрез и отсепаровку конъюнктивы выполняют в 0,5-1 мм от лимба длиной 2,5 мм.
Формируют лоскут 2-3 мм в половину толщины склеры основанием к лимбу, таким образом, что его края выходят за пределы разреза конъюнктивы. Под ним формируют глубокий склеральный лоскут почти на всю толщину оставшихся слоёв склеры, после чего на поверхности цилиарного тела остаются отдельные склеральные волокна в виде «паутинки». Глубокий лоскут повторяет по форме поверхностный, отступя от краёв последнего на 0,1 мм вовнутрь. Этим достигают сокращения до минимума контакта поверхностного склерального лоскута с подлежащими слоями склеры, что уменьшает вероятность их сращения в послеоперационном периоде. При расслоении глубокого склерального лоскута по направлению к лимбу обнажается кольцевидная связка — основной топографический ориентир при выполнении основного этапа операции. Тотчас кзади от кольцевидной связки формируют фистулу в заднюю камеру (рис. 33-65).
Для этого через световод для эндокоагуляции подают излучение диодного лазера длиной волны 810 нм, мощностью 1400-1800 мВт и длительностью импульса 0,5 с. После получения стабильной фильтрации внутриглазной жидкости глубокий склеральный лоскут удаляют. Герметизацию конъюнктивального разреза проводят наложением шва 10,0 (типа кисетного).
↑ Глубокая склерэктомия с эксплантодренированием
Глубокая склерэктомия с эксплантодренированием показана при проведении хирургического лечения пациентам с вторичной ЗУГ любой этиологии и стадии, врождённой глаукомой с органическими изменениями УПК и в случаях многократно оперированной ЗУГ с декомпенсацией офтальмотонуса. В ходе оперативного лечения имплантируют гидрогелевый дренаж с высоким содержанием воды (рег. № 29/01091099/0060 00, Россия).
Относительное противопоказание к проведению данной технологии: ЗУГ с выраженной неоваскуляризацией УПК.
↑ Техника глубокой склерэктомии с эксплантодренированием
После обработки операционного поля на верхнюю прямую мышцу накладывают уздечный шов. В 5 мм от лимба выполняют разрез и отсепаровку конъюнктивы. Формируют склеральный лоскут 4x4 мм на глубину 320 мкм и расслаивают до роговичного края лимба. Далее удаляют средние слои склеры размером 4x3 мм, а глубокие, перпендикулярно лимбу, в форме полоски 1.5х3,0 мм. Вскрывая переднюю камеру, ножницами типа Ванас выполняют базальную иридэктомию размером 2x2 мм. Внутренний конец дренажа имплантируют в переднюю камеру на глубину 1.0-1,5 мм, прикрывая его основной частью обнаженное цилиарное тело и оставшиеся слои склеры. Репонированный склеральный лоскут, покрывающий дренаж вместе с его наружной частью, фиксируют к склере швом 10,0. На боковые стороны склерального лоскута накладывают по одному склеро-конъюнктивальному клапанному шву 8,0, завязывая их «простым развязывающимся узлом». Накладывают обвивной шов 8,0 на конъюнктиву и выполняют инъекцию гентамицина с дексаметазоном.
↑ Операция клапанной трабекулотомии
Операция клапанной трабекулотомии — одна из наиболее «массовых» и применяемых операций (Нестеров А. П. и др., 1985), универсальная по своему назначению, показана при самых различных формах и стадиях глаукомы.
После выкраивания конъюнктивального и поверхностного склерального лоскутов производят сквозной разрез параллельно лимбу в области задней границы склерального синуса. Из этого разреза кпереди наносят две радиальные насечки. Насечки длиной около 1.5 мм производят ножницами Ванаса или сапфировым лезвием на расстоянии 2 мм друг от друга. Концы насечек должны доходить впереди до роговичной прозрачной ткани. Затем производят базальную иридэктомию. На поверхностный склеральный лоскут накладывают узловые швы. Коньюнктивальный разрез ушивают непрерывным швом.
Основное отличие операции состоит в том, что из глубокой пластинки склеры формируют внутренний клапан, который позволяет в первые дни после вмешательства контролировать уровень ВГД, не допуская ни излишней гипотонии, ни повышении офтальмотонусо.
Авторами получен стойкий гипотензивный эффект у прооперированных больных (более 1000 человек) в отдалённые сроки в 84% случаев, что примерно
соответствует эффективности наиболее распространенной в мире операции трабекулэктомии. Вместе с тем клапанная трабекулотомия менее травматична и даёт меньшее количество операционных и послеоперационных осложнений.
↑ Операции на цилиарном теле, уменьшающие продукцию внутриглазной влаги
При операции циклокриокоагуляции (Егоров Е. A., Альмалак С. Х., 1981) криоаппликации наносят трансконъюнктивально в 8-12 точках в нижнем отделе глазного яблока, отступя от лимба на 3-4 мм. Схема криокоагуляции: вначале две аппликации с промежутком между ними около 3 мм, затем криоаппликатор ставят в этот промежуток и добиваются полного его перекрытия ледяной сферой. Такая последовательность проведения операции позволяет добиться повторного охлаждения двух соседних участков цилиарного тела, что существенно повышает последующий деструктивный и гипотензивный эффект.
Циклокриотерапия с применением различных охлаждающих агентов позволяет добиться положительного эффекта в сроки до 2 лет после вмешательства у 60% больных с далеко зашедшей и терминальной глаукомой.
Лазерная циклокоагуляция (Нестеров А. П. и др., 2001). С помощью контактного световода диодного лазера с длиной волны 810 нм трансконъюнктивально в 3-5 мм концентрично от лимба на 270-300 градусов наносят 20-25 лазерных коагулятом. Режим работы: мощность 1,0-1,3 Вт, экспозиция 2,7-3 с, диаметр фокального пятна — 500 мкм. Для профилактики реактивного синдрома рекомендуется при менять 1% раствор диклофенака в течение 2 нед.
↑ Хирургическая стимуляция увеосклерального оттока
Операция субсклеральной синусотомии в сочетании с трабекулоспазисом и циклодиализом. После отсепаровки конъюнктивального лоскута и выкраивания поверхностного склерального лоскута размером 5x5 мм локализуют шлеммов канал и иссекают его наружную стенку. Выше синусотомии на 3 мм линейным разрезом вскрывают глубокие слои до супраувеального пространства. Через этот разрез производят циклодиализ. Склеральную шпору прошивают П-образным швом и с его помощью погружаются в супраувеальное пространство, расширяя его. Наружный склеральный лоскут фиксируют 2-4 узловыми швами. На конъюнктиву накладывают непрерывный шов. В результате операции наблюдают существенное расширение трабекулярного аппарата и супраувеального пространства.
В отдалённые сроки офтальмотонус остаётся на нормальных цифрах у 74% оперированных больных. Этот тип вмешательства стимулирует отток внутриглазной жидкости как через дренажную систему глаза, так и по увеосклеральному пути.
К операциям, стимулирующим увеосклеральный путь оттока, относится также гониоциклодилатация.
После выкраивания поверхностного склерального лоскута (4x4 мм) основанием к лимбу проводят два параллельных разреза на расстоянии 2 мм длиной 3 мм до прозрачных слоев роговицы. Затем концы их соединяются в роговице поперечным разрезом. Производят обратный циклодиализ. Шпателем выкроенный лоскут склеры подворачивают внутрь и имплантируют в супрацилиарное пространство, сформированное после циклодиализа. Базальная иридэктомия. На склеральный поверхностный лоскут накладывают узловые швы, на конъюнктиву — непрерывный шов. Этот тип операции сочетает стимуляцию увеосклерального оттока, фистулизацию склерального синуса и расширение УПК глаза.
↑ Методы повышения эффективности хирургии глаукомы
Два новых подхода в хирургии глаукомы позволили уменьшить частоту неудачных исходов при фистулизирующих операциях.
Один из них заключён в иссечении участка склеры и эписклеры в зоне хирургического вмешательства. Уменьшение количества клеточных элементов в этой зоне сопровождается ослаблением фибробластической реакции на операцию.
Второй, более радикальный подход связан с использованием антиметаболитов во время оперативного вмешательства (Егоров Е. А. и др., 1996) или после него. Одним из наиболее перспективных способов повышения эффективности хирургического лечения глаукомы в последние годы признают внедрение цитостатиков фторурацила и митомицина.
В клинике глазных болезней РГМУ (1997) разработана методика интраоперационного применения цитостатиков при синусотомии и клапанной трабекулотомии. Наибольшее распространение получили фторурацил и митомицин. Экспериментальные исследования показали подавляющее действие этих метаболитов на фиброцеллюлярную и коллагеновые структуры после антиглаукоматозных операций.
Методику клапанной трабекулотомии и субсклеральной синусотомии с термотрабекулоспазисом дополнили интраоперационным использованием цитостатиков фторурацила и митомицина. При обоих видах вмешательства после выкраивания склерального поверхностного лоскута под него закладывают на 3-5 мин кусочек коллагеновой гемостатической губки, пропитанный раствором цитостатика. После удаления губки зону операции обильно промывают физиологическим раствором и просушивают. Затем производят дальнейшие этапы операции по обычной схеме.
Особое внимание при проведении данной методики необходимо обратить на качество ушивания конъюнктивального разреза. Непрерывный или узловатый шов должен плотно закрывать операционную рану.
Использование антиметаболитов существенно уменьшает частоту фиброзного перерождения фильтрующих путей в послеоперационном периоде.
---
Статья из книги: Офтальмология. Национальное руководство | Аветисов С.Э.


Комментариев 0