Особенности фармакокинетики препаратов, применяемых для лечения заболеваний глаз │ Часть 1

Описание
Глазная фармокинетика — это наука, которая занимается изучением изменения концентрации лекарственного вещества в тканях глаза в зависимости от дозы и пути введения препарата.Очень важно иметь возможность предсказать эти изменения, зная всего лишь ограниченное число химических и физических свойств лекарства. Чтобы справиться с поставленной задачей, необходимо проанализировать проникновение лекарства в область его действия через тканевые барьеры, возникающие на его пути. Кроме того, оценивая фармакокинетические свойства лекарственных препаратов, необходимо учитывать особенности циркуляции внутриглазной и слезной жидкостей.
Используемые методы анализа распределения лекарственного препарата в тканях глаза во многом соответствуют тем методам, которые применяются в системной фармококинетике. Однако при изучении внутриглазной кинетики, в связи с характерными свойствами глаза, особое внимание уделяется ограниченным взаимоотношениям между двумя соседствующими средами, например такими как глазная жидкость и стекловидное тело или роговица.
Наиболее широко применяемый для анализа кинетики глазных препаратов метод состоит в использовании флюоресцирующих веществ в качестве индикаторов, что позволяет произвести замер концентрации во всех прозрачных средах живого глаза человека или животного с помощью специального прибора — флюорометра. Чаще всего используется флюоресцеин натрия, нетоксичное вещество, не имеющее фармакологической активности, не присоединяемое тканями и определяемое даже при очень малых концентрациях. Многие липофобные лекарства подчиняются законам кинетики подобно флюоресцеину натрия. Чтобы оценить особенности фармакокинетики липофильных соединений, можно использовать жирорастворимый краситель родамин В.
Используя радиоизотопные вещества или высокоэффективную жидкостную или газовую хроматографию, так же можно измерить концентрацию лекарственных препаратов в различных тканях. Эти методы позволяют более точно замерить концентрацию вещества, однако, как правило, требуется забор биологического материала (жидкости или ткани), что возможно только при проведении хирургического вмешательства.
Глазную фармакокинетику можно изучить, определяя биологическую реакцию глаза на активные компоненты препарата.
Обычные фармакокинетические модели описывают концентрацию препарата как функцию дозы и времени. В противоположность им фармакодинамические модели независимы от времени и отражают связь между концентрацией и эффектом.
Так как фармакологический эффект воздействия препарата на организм количественно зависит от введенной дозы, то кривая биологической реакции может отражать поведение кривой изменения концентрации лекарства в тканях. Таким образом, фармакокинетика данного лекарства может быть проанализирована на основании биологической реакции, которую оно вызывает.
Для фармакокинетического анализа особенно подходит реакция внутриглазных мышц — миоз, мидриаз, циклоплегия. Может быть использована динамика внутриглазного давления или чувствительности роговицы, так как эти параметры можно измерить «на живом организме». Перспективным является использование электроретинографии, а также моделей хронического воспаления сосудистой оболочки для анализа кинетики препаратов. Более подробно данная методика будет описана ниже.
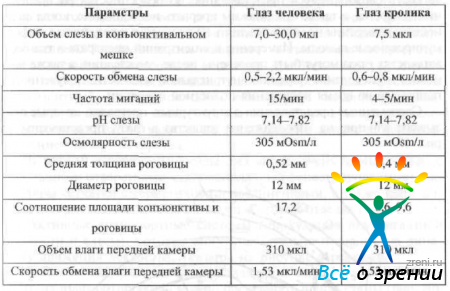
При проведении фармакокинетического анализа приходится полагаться на результаты экспериментов, проводимых на животных. В качестве живой модели в экспериментах чаще всего используются кролики, хотя иногда исследования проводятся у обезьян. Несмотря на схожесть кинетических процессов кролика и человека, имеется рад различий, которые могут существенно влиять на получаемые при анализе параметры (табл. 6).
Таблица 6. Основные анатомические и физиологические параметры глаз кролика и человека, необходимые для проведения фармакокинетического анализа (по данным T. J. Zimmerman, 1997)
Когда фармакокинетическая модель у животных становится полностью понятной, возникает необходимость проведения экспериментов на человеческом глазу для того, чтобы выявить в какой степени можно использовать эту модель для определения поведения лекарственного препарата в тканях глаза человека. Некоторые из этих исследований могут иметь нетравматический характер с использованием в качестве измерителей концентрации либо инертных веществ (индикаторов), таких как флюоресцеин, или радиоизотопных веществ, которые легко позволяют прослеживать распределение лекарственного вещества.
Однако иногда необходимо взять образец ткани или жидкости из глаза пациента, чтобы определить концентрацию лекарственного вещества. Так как получение образца происходит путем дополнительного внутриглазного вмешательства, которое может повредить пациенту, то возникают сомнения, этично ли это делать. Очень важно, чтобы была предварительно поставлена четкая цель исследования и оно было хорошо спланировано для того, чтобы извлечь как можно больше полезной информации. Исследователи должны заранее установить, какой параметр определяется и принесут ли дальнейшие измерения большую четкость сложившемуся представлению об особенностях распределения лекарства, а также они должны прервать исследование, когда дальнейшие измерения не могут повлиять на полученные результаты и сформулированные выводы. Измерение концентраций препарата в тканях и жидкостях глаза могут быть проведены после энуклеации, а также возможно исследование образцов внутриглазной жидкости, полученной у пациентов во время проведения полостной операции.
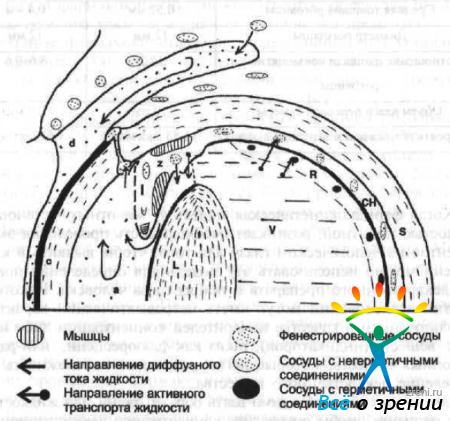
Современные представления о структурных преградах, которые оказывают влияние на продвижение вещества в глазу, представлены на рис. 19.
Рис. 19. Схематическое изображение барьеров и транспортных систем, которые оказывают влияние на продвижение вещества в глазу (по данным D. M. Maurice, S. Mishima).
d - слеза, с - роговица, s — склера, а - внутриглазная жидкость, l — радужка, z — цилиарное тело, L - хрусталик, v - стекловидное тело, R - сетчатка, СН - хориоидея.
d - слеза, с - роговица, s — склера, а - внутриглазная жидкость, l — радужка, z — цилиарное тело, L - хрусталик, v - стекловидное тело, R - сетчатка, СН - хориоидея.
Плотные ткани глаза, в которых имеется ограничение скорости диффузии веществ, заштрихованы, причем концентрация штрихов прямо пропорциональна серьезности преграды. Таким образом, отчетливо видно, что лучше всего диффузия вещества осуществляется через стекловидное тело, а в хрусталике глаза она затруднена. Клеточный барьер между различными областями обозначен жирной линией. Толщина линии указывает на степень, в которой этот барьер мешает продвижению вещества. Наибольшим сопротивлением диффузии веществ обладает эпителий роговицы, хрусталика и пигментный эпителий сетчатки. Абсолютное значение проницаемости этих барьеров зависит от растворяемости в липидах исследуемого вещества, но каждый из этих барьеров влияет на распространение любого лекарства.
На рис. 19 изображены сосуды трех видов: очень проницаемые, с небольшими отверстиями хориокапилляры (фенестрированные), капилляры сетчатки с герметичными соединениями, а также капилляры с негерметичными соединениями в других отделах глаза.
Активные транспортные системы (циркуляция внутриглазной жидкости и слезы), которые могут значительно повлиять на динамику движения лекарства, указаны на рисунке стрелками.
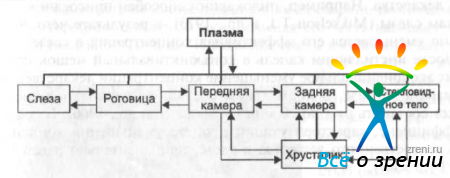
Наиболее важные отделы, составляющие кинетическую систему глаза, их взаимоотношения можно представить в виде схемы (рис. 20).
Рис. 20. Схема кинетической системы глаза.
Представленные отделы составляют цепь из пяти элементов, каждый из которых связан с плазмой. С хрусталиком также связаны три внутриглазных отдела, но обмен между ними ограничен из-зa большой сопротивляемости диффузии в ткани хрусталика.
[banner_centerrs] {banner_centerrs} [/banner_centerrs]
Имея представление о кинетической системе глаза, можно провести анализ распространения лекарств в тканях глаза при различных способах введения.
Особенности кинетики лекарственных препаратов при их местном применении в виде глазных капель и мазей
При лечении разнообразных заболеваний глаз наиболее часто используется непосредственное введение лекарственных средств в коньюнктивальный мешок в виде мазей и капель. Чтобы определить режим применения препаратов для практического врача, очень важно знать, какая доля лекарства достигнет тканей глаза.
Количество вещества, попавшее в глаз, зависит от того, в какой степени капля лекарственного средства была разбавлена слезной жидкостью, находящейся в конъюнктивной полости, а также от того, насколько быстро лекарство вымывается слезой. Поэтому характеристика циркуляции слезы заслуживает особого внимания.
Слезная пленка — это водянистый слой, покрывающий поверхность роговицы и слизистой однородным слоем, толщина которого в зоне роговицы около 8 мкм (Mishima S., 1965; Ehlers N., 1965). Ее общий объем в глазу взрослого человека в среднем составляет 8 мкл (Mishima S. и др., 1966). Средняя скорость секреции слезы равна 0,6—1,4 мкл/мин.
Несмотря на несколько увеличенную норму содержания калия, состав новообразованной слезы подобен составу диализата плазмы (Iwata S., 1973). В слезе содержится белок, который может связывать лекарства. Например, пилокарпин способен присоединяться к белкам слезы (Mikkelson T. J. и др., 1973), в результате чего значительно уменьшается его эффективная концентрация в слезе.
После инстилляции капель в конъюнктивальный мешок происходит экспоненциальное уменьшение концентрации лекарственного препарата в слезе, в нормальном состоянии период полураспада может составить от 2 до 20 мин (Mishima S. и др., 1966). В среднем коэффициент, характеризующий процесс уменьшения концентрации лекарственного вещества в слезе, приблизительно равен 6 ч-1 (1 ч -1 = 6 мин).
Увеличение скорости циркуляции слезы, следовательно, и уменьшение периода полувыведения, может быть вызвано раздражением глаза, болевыми ощущениями, зеванием или эмоциональными реакциями.
С другой стороны, сильное подавление как продукции, так и оттока слезы происходит при различных состояниях: во время общей и местной анестезии (Krupin Т. и др., 1977; Patton T. F., Robson J. M., 1975), с увеличением возраста (Furukawa R. E. и Poise К. А., 1978). В тот момент, когда глаза закрыты, происходит уменьшение скорости обмена слезы примерно в два раза (Murai Y., 1976). В результате замедления циркуляции слезы период полувыведения может значительно увеличиться.
Когда глаза открыты, а веки неподвижны, слезная жидкость делится на три основных отдела: неподвижный слой, покрывающий незащищенную роговицу и слизистую, слой, увлажняющий слизистую под веками, чаще всего неподвижный, и слезные ручейки, вдоль которых происходит поток слезы. Смешивание между этими гремя отделами происходит в момент мигания, в этот момент вещество, растворившееся в прероговичной пленке, перераспределяйся. При отсутствии мигания прероговичная пленка не перемешивается, и обменные процессы между слезой и окружающими тканями протекают изолированно.
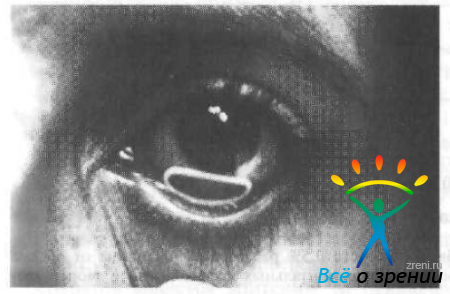
Количество лекарства, попадающее в роговицу или слизистую, в значительной степени зависит от общего объема слезы и скорости eе циркуляции. В клинической практике время, в течение которого лекарство находится в слезе, можно увеличить разными способами. С этой целью используют глазные лекарственные формы с высокой вязкостью или сложные технические устройства (контактные линзы, пропитанные лекарственным препаратом, или специальные устройства - «Окусерт» (Ocusert) и т.д.). Введение устройства «Окусерт» в конъюнктивальный мешок показано на рис. 21.
Рис. 21. Система «Окусерт» в конъюнктивальном мешке (по данным М. В. Shields, 1998).
После однократной инстилляции капли препарата, номинальный объем которой составляет 50 мкл, большая его часть выпивается из конъюнктивального мешка. Небольшая часть введенного раствора (около 10-20 мкл), которая остается в конъюнктивальном мешке, частично оттекает по слезоотводящим путям со скоростью около 2 мкл при каждом мигании. Во время миганий лекарственное вещество, растворенное во введенной капле, смешивается со слезой. В результате оно разбавляется, и концентрация вещества в слезной пленке в среднем составляет одну треть от изначального количества вещества в капле (Sugaya М., Nagataki S., 1978). После того, как препарат смешался со слезой (Chrai S. S. и др., 1973), его концентрация постоянно уменьшается из-за нормальной секреции и удаления слезы, а также в результате всасывания в ткани слизистой оболочки и роговицы. Некоторыми авторами (Ridley F., 1958; Sidikaro J., Jones D. B., 1981) было отмечено уменьшение скорости потери лекарственного вещества из слезы после того, как концентрация препарата снижается до низкого уровня. Этот эффект может быть объяснен тем, что некоторая часть лекарства, которое уже проникло в эпителий слизистой, возвращается в слезную пленку.
В результате всасывания избытка лекарственного препарата в сосуды конъюнктивы, слезоотводящих путей и полости носа возможно развитие отрицательного системного действия.
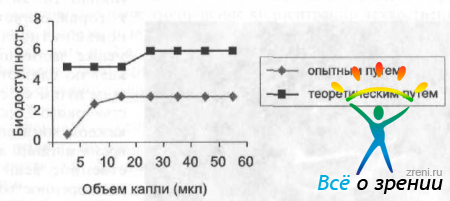
При закапывании капли, объем которой превышает 50 мкл, не происходит увеличения объема раствора, остающегося в конъюнктивальной полости. По данным ряда авторов (Patton, 1977; Sugaya, Nagataki, 1978), увеличение объема капли пилокарпина более 20 мкл не приводит к повышению эффективности, но было отмечено, что терапевтическое действие капли объемом 5 мкл соответствует 1/2 максимальной эффективности (диагр. 3).
Диаграмма 3. Зависимость биодоступтости 0,5% раствора пилокарпина от объема закапываемой капли (по данным экспериментальных исследований и теоретических расчетов).
Биодоступность определяли по степени максимального миоза. которая во всех случаях была ниже ожидаемой (по данным Sugaya, Nagataki, 1978).
Биодоступность определяли по степени максимального миоза. которая во всех случаях была ниже ожидаемой (по данным Sugaya, Nagataki, 1978).
Таким образом, без потери эффективности объем капли может быть уменьшен до 20 мкл. Поэтому более рационально использовать специальные флаконы-капельницы, которые четко дозируют объем вводимой капли препарата.
Кроме особенностей обмена слезы, на кинетику препаратов, вводимых в конъюнктивальный мешок, влияет уровень кислотности слезы, осмотическое давление и способность препарата связываться с белками.
Многие лекарства являются слабыми кислотами или основаниями, степень ионизации которых, а, следовательно, их растворимость в липидах зависит от уровня pH. При введении лекарственных препаратов происходит изменение уровня кислотности в конъюнктивной полости, которая полностью не нейтрализуется в течение получаса (Longwell А. и др., 1976). Таким образом, действие введенной капли может иметь продолжительное влияние на ионизацию лекарства в слезной пленке. Swan К., White N. G. (1945) было отмечено, что проникновение прокаина увеличивается более чем в 10 раз при изменении уровня pH от 7 до 9,5, и что этот диапазон соответствует переходу полностью ионизированной основы к ее недиссоциированной форме.
Еще одним фактором, влияющим на концентрацию лекарственного препарата в конъюнктивальной полости, является осмотическое давление введенного раствора. Так как слезная пленка очень тонкая, то она быстро вступает в осмотическое равновесие с кровью. После ввода гиперосмотической капли, под действием осмотического давления из слизистой немедленно дренируется избыточная жидкость и осмотическое давление в слезной пленке не возрастает.
Следовательно, после ввода лекарства, обладающего гиперосмотическими свойствами, произойдет очень быстрое его растворение, а проникновение не будет большим, чем для изотонического раствора. С другой стороны, гипотонические капли должны отдавать жидкость слизистой оболочке до тех пор, пока их тоничность не вырастет до показателей крови. Это может привести к тому, что концентрация лекарственного препарата в слезной пленке может намного превысить ожидаемую.
При введении лекарственного вещества в конъюнктивальный мешок существуют два основных пути проникновения вещества в переднюю камеру: через роговицу и через слизистую оболочку глаза.
Прямой переход из слезы в переднюю камеру происходит через роговицу и основным барьером для проникновения лекарственных препаратов является эпителий, за исключением липофильных соединений, которым клеточные слои не оказывают сопротивления, в этом случае барьером может являться строма. Кроме того, происходит потеря лекарства в результате всасывания в сосуды лимбальной области.
На практике было отмечено, что если с помощью специальных устройств перекрыть доступ лекарства к роговице или поверхности слизистой, большую роль в проникновении веществ играет роговица. В результате ряда экспериментов (Doane M. G. и др., 1978), в ходе которых конъюнктивный мешок кролика заполняли раствором гидрокортизона, помеченного радиоактивным изотопом, при этом предварительно поверхность роговицы закрывалась неподвижной металлической контактной линзой, было установлено, что во внутриглазную жидкость попало в 70 раз меньшая доля лекарства в том случае, когда раствор не соприкасался с роговицей. Подобный результат был получен и в результате экспериментов с пилокарпином.
Как было отмечено выше, основной путь проникновения лекарственного препарата из слезы во влагу передней камеры — пенетрация его через роговицу.
Роговицу можно представить в виде трехслойной структуры, состоящей из стромы, покрытой с обеих сторон клеточными эпителиальными слоями. Толщина роговицы человека в ее центральной части в среднем составляет 0,52±0,04 мм и увеличивается ближе к краям; ее диаметр равен 11 мм, вес составляет 70 мг. У кролика ее толщина постоянна по всей поверхности и увеличивается с возрастом от 0,35 мм до 0,45 мм.
Клетки эпителия объединены прочными соединениями, которые образуют барьер, обладающий сильным сопротивлением прохождению липофобных растворов. Липофобные вещества могут проникать в переднюю камеру только путем фильтрации через межклеточные пространства. Проницаемость эпителия роговицы для гидрофильных веществ зависит от размера молекулы и степени ионизации раствора. Липофильные вещества проникают непосредственно через цитоплазматические мембраны с помощью пассивной (по градиенту концентраций) или облегченной (с помощью специфических переносчиков) диффузии.
В случае пассивной диффузии количество лекарства, проходящего через роговицу, пропорционально его концентрации в слезной пленке, но имеется очень мало данных для доказательства этого утверждения. Если препарат проникает в ткани роговицы с помощью облегченной диффузии (например, данный вид транспорта характерен для новокаина), после насыщения переносчиков молекулами препарата дальнейшее прохождение лекарства в роговицу замедляется и носит нелинейный характер.
Проницаемость эндотелия почти полностью зависит от молекулярного веса растворенного вещества и не зависит от величины его заряда.
Эндотелий является барьером с малой сопротивляемостью, для малых ионов его проницаемость в 200 раз больше, чем у эпителия. При увеличении размера молекулы данная диспропорция увеличивается. Состояние эндотелиального слоя указывает на то, что проникновение гидрофильных веществ в основном осуществляется через межклеточные пространства, и эта гипотеза подкрепляется тем фактом, что под действием холода происходит процесс замедления диффузии малых ионов через эндотелий пропорционально увеличению вязкости воды.
Строма роговицы образована несколькими сотнями тонких слоев, состоящих из фибрилл коллагена и кератоцитов, между которыми расположено основное вещество, в состав которого входят гликозаминогликаны. С точки зрения фармакокинетики строма относительно открытая структура. Растворенные вещества, не превышающие определенный размер, хорошо проникают в собственное вещество роговицы. При неизмененной строме эта критическая цифра соответствует молекулярному весу 500 000 дальтон. При отеке стромы она становится проницаемой и для более крупных молекул.
Роговица - это не только барьер на пути распространения лекарственных веществ, но и резервуар для них. Накопление препаратов в тканях роговицы может увеличивать кажущийся объем распределения (гипотетический объем жидкостей организма, необходимый для равномерного распределения всего количества данного вещества в концентрации, равной его концентрации в плазме крови) в несколько раз.
На строму приходится около 90% толщины роговицы. Строма является своего рода основным резервуаром для гидрофильных лекарств. Однако степень присоединения в данном случае не очень высокая и не приводит к наличию в кинетике заметных нелинейностей. Ее можно рассматривать как фактор, уменьшающий эффективную концентрацию вещества в строме или увеличивающий видимый объем распределения стромы. В строме находятся в большом количестве кератоциты, которые могут стать резервуаром для липофильных лекарств.
Эпителий может быть альтернативным резервуаром для липофильных веществ, например, таких как пилокарпин (Sieg J. W., Robinson J. R., 1976).
Эндотелий имеет толщину 3 мкм, поэтому его можно не рассматривать в качестве резервуара для растворенных веществ.
Конъюнктива играет меньшую роль в проникновении лекарственных препаратов в переднюю камеру. Она представляет собой мембрану, состоящую из соединительной ткани, покрытой многослойным эпителием, плавно переходящим в эпителий роговицы. Ее общая площадь в глазу человека составляет 16 см2.
Из слезы препарат путем диффузии проникает в эпителий слизистой оболочки. Проницаемость его больше, чем у эпителия роговицы. Эпителий конъюнктивы, подобно эпителию роговицы, может образовать резервуар для жирорастворимых лекарств (Sendelbeck L. и др., 1975; Hamard Н. и др., 1975), которые возвращаются обратно в слезную пленку, как только концентрация лекарственного вещества в слезе уменьшается.
Большая часть препарата, поступившая в слизистую оболочку, всасывается в обширную сосудистую сеть этой зоны и попадает в системный кровоток. Кроме того, в системный кровоток препарат попадает, всасываясь в сосуды увеального тракта, слизистой носа и носоглотки. Доля лекарства, вернувшегося обратно в глаз через большой круг кровообращения после его всасывания в кровь, может быть проверена путем замеров в контралатеральном глазу, и может быть значимой для кролика, но, к сожалению, не для человека.
Та часть вещества, которая проникает в слизистую и не всасывается в кровь, затем диффундирует в склеру. Чуть позже из склеры вещество может попасть в плоскую часть цилиарного тела и радужную оболочку глаза. В зоне лимба вещество может проникать непосредственно в переднюю камеру, однако часть вещества распространяется в собственное вещество роговицы. Склера проницаема даже для достаточно крупных белковых молекул, однако скорость их диффузии намного меньше, чем в роговице.
Как только лекарство попадает в переднюю камеру, оно начинает циркулировать в глазной жидкости и имеет доступ к передней поверхности радужной оболочки глаза и части хрусталика, расположенной в области зрачка. Край зрачка формирует клапан, в результате чего в нормальном глазу конвекционный поток назад в заднюю камеру не осуществляется. Как у кроликов (Cunha-Vaz J. G.. Maurice D. M., 1969), так и у людей (Nagataki S., 1975) после системного или местного введения флуоресцеина видна слабоокрашенная жидкость, текущая через зрачок в ярко флуоресцирующую переднюю камеру.
Пористость ткани радужки приводит к тому, что макромолекулы легко проникают в нее, что изменяет их внутриглазную кинетику. Вещества способны накапливаться в радужке, они вновь возвращаются во влагу передней камеры, когда их концентрация в передней камере значительно снижается. Но часть вещества, накопившегося в тканях радужки, имеет доступ к сосудам радужной оболочки. Хотя эндотелиальные клетки капилляров радужной оболочки не имеют отверстий, они соединены прерывистыми точечными зажимами. Поэтому растворимые вещества малого молекулярного веса все же могут проникнуть в кровь.
Радужка имеет малую толщину и омывается с обеих сторон постоянно обновляющейся жидкостью, таким образом, лекарство, попавшее в радужку, вернется обратно во влагу передней камеры через небольшой интервал времени. С другой стороны, хрусталик представляет собой сплошную массу клеток, так что проникающие в него из стекловидного тела или глазной жидкости растворенные вещества долго не вымываются из него. Небольшая часть вещества, попавшего в хрусталик, возвращается обратно, и это можно считать главной причиной нахождения растворенных веществ в передней камере через 2 дня после местного применения лекарства.
На кинетику препарата могут оказывать влияние метаболические процессы, происходящие в различных тканях глаза.
Во время проникновения в глаз некоторые лекарства разрушаются, в результате чего в передней камере появляются не только первоначальные соединения, но и их метаболиты. Этот процесс в основном приводит к ослаблению действия лекарства, но в случае пролекарств, когда изначально планируется, что продукт распада обладает лучшими свойствами по сравнению с исходным соединением, действие препарата усиливается.
Далее будут рассмотрены особенности метаболизма некоторых препаратов.
Инактивация пилокарпина происходит в тканях передней камеры глаза, это связано с обратимым присоединением лекарства к тканям, а также с ферментативным гидролизом.
В результате после местного применения пилокарпина у кролика 40% вещества в роговице и 75% в передней камере составляют метаболиты пилокарпина, причем в основном пилокарпициды.
Скорость метаболизма препаратов может быть генетически детерминирована. Примером является различие в мидриатической реакции на атропин, которая значительно меньше у кроликов, в тканях глаза которых содержится эстераза атропина, чем у кроликов, у которых нет этого фермента. Это указывает на возможность значительного влияния эстеразы атропина на глазную фармакокинетику лекарства. Данный признак имеет частично доминантный тип наследования.
Некоторые противовирусные лекарства также подвержены метаболическому распаду, происходящему вероятнее всего в эпителии роговицы.
В системной фармакокинетике для анализа особенностей распределения лекарственных препаратов организм представляют в виде одной или нескольких частей (камер), ограниченных проницаемой мембраной, в которых равномерно распределяется лекарственное вещество. Понятие «камера» (компартмент) условно. Это не какое-либо анатомически ограниченное пространство; это единица, используемая для создания фармакокинетических моделей.
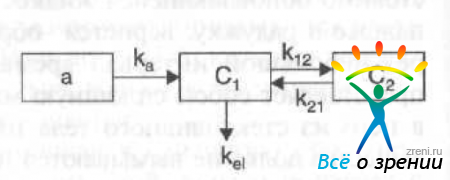
Наиболее простой является однокамерная фармакокинетическая модель, при которой организм представляется в виде единой гомогенной камеры. Однако кинетические данные, полученные при математических расчетах однокамерной модели, для многих лекарственных препаратов не соответствуют истине. Более приемлемы двух- и трехкамерные модели (рис. 22).
Рис. 22. Схема многокамерной фармакокинетической модели.
Данная модель состоит из трех компартментов: а — камера, характеризующая процесс всасывания (депо препарата), С1 - центральная камера, С2 - периферическая камера. Центральная камера — это, как правило, меньший по объему отдел, который объединяет плазму и хорошо перфузируемые органы (сердце, легкие, печень и т.д.). Периферическая камера представлена плохо перфузируемыми тканями (мышцы, кожа, жировая ткань). Обмен между этими отделами характеризуется несколькими константами: kа — константа скорости всасывания; kel — константа скорости элиминации; k12 и k21 — константы перехода вещества из центральной камеры в периферическую и обратно. Эго модель наиболее часто используется для расчета фармакокинетических параметров при внесосудистом введении лекарственных препаратов. На основе этой же модели можно смоделировать кинетику лекарственных веществ при их закапывании в коньюнктивальный мешок. Но, прежде чем перейти к описанию моделей, применяемых в глазной фармакокинетике, следует остановиться на некоторых параметрах, широко используемых для описания фармакокинетических процессов.
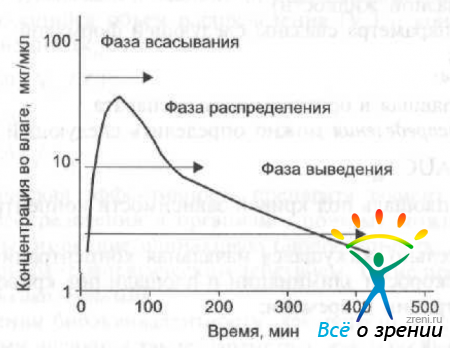
После введения лекарственного вещества его концентрация начинает быстро увеличиваться сначала в центральной камере и в меньшей степени в периферической камере. После достижения своего максимального значения концентрация постепенно снижается. Этот период времени называется фазой распределения (?-фаза) и характеризуется константой скорости распределения (?). Затем следует интенсивное выведение лекарственного средства из организма. Этот период называется фазой выведения (элиминации) (?-фаза) и характеризуется константой скорости выведения (?).
Зависимость между всеми перечисленными константами выражают следующие формулы:
Фаза распределения лекарственного препарата может быть описана с помощью таких параметров, как период полураспределения, кажущаяся начальная и равновесная концентрация, объем распределения. При внесосудистом введении препарата на его распределение будет влиять период полуабсорбнии (рис. 23).
Рис. 23. Схема распределения лекарственного вещества во влаге передней камеры в течение фазы распределения и выведения.
Период полуабсорбции (Т1/2а) — время, необходимое для всасывания половины дозы препарата из места введения в кровь (в случае глазной фармакокинетики во внутриглазную жидкость).
Период полураспределения (Т1/2а) — время, необходимое для достижения концентрации препарата в крови (в случае глазной фармакокинетики во внутриглазной жидкости), равной 50% от равновесной, т.е. при наличии равновесия между центральной и периферической камерами.
Кажущаяся начальная концентрация (С0) - концентрация препарата, которая была бы достигнута в плазме крови (в случае глазной фармакокинетики во внутриглазной жидкости) при внутривенном введении (в случае глазной фармакокинетики при внутриглазном введении) лекарственного средства и мгновенном распределении его по тканям.
Кажущийся объем распределения (Vd) - гипотетический объем жидкостей организма (в случае глазной фармакокинетики объем жидкостей глаза), необходимый для равномерного распределения всего количества данного вешества в концентрации, равной его концентрации в плазме крови (в случае глазной фармакокинетики во внутриглазной жидкости).
Эти два параметра связаны следующей формулой:
где D — попавшая в организм доза препарата.
Объем распределения можно определить следующей формулой:
где AUC — площадь под кривой зависимости концентрации и времени.
Следовательно, кажущаяся начальная концентрация зависит от константы скорости элиминации и площади под кривой зависимости концентрации и времени:
Равновесная концентрация (Сss) — концентрация препарата, которая устанавливается в плазме крови (в случае глазной фармакокинетики во внутриглазной жидкости) при поступлении препарата в организм с постоянной скоростью. Она зависит от биодоступности препарата (F), дозы, кажущегося объема распределения и коэффициента скорости элиминации:
где t - интервал времени от момента введения препарата до взятия пробы.
Биодоступность (F) - часть дозы препарата, которая достигла системного кровотока (в случае глазной фармакокинетики внутриглазной жидкости) после внесосудистого введения (в случае глазной (фармакокинетики при невнутриглазном введении). Она определяется как отношение площади по кривой зависимости концентрации от времени после внесосудистого введения (невнутриглазного) препарата к площади зависимости концентрации от времени после внутривенного введения (внутриглазного) лекарственного средства.
Для количественного описания процесса элиминации используется параметр, который носит название периода полувыведения (Т1/2) лекарственного средства из организма (его также называют периодом биологического полураспада или полужизни, периодом полусуществования, полуэлиминации). Он характеризует скорость падения содержания препарата в жидкостях и тканях организма и равен времени, за которое концентрация лекарства уменьшается вдвое.
Период полувыведения зависит от таких параметров, как клиренс (С1), кажущийся объем распределения (Vd) и константа скорости элиминации (kel):
Терапевтическая эффективность препарата зависит от особенностей его распределения в организме, поэтому можно ожидать, что препараты, имеющие одинаковую биодоступность, будут обладать соразмерным терапевтическим действием. Такие препараты называют биоэквивалентными.
При изучении биоэквивалентности лекарственных средств наиболее важными являются такие параметры, как максимальная концентрация лекарственного средства в крови (в случае глазной фармакокинетики во внутриглазной жидкости) [Cmax], время достижения максимальной концентрации [Тmax], площадь под кривой зависимости концентрации от времени [AUC].
Время достижения максимальной концентрации является функцией, отражающей соотношение между величинами констант скорости всасывания и элиминации.
Процесс распределения лекарственного препарата после его инстилляции в конъюнктивальный мешок, который подробно был описан выше, изображен на рис. 24.
Рис. 24. Схема распределения лекарственного препарата после его инстилляции в конъюнктивальный мешок (по данным D. M. Maurice, S. Mishima).
На представленном рисунке показаны отделы глаза (рис. 24, а), влияющие на распределение веществ, и графики изменения концентрации препарата в этих отделах (рис. 24, б).
После закапывания капли лекарственного препарата концентрации вещества (Сb) в слезе быстро снижается. Затем происходит экспоненциальное уменьшение концентрации лекарственного препарата в слезной пленке (Cd) с константой скорости а = 0,6 ч-1. В результате пенетрации препарата через эпителий роговицы растет его концентрация в ткани (Сс), этот процесс регулируется двумя параметрами: проницаемостью эпителия (Рdc) и коэффициентом скорости абсорбции (kdc). Он практически завершается через 10—20 мин. Из роговицы препарат проникает во влагу передней камеры, в результате чего его концентрация в передней камере увеличивается (Са) и достигает своего максимума в момент времени Тmax. Данный процесс определяется коэффициентом скорости переноса (распределения) между роговицей и передней камерой (kс). В период времени, когда происходит параллельное экспоненциальное уменьшение концентрации препарата в роговице и внутриглазной жидкости, процесс можно описать, используя коэффициент, обозначенный как g (коэффициент равновесных концентраций). Переднюю камеру лекарство покидает в трех направлениях:
- вместе с внутриглазной жидкостью по путям оттока (данный процесс описывается коэффициентом вытекания [kf =0,7 ч-1] (коэффициент получен в результате экспериментальных исследований);
- всасываясь в сосуды радужки (процесс описывается коэффициентом потерь (элиминации) [ko]);
- лекарственное вещество накапливается в ткани радужки и хрусталика, но при значительном уменьшении концентрации препарата во влаге передней камеры вещество вновь возвращается в нее из депо (процесс характеризуется коэффициентом диффузного обмена [kd]).
Таким образом, кинетика препарата в передней камере после его местного применения определяется двумя компонентами, роговицей и внутриглазной жидкостью, и для того, чтобы в достаточной мере описать их, требуется открытая система с двумя отделами, используемая в традиционной фармакокинетике.
Распространение вещества в отделах роговицы и передней камеры регулируется коэффициентами переноса между ними и между глазной жидкостью и кровью (рис. 25).
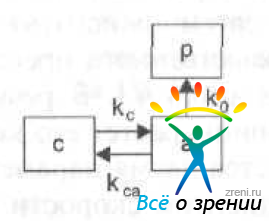
Рис. 25. Двухкамерная фармакокинетическая модель, используемая в глазной фармакокинетике.
(р — плазма крови, с — роговица, а — передняя камера)
(р — плазма крови, с — роговица, а — передняя камера)
Другие ткани, особенно радужная оболочка глаза, могут иметь значительное влияние на кинетику многих лекарств (например, пилокарпина); в этой ситуации необходимо использовать экспериментальные данные в модели с дополнительными отсеками (рис. 25а).
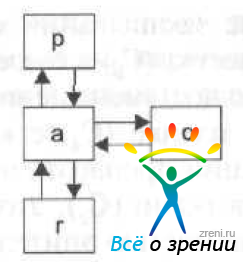
Рис. 25а. Трехкамерная фармакокинетическая модель, используемая в глазной фармакокинетике.
(р — плазма крови, с - роговица, а -передняя камера, r — дополнительный отсек, образованный радужкой и хрусталиком)
(р — плазма крови, с - роговица, а -передняя камера, r — дополнительный отсек, образованный радужкой и хрусталиком)
Наиболее часто для описания кинетики глазных лекарственных форм используется двухкамерная модель, изображенная на рис. 25.
Кинетика препарата внутри этой модели определяется тремя коэффициентами: коэффициент скорости удаления вещества из внутриглазной жидкости в кровь (k0), коэффициент скорости обмена между роговицей и передней камерой относительно объема роговицы (kс или kaс). коэффициент скорости обмена между передней камерой и роговицей относительно объема передней камеры (kса). Единица измерения для этих параметров ч-1.
Коэффициент скорости потери препарата из передней камеры в кровь соответствует коэффициенту скорости элиминации (kе1), который используется в системной фармакокинетике, а коэффициенты скорости обмена между роговицей и влагой передней камеры соответствуют коэффициентам скорости обмена между центральной и периферической камерами (k12 и k21).
Взаимоотношения между этими коэффициентами можно определить следующими формулами:
где А и В — коэффициенты очевидного удаления и всасывания.
Продолжение в следующей статье: Особенности фармакокинетики препаратов, применяемых для лечения заболеваний глаз ? Часть 2
----
Статья из книги: Офтальмофармакология. Руководство для врачей | Е.А. Егоров, Ю.С. Астахов, Т.В. Ставицкая


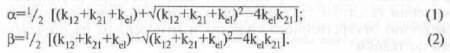




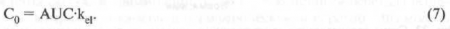
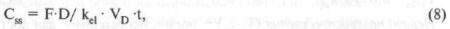
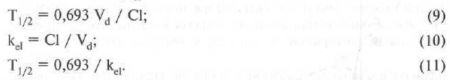
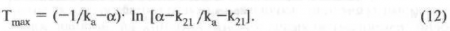

Комментариев 0