Поражение органа зрения при заболеваниях щитовидной железы | РАЦИОНАЛЬНАЯ ФАРМАКОТЕРАПИЯ В ОФТАЛЬМОЛОГИИ

Описание
ЭпидемиологияВ последние годы отмечен рост распространенности аутоиммунных заболеваний щитовидной железы (ЩЖ), в том числе у детей (наименьший возраст на момент начала заболевания составляет 2 года). В 60% случаев заболевания ЩЖ сопровождаются поражением мягких тканей глазницы и глаза, которое обусловливает необходимость в лечении у офтальмологов.
По данным литературы, в различных странах мира аутоимунные заболевания ЩЖ (диффузный токсический зоб, тиреоидит Хошимото) выявляются у 0,5—2% населения. Примерно у 73—81% больных с гипертиреозом развивается эндокринная офтальмопатия (ЭО). Среди женщин поражение органа зрения при заболеваниях ЩЖ ежегодно выявляется у 16 на 100 тыс., у мужчин — у 2,9 на 100 тыс. Средний возраст заболевших составляет 35— 58,8 года. Женщины заболевают в 2,7—5,25 раза чаще мужчин.
Классификация
Отсутствие четких данных о причинах и механизмах и последовательности поражения глаз при заболеваниях ЩЖ привело к использованию в научной литературе и клинической практике большого количества терминов. В нашей стране принят термин «эндокринная офтальмопатия», что более обосновано с учетом зоны поражения и патогенеза заболевания.
Формы ЭО в зависимости от особенностей клинической картины и морфологических изменений, развивающихся в мягких тканях глазницы на различных стадиях патологического процесса:
- тиреотоксический экзофтальм;
- отечный экзофтальм;
- эндокринная миопатия.
Стадии в зависимости от выраженности симптомов:
- компенсация;
- субкомпенсация;
- декомпенсация.
Этиология и патогенез
ЭО представляет собой экстратиреоидное проявление базедовой болезни в виде аутоиммунного органоспецифичного процесса, ассоциирующего, как правило, с претибиальной дерматопатией. Получила распространение концепция, в соответствии с которой в развитии ЭО основную роль играют антиген-специфические механизмы с инфильтрацией тканей глазницы иммунокомпетентными клетками, преимущественно Т-лимфоцитами CD4, и в меньшей степени В-лимфоцитами.
Аутореактивные Т-лимфоциты распознают тиреотропин-рецепторный антиген, общий для ЩЖ, жировой клетчатки глазницы и экстраокулярных мышц. Общий антиген может быть распознан Т-клеточными рецепторами на Т-лимфоцитах CD4, в результате чего образуются цитокины, что в еще большей степени усиливает иммунную реакцию.
В тканях глазницы при ЭО преобладают Т-лимфоциты с Тh-профилем (вырабатывающие интерлейкин-2, у-интерферон, факторы некроза опухолей — ФНО). Наряду с этим в иммунологическом ответе при ЭО принимают участие клеточные медиаторы гуморального иммунитета — лимфоциты с Th2-профилем цитокинов: интерлейкин- (ИЛ-) 4, ИЛ-5, ИЛ-10.
Адгезия моллекул, образование которых опосредуют цитокины в экстраокулярных мышцах при ЭО, играет важную роль в развитии патологического процесса и распознавании антигена. Клеточная активация и локальная экспрессия моллекул адгезии способствуют скоплению и миграции в очаге воспаления лейкоцитов.
Фибробласты клетчатки глазницы, которые стимулируются цитокинами Т- и В-лимфоцитов, рассматриваются в настоящее время как ключевые эффекторные клетки, продуцирующие регуляторные медиаторы, которые опосредуют местный воспалительный ответ в тканях глазницы при ЭО.
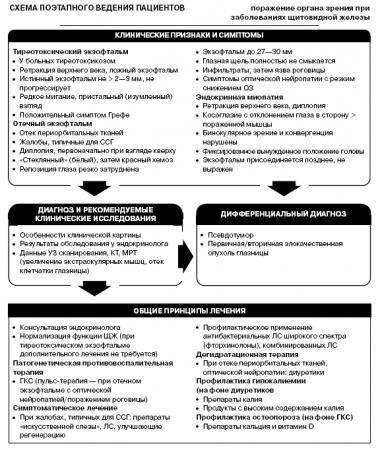
Клинические признаки и симптомы
Тиреотоксический экзофтальм наблюдается у больных с тиреотоксикозом, характеризуется расширением глазной щели за счет ретракции верхнего века с развитием ложного экзофтальма. Истинный экзофтальм не превышает 2—3 мм и не прогрессирует. Характерны редкое мигание, пристальный (изумленный) взгляд, положительный симптом Грефе. Специального лечения не требуется.
При компенсации функции ЩЖ все симптомы исчезают.
Отечный экзофтальм начинается с преходящего, а затем постоянного отека периорбитальных тканей. Нередко отеку периорбитальных тканей предшествует легкий интермитирующий неполный птоз верхнего века. В это время больные предъявляют жалобы, типичные для синдрома сухого глаза (чувство сухости, инородного тела в глазах, быстрая зрительная утомляемость).
[banner_centerrs] {banner_centerrs} [/banner_centerrs]
Появляется диплопия, первоначально при взгляде кверху. Нарушение венозного оттока из глазницы сопровождается «стеклянным» (белым) хемозом (стадия субкомпенсации), на смену которому приходит красный хемоз (декомпенсация процесса), становится резко затрудненной репозиция глаза. Экзофтальм может достигать значительной выраженности (27—30 мм). Глазная щель полностью не смыкается.
В роговице появляются инфильтраты у нижнего лимба, в отсутствие лечения приводящие к развитию язвы роговицы с последующим ее гнойным расплавлением. Сдавление сосудисто-нервного пучка у вершины глазницы сопровождается появлением симптомов оптической нейропатии с быстрым и резким снижением остроты зрения.
Эндокринная миопатия характеризуется ретракцией верхнего века и диплопией, которая вначале имеет интермитирующий характер, затем становится стационарной.
Достаточно быстро развивается косоглазие с отклонением глаза в сторону наиболее пораженной мышцы, подвижность его в противоположную сторону резко ограничена, бинокулярное зрение и конвергенция нарушены. Стремление подавить мучительную диплопию приводит к фиксированному вынужденному положению головы. Экзофтальм при эндокринной миопатии присоединяется позднее и никогда не достигает значительной выраженности. Отек периорбитальных тканей, кератопатия, оптическая нейропатия, характерные для отечного экзофтальма, отсутствуют.
Диагноз и рекомендуемые клинические исследования
Диагноз устанавливают на основании особенностей клинической картины, результатов обследования у эндокринолога, данных ультразвукового сканирования, компьютерной и магнитно-резонансной томографии, с помощью которых выявляются увеличение экстраокулярных мышц, отек клетчатки глазницы.
Дифференциальный диагноз
Дифференциальный диагноз проводят с псевдотумором, первичной или вторичной злокачественной опухолью глазницы.
Общие принципы лечения
Лечение ЭО следует начинать с нормализации функции ЩЖ и только после консультации эндокринолога.
Патогенетическая противовоспалительная терапия
Необходимый компонент терапии — ГКС, оказывающие противовоспалительное, противоотечное и иммуносупрессивное действие, а также подавляющие деструкцию тканей и развитие склероза. Противовоспалительный эффект проявляется в стабилизации биологических мембран, подавлении активности фибробластов в тканях глазницы, опосредующих не только иммунный ответ, но и развитие воспаления за счет подавления синтеза цитокинов 1, ингибирования экспрессии генов, ответственных за синтез противовоспалительных цитокинов (ФНО-а, ИЛ-1, ИЛ-6, ИЛ-8), а также молекул адгезии.
Противоотечный эффект обусловлен ингибированием секреции гликозоаминогликанов, уменьшением проницаемости капилляров и количества лаброцитов. Последние обеспечивают синтез гиалуроновой кислоты, которая принимает непосредственное участие в связывании и транспортировке воды. Подавление деструктивных процессов в тканях глазницы достигается за счет стабилизации лизосомных мембран.
Имеются сведения о том, что применение ГКС приводит к угнетению синтеза мукополисахаридов (гликозоаминогликанов) и образования фибробластов, благодаря чему уменьшается синтез коллагена и нарушается процесс развития фиброза. В исследовании Y. Song и соавт. показано снижение концентрации ФНО-а в плазме крови больных с ЭО в 1,54 раза по сравнению с исходным уровнем через 24 ч после внутривенного введения больших доз метилпреднизолона (по 500 мг/сут в течение 3 сут).
Иммуносупрессивный эффект связан с тем, что применение ГКС способствует нормализации функции Т- и В- лимфоцитов, уменьшению количества нейтрофилов и макрофагов в участках воспаления, подавлению функции иммунокомпетентных клеток и свободных медиаторов. Основой хронического воспаления при ЭО считают цитокины — низкомолекулярные белковые молекулы с массой не более 50 кД (ФНО-а), которые и обеспечивают межклеточные связи иммунокомпетентных клеток.
Показаниями к применению ГКС служат декомпенсированная и субкомпенсированная формы отечного экзофтальма, эндокринная миопатия в активной стадии при длительности заболевания не более 6 мес. Основным показанием к проведению пульс-терапии служит отечный экзофтальм с оптической нейропатией или поражением роговицы.
Лечение при ЭО всегда следует начинать с использования ГКС в максимальных дозах, оказывающих терапевтический эффект, но не сопровождающихся развитием осложнений.
Обычно лечение начинают с назначения преднизолона:
Преднизалон внутрь 40—90 мг/сут, 10—12 сут, затем снижение дозы на 5 мг каждые 5—7 сут до 20—30 мг, затем постепенная отмена в течение 3—4 мес.
При резкой декомпенсации с угрозой утраты зрительных функций, отечном экзофтальме с оптической нейропатией или поражением роговицы:
I Дексаметазон внутрь 4 мг каждые I 6—8 ч, 3—4 сут.
Или пульс-терапия:
Метилпреднизолон в/в капельно медленно (в течение 60—90 мин) 1000 мг 1 р/сут, 3 сут подряд (1-я неделя), затем 500 мг 1 р/нед (2—4-я неделя), затем 250 мг 1 р/нед (5—7-я неделя), затем 125 мг с интервалом в 10—12 сут (4—5 введений).
В промежутках между введениями метилпреднизолона рекомендуется использовать преднизолон в поддерживающей дозе (по 25—30 мг/сут с постепенным уменьшением дозы на 5 мг каждые 7— 14 сут). Такая схема длительного лечения способствует быстрому подавлению воспалительного процесса в тканях глазницы, а последующее использование препарата в поддерживающей и постепенно уменьшающейся дозе на протяжении 9— 10 нед закрепляет полученный терапевтический эффект.
При вовлечении в процесс мышц глазницы, гипертрофия которых в сочетании с отеком ретробульбарной клетчатки приводит к сдавлению зрительного нерва: Бетаметазон ретробульбарно 1 мл
1 р/сут, 5—6 сут или Бетаметазона динатрия фосфат/бетаметазона дипропионат ретробульбарно 1 мл 1 р/7—12 сут, всего 4 —5 введений или Дексаметазон ретробульбарно 1 мл (4 мг) 1 р/сут, не более 7—10 сут.
Симптоматическое лечение
При компенсации ЭО, а иногда еще до появления экзофтальма, при редком мигании и пристальном взгляде одной из первых жалоб служат чувство «засоренности» в глазах, слабо выраженное жжение, резь. К вечеру больные ощущают зрительную утомляемость, появляется светобоязнь, слезотечение.
При субкомпенсации и декомпенсации отечного экзофтальма, когда затруднено смыкание век, повышается риск вовлечения в процесс роговицы. При этом больные предъявляют жалобы на дискомфорт, обусловленный сухостью роговицы и бульбарной конъюнктивы. У таких больных можно достичь эффекта путем введения препаратов «искусственной слезы», играющих заместительную роль.
Так как заболевания характеризуется хроническим течением, лечение должно быть длительным (определяется индивидуально с учетом тяжести состояния). Благодаря использованию препаратов «искусственной слезы» удается достичь увлажнения открытой поверхности глаза; они длительно удерживаются на роговице и конъюнктиве за счет повышенной вязкости и защищают их от высыхания.
В последнее время наилучший эффект удается получить при использовании декспантенола и карбомера. Эти препараты представляют собой стерильные гели с повышенной вязкостью, что способствует их длительному контакту с роговицей и конъюнктивой. Для уменьшения выраженности симптомов достаточно закапывать указанные препараты 1—3 р/сут. Декспантенол и карбомер более длительно удерживаются на поверхности роговицы и конъюнктивы за счет высокой вязкости. При кератопатии ускоряется эпи- телизация роговицы:
Декспантенол в конъюнктивальный мешок по 1 капле 1—3 р/сут, длительно или Карбомер в конъюнктивальный мешок по 1 капле 1—3 р/сут, длительно.
При появлении первых признаков кератопатии необходмо профилактическое применение антибиотиков. Учитывая резкое снижение чувствительности роговицы у больных с ЭО и тенденцию к быстрому переход кератопатии в язву роговицы, следует использовать антибактериальные ЛС широкого спектра действия, поскольку сочетание нескольких антибиотиков обеспечивает защиту от широкого спектра возбудителей.
Использование комбинированных ЛС, таких как хлорам-финекол/тетрациклин/колистин, а также ломефлоксацина более эффективно при язве роговицы, развившейся на фоне отечного экзофтальма. Кроме того, при язвах роговицы эффективно применение 0,3% раствора офлоксацина:
Ломефлоксацин в конъюнктивальный мешок по 1 капле 1 —3 р/сут, до достижения клинического улучшения или Офлоксацин, 0,3% р-р, в конъюнктивальный мешок по 1 капле 1—3 р/сут, до достижения клинического улучшения или Хлорамфеникол/колистиметат/тетрациклин в конъюнктивальный мешок по 1 капле 1—3 р/сут, до достижения клинического улучшения.
Оценка эффективности лечения
Исчезновение хемоза, уменьшение выраженности экзофтальма, диплопии, улучшение зрительных функций. При ретробульбарном введении ГКС — уменьшение выраженности субъективных жалоб (ослабление чувства напряжения в глазницы, ощущения инородного тела). Выраженность экзофтальма уменьшается, но он никогда не исчезает полностью. Кроме того, может наблюдаться ослабление диплопии.
Дегидратационная терапия
Необходима при отеке периорбитальных тканей, бульбарной конъюнктивы, ретробульбарной клетчатки и диска зрительного нерва (оптическая нейропатия):
Гидрохлоротиазид внутрь 0,025—0,05 г 1 р/сут утром, 2—3 сут, затем перерыв 3 сут, затем 0,025—0,05 г 2—3 р/нед, до достижения клинического улучшения или Фуросемид внутрь 0,04 г 1 р/сут ут¬ром, 2—3 сут, затем перерыв 3 сут, затем 0,025—0,05 г 2—3 р/нед, до достижения клинического улучшения.
Начальная доза и схема приема зависят от величины диуреза, который необходимо проверять до начала и на фоне лечения. По мере уменьшения отека тканей глазницы, нормализации диуреза дозу препаратов уменьшают с последующей полной отменой. При использовании диуретиков на фоне терапии ГКС повышается риск развития гипокалиемии, поэтому его необходимо сочетать с применением препаратов калия, а также употреблением продуктов с высоким содержанием калия (печеный картофель, свекла, морковь, урюк).
Для профилактики развития остеопороза на фоне применения ГКС используют препараты кальция и витамин D (схемы определяются индивидуально с учетом возраста, длительности терапии ГКС и других факторов риска.
См. «Осложнения и побочные эффекты лечения»).
Ошибки и необоснованные назначения
При ЭО недопустимо начинать лечение с использования ГКС в малых дозах, поскольку это удлиняет срок получения терапевтического эффекта и повышает риск развития рецидивов. Кроме того, применение ГКС в малых дозах может приводить к возникновению стероидоустойчивых форм ЭО.
Использование преднизолона прерывистыми курсами (как это иногда рекомендуется в литературе) нецелесообразно, поскольку при таком режиме лечения 20% препарата выводится из организма неизмененным, а период его полувыведения достаточно короток (2—3 ч).
Субконъюнктивальное введение ГКС также неэффективно. По данным S. Gebert (1961), субконъюнктивальное введение ГКС, в частности метилпреднизолона-де-по, оказывает минимальный терапевтический эффект в виде уменьшения гиперемии конъюнктивы.
Осложнения и побочные эффекты лечения
Быстрая отмена ГКС может приводить к развитию синдрома отмены, который характеризуется головной болью, головокружением, общим недомоганием, тошнотой, рвотой и одышкой. Могут появиться миалгии, боли в суставах, ортостатическая гипотония.
При системном применении ГКС может возникать целый ряд осложнений как на фоне лечения (осложнения первого типа), так после его окончания (осложнения второго типа).
Осложнения первого типа возникают при кратковременном приеме препарата. К ним относятся тошнота, рвота, брадикардия, аритмия, артериальная гипотония вплоть до коллапса и остановки сердца.
Осложнения второго типа развиваются при длительной терапии ГКС. К ним относятся артериальная гипотония, застойная сердечная недостаточность, повышение свертываемости крови, нарушение водного и электролитного баланса, отрицательный азотистый баланс, гипергликемия и сахарный диабет, общая мышечная слабость, увеличение массы тела, гирсутизм, язвенные поражения желудочно-кишечного тракта, обострение сопутствующих хронических заболеваний и инфекций, депрессия, синдром Кушинга, повышение внутриглазного давления, катаракта, остеопороз и асептический некроз костей.
В последние годы все большее внимание привлекает к себе проблема остеопороза, связанного с использованием ГКС. Нарушение метаболизма в костной ткани представляет собой наиболее часто возникающее осложнение, связанное с применением ГКС в высоких дозах. Под воздействием ГКС нарушаются минеральная плотность костной ткани и ее качество. Увеличение костной резорбции связывают с ухудшением абсорбции кальция в кишечнике и увеличением его выделения почками.
В течение первых 6—12 мес терапии ГКС потеря костной ткани может составлять 3—27%. Считается, что этот патологический процесс может развиваться одинаково часто в любом возрасте как у женщин, так и у мужчин. Однако у женщин в постменопаузе риск развития остеопороза и переломов костей возрастает. Чаще поражается позвоночник, большой вертел и длинные трубчатые кости.
Морфологические признаки перелома позвонков выявляются в течение первого года у 15% больных, принимавших ГКС в средней дозе 10 мг/сут.
К факторам риска развития остеопороза относятся:
- детский и пожилой возраст;
- постменопауза;
- небольшая масса тела;
- курение и злоупотребление алкоголем;
- злоупотребление кофеином;
- малоподвижный образ жизни;
- избыточные физические нагрузки;
- недостаточное употребление продуктов, содержащих кальций и витамин D.
Для профилактики осложнений, связанных с терапией ГКС, необходимо использовать препараты кальция (кальций D3 или витрум кальциум/витамин D3 по 1000 мг/сут) в сочетании с витамином D (по 400—800 МЕ), рекомендовать больным употреблять продукты, богатые кальцием и витамином D, а также с низким содержанием фосфатов, натрия хлорида и пищевых волокон.
Необходимо рекомендовать устранение таких факторов риска, как курение, употребление алкоголя и кофеина, тяжелую физическую нагрузку. Женщинам в постменопаузе необходима консультация гинеколога для решения вопроса о заместительной гормональной терапии или терапии кальцитонином лосося.
Использование последнего рассматривают как альтернативу заместительной гормональной терапии, поскольку он уменьшает костную резорбцию и стимулирует костеобразование. На фоне применения препарата минеральная плотность костной ткани возрастает на 1,5— 7,6%, за счет чего снижается риск возникновения переломов костей. Частота развития и тяжесть осложнений возрастают с увеличением длительности терапии ГКС в высоких дозах; наиболее часто осложнения возникают при длительном приеме преднизолона. Именно поэтому необходим постоянный врачебный контроль за состоянием больных, получающих амбулаторное лечение.
При появлении признаков, свидетельствующих о развитии остеопороза, необходимо как можно более раннее изменение схемы лечения или его отмена. Немаловажное значение имеет взаимодействие ГКС с другими ЛС. В частности, эффективность терапии ГКС уменьшается при одновременном использовании барбитуратов, рифампицина; применение гормональных контрацептивов, напротив, усиливает действие ГКС. Прием ГКС ухудшает переносимость диуретиков, снижает эффективность использования гипотензивных ЛС.
Ретробульбарное введение ГКС может сопровождаться возникновением ретробульбарных гематом, перфорацией склеры, повреждением зрительного нерва, окклюзией сосудов сетчатки, появлением стойкого мидриаза, параличом экстраокулярных мышц, контралатеральным амаврозом, нарушением сердечного ритма, остановкой дыхания. Частое и быстрое введение лекарственного раствора в ретробульбарное пространство может приводить к дополнительной механической травме пораженной мышцы.
Прогноз
Нормализация положения глаза в глазнице и восстановление функций экстраокулярных мышц возможны при начале лечения в ранней стадии ЭО. Пульс-терапия с использованием метилпреднизолона представляет собой альтернативу декомпрессионным операциям на глазницы.
Даже при условии проведения адекватной терапии ГКС высок риск развития рецидивов. По данным многих авторов, вероятность получения удовлетворительной ответной реакции на лечение составляет около 50%. К факторам, влияющим на эффективность лечения, относятся степень компенсации функции ЩЖ, выраженность и длительность заболевания, использующиеся дозы препаратов и способы их введения.
Наименее эффективно лечение при компенсированных формах отечного экзофтальма и особенно при длительном течении ЭО, сопровождающемся развитием фиброза экстраокулярных мышц и клетчатки глазницы. Эффективность лечения тем выше, чем тяжелее течение и больше длительность заболевания; при тяжелых формах, кратком анамнезе заболевания (менее 11 мес) и использовании ГКС в высоких дозах удается достичь удовлетворительного терапевтического эффекта у 60—73% больных.
Длительная терапия обеспечивает достаточно стойкий положительный эффект практически у всех больных при декомпенсированной форме ЭО и у 73% больных в стадии субкомпенсации.
Пульс-терапия позволяет достичь положительного эффекта у 88% больных. Особенно отчетливо он проявляется при оптической нейропатии, когда уже после первой инъекции появляются признаки повышения остроты зрения.
По данным, полученным в нашей клинике, у 46 больных с декомпенсированным отечным экзофтальмом и оптической нейропатией удалось добиться стойкого повышения остроты зрения со светоощущения до 0,6—0,8. Наряду с улучшением функциональных показателей уменьшается выраженность экзофтальма и диплопии.
Результаты ультразвукового сканирования, компьютерной и магнитно-резонансной томографии подтверждают уменьшение толщины экстраокулярных мышц и выраженности отека клетчатки глазницы после лечения, а позитивная сцинтиграфия при исследовании глазницы с октреотидом указывает на уменьшение объема ее мягких тканей.
По мнению S. Mori и соавт. (1995), высокий уровень тиреоидстимулирующих антител, обнаруживаемых в сыворотке крови больных до лечения, следует расценивать как благоприятный прогностический фактор, подтверждающий целесообразность использования ГКС. Вероятность эффективности лечения увеличивается при устранении общего для ЩЖ и тканей глазницы антигена.


Комментариев 0