Регенерация фотопотенциала на фоторецепторном диске (Часть 2)

Описание
Существенны ли протонирование родопсина и генерация фотопотенциала для его взаимодействия с трансдуцином?В ходе фотолиза родопсина на стадии образования метародопсина II происходит взаимодействие этого продукта с трансдуцином. Реакция связывания трансдуцина с метародопсином II является первой запускающей реакцией ферментативного каскада, завершающего падением концентрации цГМФ - предполагаемого внутриклеточного медиатора в фоторецепторной клетке.
В экспериментах, посвященных исследованию фотоиндуци-рованного поглощения протона фоторецепторными дисками, было подтверждено предположение о существовании нескольких изохронных форм метароцопсина II и было показано, что протонируется более поздняя форма В связи с этим представлялось весьма важным выяснить, какая из форм метародопсина II - более ранняя, непротонированная или более поздняя, протонированная - образует комплекс с трансдуцином.
Для того чтобы ответить на этот вопрос, мы исследовали взаимодействие родопсина с трансдуцином в присутствии гидроксиламина, поскольку в наших экспериментах было показано, что реакция фотоактивированного родопсина с гидроксиламином предотвращает образование поздней, протонированной формы метародопсина II. Как известно, трансдуцин является водорастворимым белком НСП и легко экстрагируется растворами с низкой ионной силой. Такая обработка НСП приводит к лизису цитоплазматической мембраны НСП и экстракции целого ряда водорастворимых белков, локализованных в наружной мембране НСП и цитоплазме. Последующее центрифугирование суспензии НСП в растворе с низкой ионной силой позволят выделить две фракции: осадок чистых фоторецепторных дисков и на достаточную жидкость, содержащуюся в числе других водорастворимых белков и трансдуцин. Дальнейшее фракционирование белков надосадочной жидкости позволяет выделить чистый трансдуцин. Характер взаимодействия фото-активирозанного родопсина с трансдуцином одинаков как в нативных НСП, так и в суспензии фоторецепторных дисков, к которым добавлен очищенный трансдуцин.
Кинетику взаимодействия трансдуцина с родопсином исследовали методом импульсного фотолиза, регистрируя изменения светорассеяния в образцах. Увеличение светорассеяния, происходящее в процессе взаимодействия родопсина с трансдуцином, объясняют изменением коэффициента преломления фоторецепторных дисков в ходе связывания двух белков, сопровождаемого сдвигом центра тяжести молекулы родопсина на 1А по направлению к внешней поверхности диска, что приводит к кажущемуся утолщению мембраны. Напротив, уменьшение светорассеяния объясняют распадом комплекса родопсина с трансдуцином, что приводит к уменьшению коэффициента преломления дисков и незначительному его увеличению во внешней среде за счет диссоциировавшего трансдуцина.
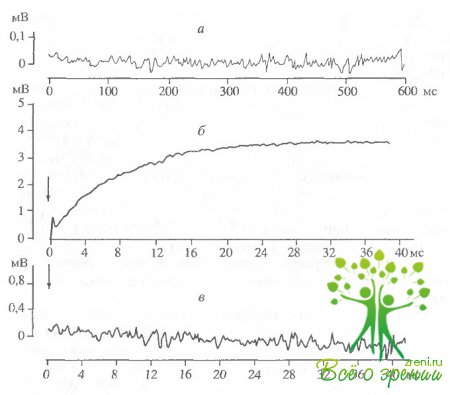
Экспериментальным доказательством прямой связи изменений светорассеяния с образованием комплекса родопсина с трансдуцином является, во-первых, тот факт, что в отсутствие трансдуцина изменений светорассеяния не происходит.; во-вторых, при соотношении трансдуцин/родопсин. равном 1 : 10, соответствующем этому соотношению m vivo, обесцвечивание около 10% родопсина вызывает "насыщение" сигнала "связывания1: при последующих вспышках амплитуда сигнала не изменяется, т.е. связывание в комплекс всего имеющегося трансдуцина приводит к изменению светорассеяния. В наших экспериментах при освещении отмытых от трансдуцина фоторе-цепторных дисков сетчатки глаза быка изменений светорассеяния также не происходит (рис. 2.14, а). Добавление к аналогичному темновому образцу суспензии экстракта водорастворимых белков НСП, содержащих трансдуцин, и последующее освещение препаиата вызывали увеличение светорассеяния (рис. 2.14, б).
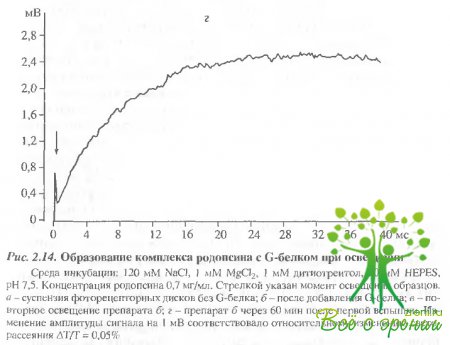
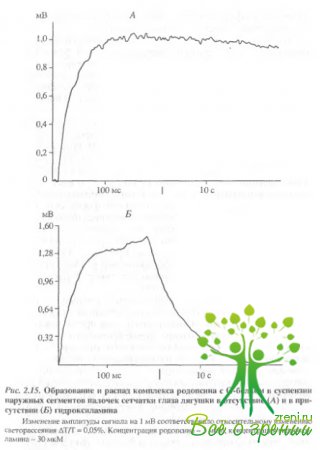
Время нарастания полумаксимальной амплитуды сигнала светорассеяния (t1/2) при обесцвечивании 6-8% родопсина в образце составило около 5 мс (см. рис. 2.14, б). При повторном освещении препарата никаких изменений светорассеяния не происходило, что свидетельствует о связывании всего имеющегося трансдуцина с родопсином (рис. 2.14, в). Если же препарат выдерживали в течение часа в темноте, то при последующем освещении снова наблюдали увеличение светорассеяния (рис. 2.14, г) в результате связывания освободившегося из комплекса трансдуцина с новыми фотоактивирозанными молекулами родопсина. Сходные результаты были получены при исследовании суспензии НСП сетчаток лягушек, Освещение также вызывало увеличение светорассеяния. Время нарастания полумаксимальной амплитуды сигнала составило около 9 мс (рис. 2.15), что по порядку величины совпадает с данными других авторов.
Образование комплекса фотоактивированного родопсина с трансдуцином в присутствии гидроксиламина исследовали в образцах суспензии сетчаток лягушек. Раствор гидроксиламина (pH 7,5) добавляли в кювету с образцом перец освещением. Освещение такого образца вызывало появление сигнала "связывания"' (увеличения светорассеяния). Время достижения полумаксимума составляло 11 мс. Однако если в образцах без гидроксиламина за время регистрации (10 с) практически не происходило изменения амплитуды сигнала после достижения максимального уровня, то в опытах с гидроксиламином уже через 100 мс после вспышки света начиналось падение амллитуды. В течение 10 с происходил спад амплитуды сигнала "связывания" до исходного, темнового уровня. Повторное освещение такого образца снова приводило к увеличению и достаточно быстрому падению амплитуды сигнала, причем, с каждой последующей вспышкой максимальная амплитуда сигнала падала Сигнал исчезал после полного обесцвечивания родопсина в образце. Таким образом, гидроксиламин не влияет на скорость образования комплекса трансдуцина с фотоактивированным родопсином, однако значительно сокращает время его существования.
Это свидетельствует о том, что трансдуцин, очевидно, взаимодействует с более ранней, непротонированной формой мета-родопсина II. Переход этого продукта в присутствии гидроксиламина в ретинальоксим и опсин способствует распаду комплекса, после чего свободный трансдуцин может вновь реагировать с вновь образующимися молекулами метародопсина II при повторной фотоактивации.
Как известно, ключевым этапом трансформации светового сигнала в электрический ответ фоторецепторной клетки является образование метародопсина И. Именно на этой стадии фотолиза зрительного пигмента происходят максимальные изменения в структуре белка. Происходит ли на этой стадии трансмембранный перенос протона так, как это имеет место в другом ретинальсодержащем белке бактериородопсине? Наши косвенные эксперименты с протонным ионофором свидетельствуют об отсутствии трансмембранного переноса протона: 2,4-ди-нитрофенол не влиял на фотоиндуцированное поглощение Н+ фоторецепторными дисками. Аналогичные результаты были получены при исследовании влияния на протонирование грамицидина и нигерицина, NH4Cl и карбонилцианил р-трифлуорометок-сифенилгидразона, также ускоряющих перенос Н+ через мембрану.
В описанных выше экспериментах была предпринята попытка оценить изменения рН внутри диска, используя суспензию инвертированных дисков. Действительно, если предположить, что имеет место трансмембранный перенос протона, то в случае нормально ориентированных дисков следовало бы ожидать подщелачивания среды, а в случае инвертированных дисков - ее подкисления. В наших экспериментах не удалось получить суспензию, содержащую только инвертированные диски, однако анализ экспериментальных данных позволяет заключить, что в ходе фотолиза родопсина трансмембранный перенос протона в фоторепепторном диске не происходит.
Интересно провести сравнение зрительного пигмента родопсина с другим ретиналь-содержащим белком - бактериородопсином. Этот белок был впервые обнаружен в мембранах пурпурных бактерий Halobactermm halobium. Основной его функцией в этих бактериях является преобргзование энергии света в энергию синтеза АТФ. Зрительный пигмент родопсин и бактериородопсин обнаруживают много сходных свойств: оба являются интегральными мембранными белками и имеют близкие молекулярные веса (39 и 26 кДА соответственно). Аминокислотные последовательности некоторых участков полипептидных цепей совпадают. В обоих случаях структуры белков представляют собой семь ?-спиральных столбов, пронизывающих мембрану. Хромофор обоих пигментов - ретиналь - образует альдиминную связь (Шиффово основание) с е-аминогруппой лизина, локализованного ближе к С-концевому участку полипептидной цепи. В обоих случаях первой и основной фотохимической реакцией является цистранс переход ретиналя.
Поглощение света молекулой зрительного и бактериального родопсина приводит сначала к небольшому батохромному сдвигу - образованию продуктов с ?макс = 543 нм и ?макс = 610 нм (батопродукты зрительного и бактериального родопсинов соответственно), а затем - к значительному (около 100 нм) гипсохромному сдвигу с образованием метародопсина II с ?макс = 380 нм (в случае зрительного родопсина) и М4П с ?макс = 412 нм (в случае бактериородопсина). Метародопсин II и М412образуются в миллисекундой временной шкале и являются долгоживущими продуктами фотолиза. Фотолиз обоих пигментов приводит к генерации разности потенциалов на мембране, причем, постоянные времени нарастания этих потенциалов близки.
Образование метародопсина II и М412 сопровождается поглощением протона из внешней среды. С другой стороны, при сравнении зрительного и бактериального родопсинов можно обнаружить очень существенные различия и прежде всего функциональные. Действительно, основной функцией бактерпородопсина, как уже отмечалось, является преобразование энергии света в энергию синтеза АТФ. В случае зрительного родопсина квант света является лишь информационным сигналом, при этом его энергия в процессе фототрансдукции, по современным представлениям, не запасается. Свет лишь запускает последующий каскад реакций, что приводит к возникновению гиперполяризационного потенциала, создаваемого изменением натриевого тока через наружную, цитоплазматическую мембрану палочки.
В основе функционирования бактериородопсина лежит создание на мембране электрохимического протонного потенциала, а в основе работы зрительной клетки - каскад феоментативных и ионных процессов, запускаемых светом. Как показано в настоящей работе, освещение не приводит к возникновению протонного градиента на фоторецепторной мембране.
Таким образом, при анализе свойств обоих пигментов оказывается, что основные сходные черты обусловлены одинаковыми физико-химическими и прежде всего фотохимическими свойствами молекул, а именно фотоиндуцированным цис-транс-переходом ретиналя. Следствием этой реакции является возникновение разности потенциалов на мембране. Однако если ь бактериальной мембране этот процесс сопровождается еще и переносом протона через мембрану, что важно для функционирования всей клетки, то в зрительной клетке, где энергия света не запасается в виде АТФ, такой перенос отсутствует. Именно с этого момента функциональные пути бактериального и зрительного родопсина расходятся. Таким образом, в цепи последовательных фотоинду-цированных реакций отсутствие трансмембранного переноса протона в зрительной клетке является первой принципиальной чертей, отличающей зрительный родопсин от бактериального.
Как известно, функционально наиболее важной стадией фотолиза является образование метародопсина II В связи с этим интересно выяснить, какова последовательность событий, которые происходят в той же временной шкале, что и физиологический ответ фоторецептора. И прежде всего необходимо рассмотреть процессы, непосредственно связанные с существованием метародопсина II. Одной из таких реакций является поглощение протона из внешней среды.
В наших экспериментах с гидроксиламином было показано, что поглощение протона ограничено временем жизни метародопсина II. Известно, что взаимодействие гидроксиламина с мета- родопсином II приводит к быстрому образованию ретинальоксима, т.е. к сокращению времени жизни метародопсина П. Б присутствии избытка гидроксиламинамы не наблюдали поглощения протона. Кроме того, исследования кинетики образования метародопсина II и протонирования методом импульсного фотолиза показали, что время образования метародопсина II составляет около 2 мс, что значительно короче времени протонирования родопсина (около 30 мс).
Таким образом, наши результаты подтверждают представление о существовании двух форм метародопсина II - непротснированной и протонированной. В ходе фотолиза родопсина сначала образуется непротони-рованная форма, а затем - изохромный ей протонированный продукт. Этот вывод подтверждается также несовпадением рН-зави- симостей образования метародопсина II и поглощения протона.
Термальный распад метародопсина II завершается гидоолизом альдиминной связи хромофора с опсином и образованием свободных продуктов - полностью-транс-ретиналя и опсина непосредственно из метародопсина III. Как было указано выше, освещение метародопсина II в максимуме его поглощения позволяет быстро перевести метародопсин II в фотопродукт Р460. При этом в мембране происходит ряд обратных изменений. Так, фотопотенциал, регистрируемый на фоторецепторной мембране, изменяет полярность. Аналогичное изменение трансмембранного потенциала наблюдается при действии синего света на продукт фотолиза бактериородопсина М412. Термальный распад метародопсина II и фотоиндуцированное образование Р460сопровождается уменьшением конформационной подвижности гидрофильных, экспонированных во внешнюю среду, участков полипептидной цепи родопсина, тогда как образование метародопсина II - ее увеличением.
Известно, что при термальном распаде метародопсина II происходит медленное высвобождение протона во внешнюю среду Как было показано в настоящей работе, образование Р460также сопровождается освобождением протона, однако в этом случае депротонирование метародопсина II происходит быстро. Можно предположить, что поглощение Н+ из внешней среды и его высвобождение из мембраны ЯВЛЯЮТСЯ следствием изменения конформационного состояния молекулы родопсина и, в частности, ее гидрофильных участков. Переход к развернутой конформации при образовании метародопсина II сопровождается его протонированием. С другой стороны, образование продуктов Р46с и метародопсина III, спектрально близких более раннем) продукту фотолиза метародопсину I, соответствует обратному переходу к более стабильной, исходной конформации и сопровождается высвобождением протона, Как уже указывалось, фотолиз родопсина приводит к генерации разности потенциалов на фоторецепторной мембране. Время нарастания фотопотенциала - 10 мс, что в несколько раз больше времени образования непротонированной формы метародопсина II, но существенно меньше, чем время образования протонированного метародопсина II.
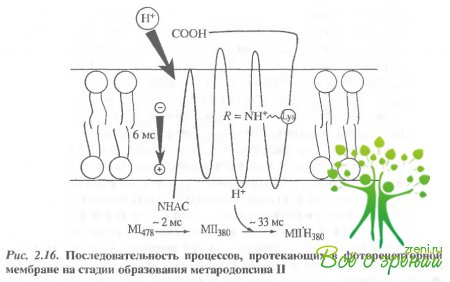
Таким образом, три процесса образование метародопсина II, генерация фотопотенциала и поглощение протона происходят в том же временном диапазоне, что и развитие физиологического ответа фоторецепторной клетки. Для понимания функциональной роли этих процессов важно представлять себе их последовательность Схематично процессы, происходящие в фоторецепторной мембране на стадии образования и за время жизни метародопсина II, изображены на рис. 2 16. Поглощение света и изомеризация ретиналя приводят в ходе фотолиза родопсина к образованию метародопсина II, который сначала находится в непротонированной форме (МП).
Затем происходят разделение зарядов в гидрофобной области белковой части молекулы, ее поляризация. Возникает разность потенциалов на фоторецепторной мембране со знаком плюс внутри диска и минус на внешней поверхности дисковои мембраны. Практически одновременно с разделением зарядов происходят конформационные изменения в белковой части молекулы родопсина. Вследствие этих изменений в гидрофильной области опсина высвобождаются отрицательно заряженные группы: метародопсин II переходит в новое конформационное состояние (МІІ). В этом состоянии МП протонируется с образованием протонированной формы метародопсина II - МП Н+. По-видимому, процесс протонирочания ограничивается нейтрализацией заряженных групп у внешней поверхности мембраны, и дальнейшей транслокации протона не происходит. Если бы такой перенос протона происходил, это привело бы к изменению кинетических характеристик фотопотенцкала, регистрируемого на дисковой мембране, и появлению компоненты с временем нарастания около 30 мс. Однако такая компонента в фотопотенциале отсутствует (время нарастания фотопотенциала составляют 10 мс, а спада - до секунды). Дальнейшие превращения молекулы МІІ Н+ приводят к образованию конформации, близкой к исходной, и эти "медленные" изменения сопровождаются высвобождением протона во внешнюю среду. По-видимому, в поглощении и высвобождении протона участвуют одни и те же аминокислотные остатки, а сам этот процесс, вероятно, является лишь сопутствующей реакцией и самостоятельной роли в функционировании фоторецепторной мембраны не играет.
Образование комплекса фотоактивированного родопсина с транслуцином также связано с ключевой стадией трансдукции - образованием метародопсина II. До появления этого продукта трансдуцин находится в свободном состоянии и не взаимодействует с более ранними продуктами фотолиза родопсина.
Активатором трансдуцина является уже образовавшийся метародопсин II. В цепи рассмотренных выше реакций, сопряженных с существованием этого продукта фотолиза (генерация трансмембранного фотопотенциала, конформационные изменения белковой части молекулы, поглощение протона из среды), связывание трансдуцина происходит, по видимому, параллельно с конформационными изменениями, затрагивающими гидрофильный С-кониевой участок опсина, после генерации фотопотенциала, но несколько раньше протонирования Начальная, быстрая фаза связывания трансдуцина лежит в 10-миллисекундном временном диапазоне и несколько отстает от начальной фазы образования метародопсина II. К такому же выводу приходят авторы, параллельно исследовавшие кинетику образования метародопсина II и связывания трансдуцина.
Образовавшийся комплекс трансдуцина с метародопсином II существует достаточно долго в отсутствие ГГФ. Было высказано предположение, что в отсутствие ГТФ при обесцвечивании менее 10% родопсина образование комплекса стабилизирует метародопсин II и ускоряет время распада метародопсина III.
С другой стороны, сокращение времени жизни метаоодопсина II с помощью гидроксиламина сокращает и время существования комплекса Эти результаты совпадают с результатами исследований Хофманна с соавторами, которые показали, то присутствие 1 мМ гидроксиламина в 5 раз ускоряет распад комплекса трансдуцина с метародопсином II. Однако результаты пашей работы позволяют более точно определить, с какой формой метародопсина II взаимодействует трансдуцин. Действительно, в экспериментах по исследованию фотоиндуци-рованного поглощения протона в присутствии гидроксиламина протониоования метародопсина II не происходило. Этот эффект является следствием того, что гидроксиламин взаимодействует с более ранней, непротонированной формой метародопсина II (МІІ), и образования формы МІІ', способной связывать протон, не происходит. С другой стороны, на постоянную времени образования комплекса метародопсина II с трансдуцином гидроксиламин не влияет, а лишь сокращает время его жизни Это однозначно свидетельствует о том, что МП не является необходимым для взаимодействия тралсдуцина с фотоактивированнь.м родопсином. Активатором трансдуцина является более ранняя, непрото- нированная форма метародопсин II.
Сравнение проводимости диска и плазматической мембраны фоторецептора
Долгое время при исследовании механизмов фототрансдукции доминировала кальциевая гипотеза, предполагавшая, что диски внутри зрительной клетки являются своеобразными депо - структурами, аккумулирзющими ионы кальция подобно сарко-плазматическому ретикулуму. Сейчас можно считать твердо установленным, что кальций в фоторецепторной клетке не играет той роли, которая предполагалась этой гипотезой. Напротив, концентрация ионов кальция при освещении не увеличивается, а уменьшается. Кальций действует не как ингибитор ионных каналов на плазматической мембране клетки, а как регулятор активности гуанилатциклазы и, возможно, других ферментов цикла фототрансдукции. Роль же дисков как замкнутых структур остается неясной. Есть данные, что они могут тем не менее играть роль кальциевого депо, выполняя функцию кальциевого буфера и связывают цГМФ. Показано также, что проводимость дисковой мембраны зависит от цГМФ. В связи с этим представляется интересным исследовать электрические свойства дисковой мембраны и, в частности, проводимость.
Как известно, фоторецепторные диски образуются из плаз-матической мембраны в результате ее инвагинации в базальной части наружного сегмента палочки. Поэтому, казалось бы, структура, состав и функциональные свойства этих мембран не должны были бы различаться. Вместе с тем складывается впечатление, что различия между ними весьма существенны. Биохимия фоторецепторной мембраны диска изучена довольно подробно. Однако получить фракцию цитоплазматических мембран в количестве, достаточном для биохимических исследований, практически невозможно. Помимо родопсина, она содержит фосфорилируемые белки, которых, по-видимому, нет в мембране диска.
В то же время накоплена обширная информация об электрических свойствах плазматической мембраны наружного сегмента. С другой стороны, электрофизиологические исследования фоторецепторной мембраны диска при помощи обычных методов невозможны, поскольку его размеры слишком малы и лежат за пределами разрешения светового микроскопа. По той же причине нельзя использовать метод пэтч-кламп.
Хорошую возможность для исследования проводимости дисков дал метод их встраивания в пропитанный липидами мембранный фильтр, использованный нами для исследования фотопотенциалов и подробно описанный в предыдущей главе. При этом сам фотопотенциал является своеобразным толчком тока, по которому и можно измерить сопротивление дисковой мембраны. То, что оно значительно больше, чем сопротивление плазматической мембраны, следует уже из модельных экспериментов, описанных ранее. Сильное шунтирование измерительной мембраны делало этот потенциал похожим на РРП, т.е. приближало дисковую мембрану по своим характеристикам к плазматической. В данном разделе в продолжение этой работы мы измеряли проводимость обеих мембран в одинаковых условиях, т.е. используя метод встраивания дисков.
На рис. 2.2 представлен фотопотенциал, возникающий в ответ на короткую вспышку, на мембранном фильтре, в который встроены фоторецепторные диски. Регистрируемый фотоответ, как было показано ранее, той же природы, что и ранний рецепторный потенциал, который отводится от плазматической мембраны. Постоянная времени нарастания фотоответа составляет порядка 10 мс и соответствует кинетике перехода метародопсина 1 в метародопсин II. Следует обратить внимание на крайне медленный спад фотопотенциала, который происходит в секундной шкале. Если принять емкость мембраны диска равной 1 мкФ/см, оказывается, что сопротивление мембраны диска очень велико.
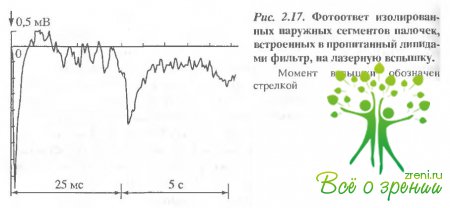
В следующей серии экспериментов пропитанный липидами мембранный фильтр модифицировали интактными НСП. В этом случае в ответ на такую же вспышку света регистрируется более сложный фотоответ, быстрый (миллиеекундный) компонент которого по временным параметрам соответствует раннему рецепторному потенциалу (рис. 2.17). Второй, гораздо более медленный компонент фотоответа с характерным временем порядка 1 с может быть интерпретирован как ПРП.
В отличие от быстрого, медленный компонент может быть зарегистрирован лишь в первые 10 мин после приготовления препарата. Это примерно соответствует времени выравнивания ионных градиентов на плазматической мембране при блокировании Nа+/К+ -АТФазы фоторецепторной клетки оуабаином. Насыщается медленный компонент при значительно меньших энергиях вспышки, чем быстрый.
Как по характерным временам, так и по полярности быстрый компонент фотоответа, представленный на рис. 2.17, может быть интерпретирован как РРП, регистрируемый при обычных элект-рофизиологических условиях отведения от наружного сегмента палочки.
Для плазматической мембраны фоторецепторной клетки время спада составляет 5 мс и совпадает с характерным временем спада для РРП, регистрируемого внутриклегочно Такое совпадение свидетельствует о том, что постоянная спада определяется именно RС биологической мембраны, сорбированной на фильтре, а не переходными процессами на мембранном фильтре. Удельное сопротивление плазматической мембраны фоторецептора в темноте, когда все Na+ -каналы открыты, составляет 3 кОм/см. Если считать удельные емкости фоторецепторной и плазматической мембран одинаковыми и равными примерно 1 мкФ/см, то вычисленная, исходя из времени спада, величина удельного сопротивления мембраны диска составляет 1-2 мОм/см2.
Таким образом можно полагать, что величина удельного сопротивления мембраны диска составляет 1-2 мОм/см2. Интересно отметить, что это значение совпадает с сопротивлением плазматической мембраны в условиях действия насыщающего света, когда все светочувствительные каналы закрыты. Поскольку в настоящее время считается, что в плазматической мембране фоторецептора существует только один тип проводимости, а именно регулируемая светом натриевая проводимость, исходя из наших данных, можно полагать, что в мембране фоторецепторного диска палочки отсутствуют какие-либо ионные каналы. Если принять, исходя из общепринятых представлений о морфогенезе дискоз, что свойства плазматической и дисковой мембран одинаковы, то обнаруженное нами отсутствие канальных структур в дисковой мембране представляется удивительным. Наличие в мембране диска хотя бы одного канала с проводимостью 1 пОм, с учетом диаметра диска около I мкм и удельной емкости мембраны 1 мкФ/см, давало бы постоянную времени спада около 1 мс, что на три порядка меньше реального параметра. Поэтому можно полагать, что ионные каналы либо утрачиваются в процессе формирования диска из плазматической мембраны, либо встраиваются в плазматическую мембрану уже после отделения дисков. Возможно также, что, вопреки существующим представлениям, дисковая мембрана происходит не из плазматической мембраны, а образуется в базальной части наружного сегмента независимо от нее.
Более поздние работы отчасти подтвердили вывод, сделанный нами. Так, в работе гистохимически показано, что цГМФ-регулируемые каналы локализованы только в плазматической мембране фоторецептора. Проводимость фото-рецепторной мембраны диска соизмерима с проводимостью сопрягающих мембран митохондрий, хлоропластов, пурпурной (содержащей бактериородопсин) мембраны галобактерий. Столь низкая проводимость перечисленных мембран имеет функциональный смысл. Это необходимо для поддержания на них трансмембранного градиента Н+. Однако в случае фоторецепторной мембраны функциональная роль столь низкой проводимости остается неясной.
Крайне незначительное при физиологических условиях освещения увеличение ионной проницаемости мембраны диска, в частности, для ионов кальция, также указывает на отсутствие в ней ионных каналов. Это предположение подтверждают также результаты наших экспериментов по исследованию влияния цГМФ и SH-реагентов на проводимость обеих мембран. Концентрация цГМФ, при которой открываются все ионные каналы ь плазматической мембране фоторецептора, вызывает лишь незначительное изменение проводимости мембраны диска, хотя при наличии в мембране диска цГМФ-регулируемых каналов проводимость изменилась бы на 2-3 порядка.
[banner_centerrs] {banner_centerrs} [/banner_centerrs]
Статья из книги: Молекулярные механизмы зрительной рецепции | Каламкаров Г.Р., Островский М.А..


Комментариев 0