Взаимодействие родопсина с цитоплазматическими белками (трансдуцином и ареатином) в фоторецепторной клетке (ЧАСТЬ 1)
Содержание:
Описание
В предыдущей главе мы рассматривали фотоэлектрические процессы, происходящие в молекуле родопсина и фоторецепторной мембране. Основным следствием этих процессов являются такие изменения в молекуле зрительного пигмента, которые приводят к его взаимодействию со специфическим трансдуцином на этапе активации, фосфорилированию и связыванию с арестином на этапе инактивации. Активация трансдуцина достигается при его взаимодействии с активированным родопсином и обмене в связанном состоянии ГТФ на ГДФ. Затем комплекс диссоциирует и активирует фосфодиэстеразу путем замещения ее ишибиторной субъединицы. Трансдуцин обладает ГТФазной активностью, и гидролиз ГТФ возвращает молекулу в исходное состояние.
Предполагается, что арестин играет важную роль в процессе инактивации родопсина. У стан эвлено, что инактивация фосфодиэстеразы ускоряется в его присутствии. Есть две точки зрения на механизм этого процесса. Первая предполагает, что арестин связывается с обесцвеченным и фосфорилированным родопсином и таким образом занимает место связывания трансдуцина. С другой стороны, есть данные, что арестин прямо действует на фосфодиэстеразу, ингибируя ее активацию трансдуцином. Согласно этой последней схеме, необходимо, чтобы арестин связался с обесцвеченным родопсином и при этом активировался. Для такой активации, согласно этой схеме, необходима одна молекула АТФ, а фосфорилирование родопсина не является обязательным.
В настоящей главе нами были рассмотрены следующие вопросы: (1) какие изменения, происходящие в молекуле родопсина при его переходе в метародопсин II, существенны для его связывания с трансдуцином; (2) где локализовано место связывания трансдуцина и арестина на молекуле родопсина и есть ли это один и тот же центр; (3) какие изменения в конформации молекулы вызывает фосфорилирование родопсина и насколько эти изменения могут преплтствовать связыванию с трансдуцином. Результаты этих исследований изложены в серии публикаций.
Наиболее адекватным методом для выяснения этих вопросов явилась, по нашему мнению, комбинация ограниченного протеолиза молекулы родопсина в мембране и направленная модификация функциональных групп родопсина в совокупности с методом спиновых меток. Взаимодействие родопсина с периферическими белками исследовалось ранее с помощью светорассеяния, адсорбционной спектроскопии, определение фосфодиэстеразной активности. Взаимодействие родопсина с трансдуцином исследовалось также методом ограниченного протеолиза, модификацией SH-групп, с помощью рекомбинантного родопсина, по переносу энергии флуоресценции, используя пептиды, гомологичные родопсину, антитела на пептиды.
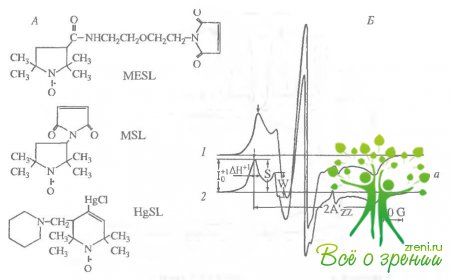
В данном исследовании мы использовали ЭЛР-спектроскопию и спиновые метки, которые являются удобным инструментом для исследования функциональных изменений белках. В настоящей работе использовались три типа спиновых меток, модифицирующих цистеиновые остатки: MSL, MESL, HgSL. Нам удалось селективно пометить цистеиновые остатки, локализованные в разных петлях родопсина, что и позволило выявить их участие в процессах активации и инактивации родопсина.
↑ Модификация родопсина спиновыми метками
Малеи. шдные спиновые метки. Определение мест связывания меток при помощи протеолиза родопсина папаином. С целью избирательного спинмечеьия SH групп родопсина была изучена кинетика связывания MSL, MESL и N-этилг алсимида (НЭМ). Кинетические кривые в условиях реакции псевдопервого порядка описываются суммой трех экспонент с константами скоростей связывания К1= (2,3 ± 1,1) 10-2 с-1 , К2 = (1,55 ± 0,23) • 10-3 с-1 , К3 = (2,36 ± 0,05) 10-3с-1 . Это означает, что в мембране имеются три типа SH-групп (SH-1, SH-2, SH-3), предельные степени модификации которых спиновыми метками составляют соответственно 0,3, 1 и 1 на молекулу родопсина.
Из полученных констант скорости следует, что инкубация мембран НСГТ с меткой в течение 2 мин позволяет модифицировать SН-группы 1-го типа (SН-1). Для того чтобы метками модифицировать SН-2-грзппы, SН-1 -группы модифицировали в течение 2 мин НЭМ, а после отмывания НЭМ препарат инкубировали 13 мин с малеимидной меткой. При этом 75% меток оказывались связанными с SН-2-группами.
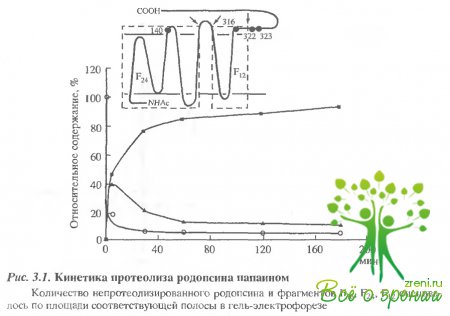
Для модификации метками 8Н-групп 3-го типа (SН-3) препарат инкубировался с НЭМ 25 мин, а затем 50 мин - со спиновой меткой. Место ковалентного связывания этих меток можно определить методом ограниченного протеолиза. Известно, что в результате протеолиза родопсина папаином первоначально отщепляется С-концевой пептид и образуется фрагмент с молекулярной массой 36 кДа (Р36), а затем выщепляется петля между V и VI ?-спиральными тяжами, и образуются два ковалентно не связанных фрагмента с молекулярными массами 24 и 12 кДа (F24и F12). Согласно схеме расположения полипептидной цепи родопсина в мембране, с цитоплазматической стороны родопсина имеются только 4 остатка цистеина Суs-140, Суs-316, Суs-322 и Суs-323, причем, первые два остатка расположены соответственно во фрагментах F24и F12, а два последние - в С-концевом пептиде, причем известно, что они могут образовывать специфический динитрозильный комплекс. На рис. 3.1 представлена кинетика протеолиза роцопсина папаином.
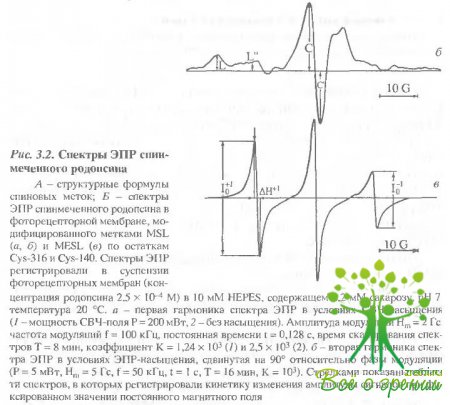
Видно, что через 5 мин протеолиза основным промежуточным продуктом является фрагмент который через 30 мин практически полностью расщепляется на два фрагмента. В ходе протеолиза родопсина, меченного М8Ь или МЕ8Ь, сигнал ЭПР, представленьый на рис. 3.2, сохраняется, хотя фрагмент, содержащий остатки Суs-322 и Суs-323, полностью отщепляется.
Это означает, что МSLи MESLлокализуются в основном в мембран связанных фрагментах F24и F12и связываются с остатками Суs-140 и Суs-316. расположенными в этих фрагментах. Данные по распределению М8Ь по фрагментам протеолитического расщепления родопсина представлены в табл. 3.1 Наиболее реакционноспособные SН-группы 1-го типа, число которых составляет 0,3 моля на моль белка, скорее всего не могут принадлежать основному белку.
Возможно, они принадлежат обесцвеченному родопсину или минорным белкам фоторецепторных мембран. Поэтому в дальнейшем все эксперименты проводились для препаратов, спинмеченных по SН-2 и SН-З -группам, а SН-1 -группы всегда предварительно блокировались НЭМ.
Из сопоставления кинетики связывания MSL с фрагментами F24и F12кинетики модификации SH-2- и SH-3-групп следует, что более реакционноспособная SH-2 группа, по-видимому, расположена во фрагменте F12(Cys-316), а наименее реакционноспособная SH-3-группа - во фрагменте F24(Cys-140). Эти результаты в целом согласуются с данными работы.
Было найдено, что кинетика титрования родопсина MSL при 10-кратном избытке по отношению к родопсину практически совпадает с кинетикой модификации родопсина MESL при 20-кратном избытке.
Поэтому можно считать, что модификация родопсина MSL и MESL происходит одинаково.
Основываясь на изложенных выше результатах, для избирательной модификации различных цистеинов использовались еле дующие схемы.
Схема 1.Мембраны сначала обрабатывались НЭМ (0,3 моль/моль родопсина). Затем отмытые мембраны инкубировались с малеимидной спиновой меткой. При этом 80% меток (MSL или MESL) связывалось с Cys-316 и 20% - Cys-140.
Схема 2.Мембраны обрабатывались НЭМ 15 мин (1,2 мо ля SH-групп на моль родопсина блокировалось), затем мембраны отмывались и обрабатывались спиновой меткой -в течение 60 мин. При этом 40% метки связывалось с Cys-316 и 60% - с Cys-140.
Ртутьорганическая спиновая метка (HgSL). Локализация места связывания метки.При добавлении к суспензии фоторецепторных мембран HgSL в соотношении 2 моля метки на 1 миль белка она менее чем за 2 мин полностью связывается с молекулой родопсина, о чем свидетельствует появление сигнала ЭПР и отсутствие сигнала свободной метки (рис. 3.3,a).
Эксперименты с ограниченным протеолизом показали, что в этом случае метка связывается с С-концевым фрагментом. Действительно, после 5 мин протеолиза родопсина папаином, т.е. при отщеплении С-концевого фрагмента, форма спектра и амплитуды сигналов ЭПР существенно изменяются (рис. 3.3,б): на 80-85% уменьшается интенсивность сильно иммобилизованной компоненты сигнала и резко возрастает вклад слабоиммо-билизованной компоненты. После двукратного отмывания фоторецепторных мембран в большом объеме среды инкубации расторможенная компонента сигнала в спектре ЭПР исчезает, что указывает на отщепление в водную фазу. Таким образом, HgSL, по-видимому, связывается с С-концевыми остатками Cys-322 и Суs-323.
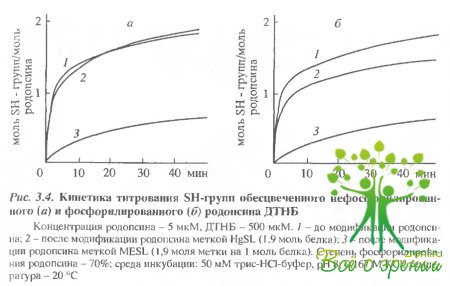
Другим подтверждением того, что HgSLи МSLмодифицируют разные остатки молекулы родопсина, являются результаты исследования кинетики титрования поверхностных SН-групп родопсина дитионитробензойной кислотой (ДТНБ) до и после модификации родопсина спиновыми метками. Как видно из рис. 3.4,а, ДТНБ и МSL модифицируют одни и те же SН-группы после связывания 1,9 моль МЕSL на 1 моль родопсина.
ДТНБ способна модифицировать еще не более 0,4 моль SН-групп на 1 моль белка. В случае же HgSLдостижение степени модификации 1,9 не препятствует последующему взаимодействию родопсина с ДТНБ: этот реагент дополнительно модифицирует 2,0-2.3 остатка цистеина на молекулу белка.
Модификация фосфорилированного родопсина спиновыми метками. Кинетические кривые, описывающие взаимодейстие ДТНБ с SН-группами обесцвеченного фосфорилированного и нефосфорилированного родопсина, практически совпадают (рис. 3.4.б. В обоих случаях общее число SН-групп, доступных ДТНБ, близко как в намеченном белке, так и в родопсине, модифицированном HgSL или МSL. Поэтому можно предположить, что метки, так же как и ДТНБ, одинаковым образом модифицируют тиоловые группы фосфорилированного и нефосфорилированного родопсина, т.е. в обоих случаях MSL и MESL модифицируют остатки Cys-140 и Cys-316, а HgSL - остатки Cys-322 и Cys-323.
↑ Фотоиндуцированные изменения в спектрах ЭПР спинмеченного родопсина
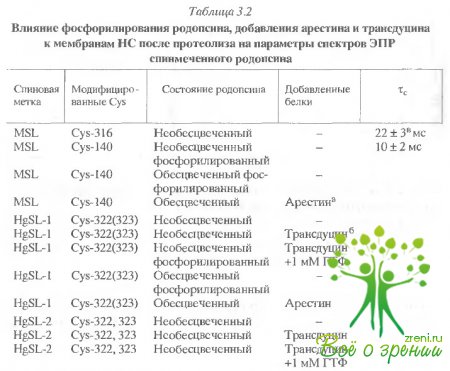
Темноадаптированный родопсин. Как оказалось, параметры спектров ЭПР различаются для меток, связанных с различными цистеинами (Cys-140, Cys-316, Cys-322, 323). Это указывает на различия в структурном окружении этих остатков (табл. 3.2).
Так, при модификации цистеинов по схеме 2 (Cys-316 : Cys- 140 = 43/75) величина фактора насыщения Z+1 и тс значительно ниже, чем в том случае, когда модифицируется преимущественно Cys-316 (Cys-316 : Cys-140 = 78/22). Например, для MESL в первом случае ?c= 0,29 ± 0,03 не, а во втором случае ? = 0,6 ± 0,06 не. Такая же корреляция получена и для MSL. Это означает, что увеличение лабильности метки происходит из-за вклада Cys-140.
Абсолютные значения тс были оценены для MSL при мечении в соответствии со схемами 1 и 2, используя параметры L /I С'/С и Z+1. Величина ?c полученная из L"/L, составила 22 и 10 мкcсоответственно для схем 1 и 2. Величины, полученные из С'/С, были 0,5 и 0,3 мкc, а из Z+1 - 2 и 1 мке соответственно для схем 1 и 2. В дальнейшем для количественных оценок времени вращательной корреляции мы использовали параметр Z+1.?
МеткаHgSL, которая связывается с С-концевым пептидом, сильно иммобилизована на белке, однако параметры сигнала ЭПР зависят от того, одна или две метки связываются с молекулой белка (см. табл. 3.2). В последнем случае фактоэ насыщения Z+I меньше (1,07 ± 0,05 по сравнению с 1,22 ± 0,05), т.е. лабильность метки выше в том случае, когда помечены оба остатка.
Известно, что С-концевой пептид соединен тиоэфирной связью с пальмитиновой кислотой и, следовательно, полная модификация обеих сульфгидрильных групп может приводить к освобождению С-концевого пептида и как следствие - к большей лабильности меток.
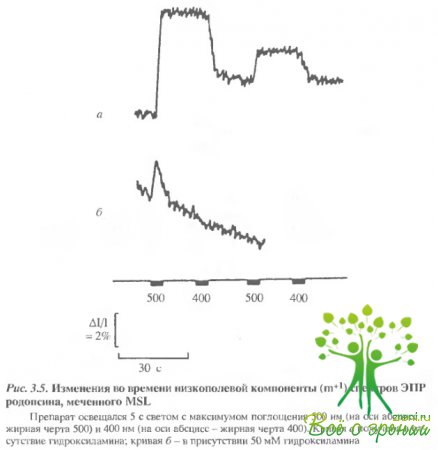
Фотоиндуцированные изменения родопсина. При обычной регистрации фотоиндуцированные изменения в спектрах ЭПР не наблюдаются. Значительные изменения в спектрах, как было показано, наблюдаются при регистрации спектров в условиях СВЧ-насыщения. В этом случае удается наблюдать изменения всех трех типов меток, которые описаны выше. В качестве примера фотоиндуцириванные изменения, полученные таким образом при регистрации спектров метки МSL, представлены на рис. 3.5.
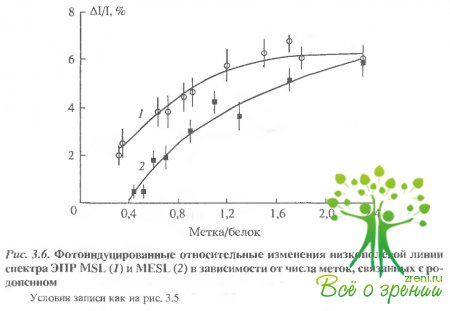
Фотоиндуцированные относительные изменения низкополевой линии спектра ЭПР МSL и МЕSL в зависимости от числа меток, связанных с родопсином, представлены на рис. 3.6. При этом изменения первой низкополевой компоненты для сильно иммобилизованных меток (МSL, HgSL) достигали 10-15% (в отсутствие насыщения- 1-2%).
В основном фотонндуцированные изменения, полученные в условиях СВЧ-насыщения, были следствием уменьшения времени вращательной корреляции и, следовательно, освещение приводит к "освобождению" участка, где расположены метки.
Как отмечалось выше, различные схемы мечения позволяют избирательно пометить различные сульфгидрильные группы. Так, время корреляции для МSL уменьшалось на 24-30% для Суs- 316 и на 21-24% - для Суs-140; при мечении МЕSL - на 7-8%. для СУs-316 и на 12-14% - для Суs-140. Таким образом, можно полагать, что в районе Су8-140 фотоиндуцированные изменения - более выраженные. Фотоиндуцированные изменения метки НgSL, связанной с С-концевым пептидом, по знаку и величине были аналогичны МЕSL и МSL в том случае, когда соотношение родопсина и метки составляло Г1. Однако в том случае, когда оба остатка цистеина (322 и 323) модифицировались меткой, величина эффекта существенно возрастала (от 6 до 17,5%).
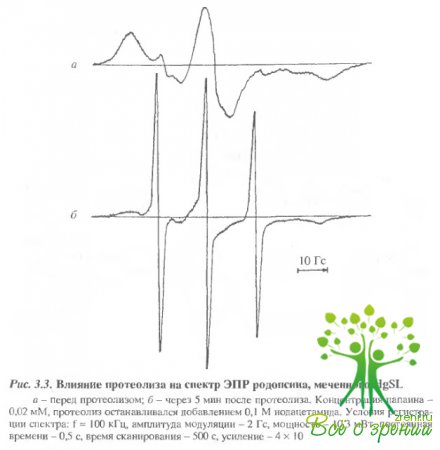
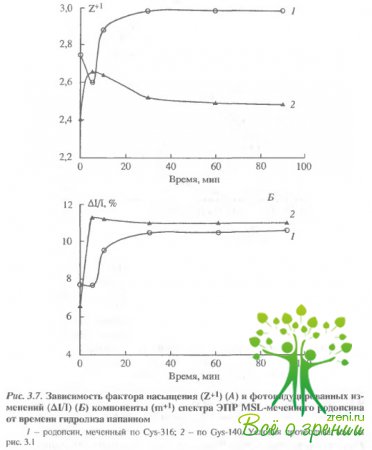
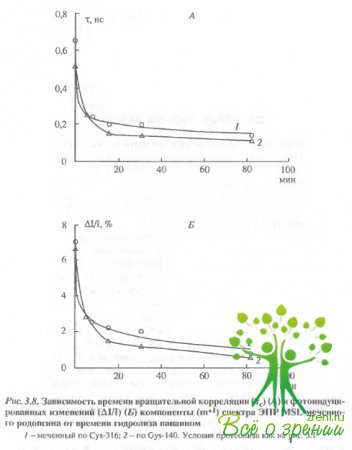
Влияние протеолиза на спектры ЭПР спинмеченного родопсина.Чтобы понять характер изменений в белке при действии света, оказалось полезно сравнить их с изменениями, индуцируемыми при протеолизе белка, т.е. при последовательном удалении его фрагментов и расщеплении полипептидной цепи Известно, что при ограниченном иротеолизе многие свойства белка сохраняются, в частности, не изменяются спектр поглощения и фотолиз родопсина. Как оказалось, ограниченный протеолиз влияет как на темновые характеристики спектров ЭПР-меток (рис. 3.7, 3.8,А), так и на характер фотоиндуцированных изменений в спектрах ЭПР (будем называть в дальнейшем эти изменения фотооткликом (рис. 3.7, 3.8,Б).
Удаление С-концевого пептида через 5 мин после начала протеолиза приводит к изменениям в темновых спектрах ЭПР как для меток, связанных с Cуs-316, так и для меток, связанных с Суs-140, хотя в первичной структуре белка Суs-140 значительно удален от Суs-316. Такой результат обнаруживается как для МSL. так и для МESL. Полное удаление С-концевого пептида приводило к практически полному исчезновению фотоотклика МЕ8Ь. Фотоотклик МSLне изменялся для метки, связанной с Суs- 316, и даже возрастал для метки, связанной с Суs-140.
Существенное увеличение фотоотклика в случае МSLнаблюдалось не только при удалении С-концевого пептида, но также и при расщеплении молекулы родопсина на два мембран-связанных фрагмента (см. рис. 3.7). В этом случае фото-отклик возрастал в районе обоих остатков (Суs-316 и Суs-140), хотя Суs-140 локализован во фрагменте F24, а Суs-316 - во фрагменте F12.
↑ Взаимодействие родопсина с периферическими белками фоторецепторных мембран
Влияние фосфорилирования родопсина на спектры ЭПР меток.Изменения различных спектральных параметров меток при фосфорилировании родопсина представлены в табл. 3.2. Можно видеть, что хотя фосфорилирование затрагивает непосредственно С-концевой фрагмент, уменьшение подвижности наблюдается для меток, связанных не только с этим фрагментом, но и с другими участками белка.
Этот результат, так же как и данные по влиянию протеолиза на спектры родопсина в темноте и при освещении, свидетельствует о пространственной близости С-концевой области с остатками Су8-140 и Сув-316. Однако, в отличие от протеолиза, фосфорилирование приводит к значительному затормаживанию вращательной подвижности МЕSLв этих областях.
Фосфорилирование родопсина приводит также к значительному возрастанию фотоотклика, особенно для меток, связанных с С-концевыми парными SН-группами. В этом случае, так же как и при протеолизе, наблюдается корреляция между большей иммобилизацией метки на поверхности родопсина в регенерированном или темновом белке и последующим более сильным "разрыхлением" структуры белка при образовании метародопсина II.
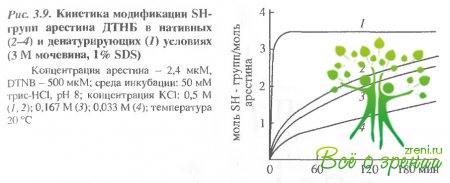
Модификация сулъфгидрилъных групп арестина ДТНБ и HgSL. При помощи ДТНБ в препаратах арестина можно обнаружить до 3,4 ± 0,2 моль 8Н-групп на 1 моль белка (рис. 3.9). Таким образом, все три остатка цистеина, имеющиеся в молекуле арестина, доступны модификации, т.е. в этом белке нет дисульфидных связей. Доступность SН-групп существенно зависит от ионной силы среды инкубации.
При уменьшении концентрации КСl от 0,5 до 0,033 М время, необходимое для модификации половины всех доступных титрованию 8Н-групп, возрастает почти в 3 раза: от 60 до 150-180 мин. При низкой ионной силе (0.033 М КСl) даже в присутствии 0,1% ЦТАБ полный титр SН-групп не превышает 2,7 моль SН-групп на 1 моль белка, причем, при добавлении КСl эта величина не возрастает. По-видимому, в этом случае происходят необратимая агрегация молекул арестина, приводящая к маскированию SН-групп внутри белкового кластера, или образование внутри- и межмолекулярных дисульфидных связей.
Кинетика титрования SН-групп в нативных услозиях в присутствии 0,5 М КС1 описывается суммой двух экспонент. Найдены следующие значения констант скоростей реакций псевдопервого порядка: к1 = (2,7 ± 0,1) 10-3 с-1 (для 0,7-0,8 моль SН-групп на 1 моль белка), к2 = (1,5 ± 0,1) • 10-3 с-1 (для 2,5-2,7 моль SН- групп на 1 моль белка). В денатурирующих условиях (в присутствии 3 М мочевины и 808), а также в 0,1% растворе ЦТАБ скорость модификации 8Н-групп существенно возрастает: к1 > > 10-1 с-1 (для 2,4 молейSН-групп на 1 моль белка), к2 = (7,5 ± 1,5) – 10-3 с-1(для 0,8 молей SН-групп на 1 моль белка).
По отношению к водорастворимым тиоловым реагентам SН- группы арестина менее реакционноспоссбны по сравнению с SН- группами ?-субъединицы трансдуцина, что может свидетельствовать о более гидрофобном окружении остатков цистеина в молекуле арестина. Если это предположение верно, то скорость модификации 8Н-групп этого белка гидрофобными тиоловыми реагентами должна быть больше. Действительно, нерастворимая в воде ртутьорганическая спиновая метка при кратном избытке по отношению к арестину и концентрации последнего 2 мкМ через 30 мин инкубации при комнатной температуре модифицирует все свободные SН-группы: они оказываются недоступными для ДТНБ.
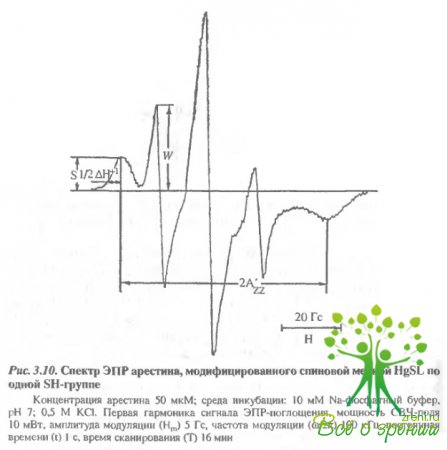
При высокой концентрации арестина (50 мкМ) и эквимолярном количестве метки последняя практически полностью связывается с белком уже через 10 мин инкубации при комнатной температуре, о чем свидетельствует отсутствие сигнала свободной метки в спектрах ЭПР спинмеченного арестина (рис. 3.10). При помощи ДТНБ в этих образцах удается обнаружить еще 2,1 моль SН-групп на 1 моль белка.
При 1,3-1,5-кратном избытке метки НgSLне происходит дополнительной модификации арестина: даже при инкубации в течение 2 ч в спектрах ЭПР сохраняется сиг-нал свободной метки. Недоступность двух 8Н-групп арестина спиновой метке в концентрированном растворе белка может быть обусловлена его агрегацией. Увеличение светорассеяния концентрированных растворов арестина указывает на это.
Чтобы проверить это предположение, была изучена зависимость спектров ЭПР спинмеченного арестина от вязкости, которую варьировали, добавляя кристаллическую сахарозу. Установлено, что при "величении вязкости от 1 до 6 сан гипуаз параметр 2А' возрастает от 67 до 68,7 Гс. Линеаризация этой зависимости в координатах, используемых при описании броуновского вращения по закону Стокса, дает предельное значение 2А' = 69 Гс, соответствующее отсутствию вращения. Зная предельное значение, можно оценить время корреляции вращения белка. В водном растворе при 20° С оно составляет 63 ± 2 не. Согласно теоретической оценке, время корреляции вращения для белка с молекулярной массой 46 кДа должно быть равно 19,2 не. Таким образом, можно заключить, что при концентрации 50 мкМ арестин образует агрегаты, причем, средняя степень агрегации близка к трем.
Статья из книги: Молекулярные механизмы зрительной рецепции | Каламкаров Г.Р., Островский М.А..






Комментариев 0