Регенерация фотопотенциала на фоторецепторном диске (Часть 1)

Содержание:
Описание
В данной главе изложены результаты исследования электрохимических свойств фоторецепторной дисковой мембраны. Начиная это исследование, мы исходили из определенной структурной схожести зрительного родопсина и другого ретиналь-содержащего белка - бактериородопсина. Действительно, нам удалось установить, что зрительный родопсин, как и бактериальный, генерирует при освещении электрический потенциал на мембране диска; предполагалось, что именно появление потенциала является одним из факторов усиления сигнала, и появление потенциала приводит к открыванию большого количества кальциевых каналов в диске. Дальнейшие исследования показали, что эта гипотеза неверна, однако фотопотенциал, генерируемый на мембране диска, оказался удобным инструментом для исследования ее электрохимических свойств. В частности, мы попытались вы¬явить наличие ионных каналов в фоторецепторной дисковой мембране. То, что дисковая мембрана должна содержать ионные каналы, представляется совершенно естественным. Действительно, онтогенетически эта мембрана образуется из плазматической мембраны фоторецептора, которая содержит как цГМФ-регулируемые каналы в наружном сегменте, так и потенциал-регулируемые каналы - во внутреннем.
↑ Генерация фотопотенциала родопсином и бактериородопсином
Известно, что основой функционирования родопсин-подобного белка бактериородопсина является генерация им под действием света разности потенциалов на бактериальной мембране. Исторически именно фоторецепция дала первые идеи о функционировании бактериородопсина. Структурно зрительный и бактериальный родопсин близки. Оба белка используют ретиналь в качестве хромофора, оба белка трансмембранны. Есть определенное сходство в первичной структуре. Однако до какой степени эти структурные общие черты существенны при функционировании молекулы? Известно, что функции этих двух фоточувствительных белков различны. Бактериородопсин является типичным фотоэлектрическим генератором, аналогичным фотосинтетической системе и использует энергию света для образования АТФ Родопсин является сенсорным белком, функция которого - лишь определить существование светового кванта. Фоторецепторная клетка имеет мощную систему усиления сигнала, которая, в противоположность бактериородопсину, использует АТФ и другие источники энергии.
Известно, что фотоцикл бактериородопсина и фотолиз зрительного родопсина имеют много общего. В связи с этим мы задались вопросом, в какой степени хотя бы фотоэлектрические процессы, протекающие в этих двух системах, сходны и генерили в ходе фотолиза родопсина фотопотенциал на фото- рецепторной мембране аналогично тему, как он возникает на бактериальной мембране, содержащей бактериородопсин. Указание на то, что это имеет место можно найти в работе.
Известно также, что в фоторсцепторной клетке при освещении сильным светом генерируется ранний рецепторный потенциал, постоянные времени которого по порядку совпадают со временем жизни промежуточных продуктов фотолиза родопсина. Генерация фотопотенциала была также прямо показана при модификации бислойной мембраны родопсином.
В группе академика В Л Скулачева был разработан метод, позволяющий подробно исследовать генерацию фотопотегциала бактериородопсина. Преимущество этого метода перед бислойными мембранами, используемыми Fesenко. Lubarsky, состоит в том, то родопсином модифицируется не бислойная мембрана, которая очень нестабильна, а пропитанный липидами мембранный фильтр. Часть мембраны, которая непосредственно взаимодействует с липидами фильтра, растворяется и между фоторепеторной мембраной и мембранным фильтром образуется водный промежуток. Поскольку сопротивление толстого мембранного фильтра значительно больше, чем фоторецеиторнэй мембраны, то такая система передает фотоэлектрические процессы, происходящие в мембране, без искажений. Фоторецепторные диски, или бляшки, содержащие бактериородопсин, добавляли в один из отсеков тефлоновой кюветы, разделенной коллодиевой или флуороиоровой пленкой, пропитанной раствором азолектина или яичного лецитина с октадециламином В течение 2-4- ч диски или бляшки встраивали в пленку, затем система подвергалась освещению постоянным светом или лазерной вспышкой. Результаты этих исследований изложены в серии статей.
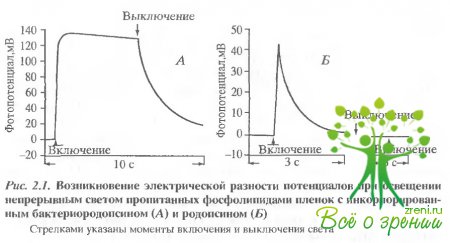
На рис. 2.1 показана генерация разности электрических потенциалов, индуцированных постоянным светом в системе родопсиновый диск - коллодиевая пленка (рис. 2.1, А) и бактериоро-допсиновая бляшка - коллодиевая пленка (рис. 2.1, Б).
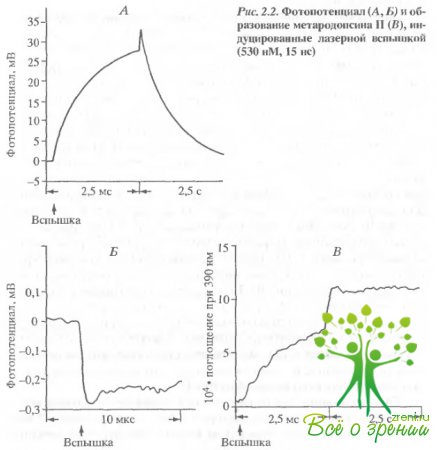
Показано, что бактериородопсин генерирует устойчивый электрический потенциал в течение всего периода освещения, что согласуется с болранними работами. Зрительный родопсин также генерировал фотоэлектрический потенциал, который в данном эксперименте достигал 43 мВ. Однако в этом случае не наблюдалось устойчивого фотопотенциала Увеличение потенциала спонтанно сменялось падением задолго до выключения света. Повторное освещение системы со зрительным родопсином не вызывало измеримого фотоответа. На рис. 2.2. приведены эффекты лазерной вспышки. Как видим, при однократном срабатывании два родопсина обнаруживают гораздо больше сходства чем при освещении постоянным светом.
Как в случае бактериального, так и животного родопсинов вспышка индуцирует очень быстрое (I = 200 не) образование разности потенциалов, направление которой (сторона пленки без родопсина заряжена отрицательно) оказывается противоположным таковому при постоянном освещении. Затем развивается положительный ответ, и мембранный потенциал достигает своего максимума в миллисекундной шкале.
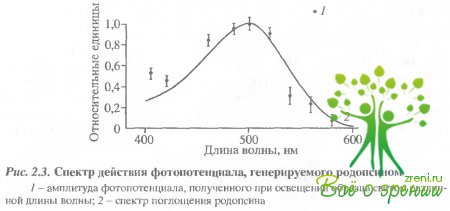
Величина отрицательной фазы примерно в 100 раз меньше, чем положительной. Передний фронт ее не разрешен даже примененной нами техникой (рис. 2.2, Б). Разница между величинами фаз может быть искусственно уменьшена, если зашунтировать коллодиевую пленку внешним сопротивлением. На рис. 2.2, А удельное сопротивление коллодиевой пленки, разделяющей отсеки камеры, составляет 50 мОм/см2. Если пленку зашунтировать сопротивлением, соответствующим 2 к Ом/см-, что близко к сопротивлению наружной мембраны фэторецептора, то в результате соотношение положительной и отрицательной фаз от 0,014 возрастало до 0,16. Фотоэлектрический ответ такой зашунтированной системы становится похож на ранний рецепторный потенциал, Фронт нарастания фотопотенциала хорошо коррелирует с постоянной зремени образования метаро-допсина II (рис. 2.2, Б). Спектр действия фотоиндуцированного фотоэлектрического ответа совпадает со спектром поглощения родопсина (рис. 2.3).
↑ Фотоиндуцированный электрический ответ метародопсина.
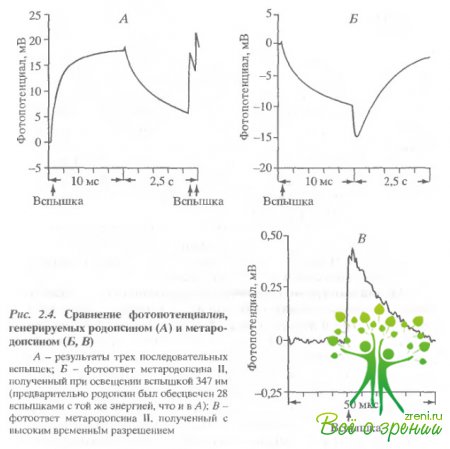
Освещение образца лазерной вспышкой с ?макс = 347 нм вслед за вспышкой 540 нм приводило к генерации фстопотенциала, имеющего полярность, противоположную фотопотенциалу родопсина. Для получения такого фотоответа критичен интервал между вспышками 530 и 347 нм. Этот интервал должен быть больше 1 мс и меньше 5 мин. Изучение временных и спектральных характеристик фотоответа на вспышку 34"7 нм позволяет заключить, что он генерируется интермедиатом метародопсином II. На рис. 2.4 для сравнения приведены ответы родопсина и метародопсина II. Первый фотоответ (см. рис. 2.4, А) был получен при освещении родопсина вспышкой 530 нм. Через 2 с образец освещался серией вспышек (30 вспышек 530 нм с интервалом 200 мс между вспышками). Спустя 10 с образец освещался вспышкой 347 нм (см. рис. 2.4. Б).
Видно, что величина и форма фотопотенциала метародопсина II сходны с фотоответом родопсина, однако он имеет противоположную полярность (знак плюс внутри диска - для родопсина и минус - для метародопсина II) Более детальное сравнение показало, что у метародопсина II электрогенная фаза больше, а последующие фазы несколько меньше, чем у родопсина Никаких фотоэлектрических ответов не было обнаружено в том случае, когда образец освещался через 7 мин после первоначального освещения, хотя спектральные измерения показали, что в образце содержится большое количество метародопсина III.
Гидроксиламин, как известно, предотвращает образование каких-либо устойчивых интермедиатов фотолиза родопсина. Добавление гидроксиламина приводило к тому, что ответ на вспышку 347 нм полностью исчезал. На ответ же собственно родопсина гидроксиламич влияния практически не оказывал. Например, в изложенном выше эксперименте (см. рис. 2.4, А) величина фото-ответа на первую вспышку 530 нм без гидроксиламина составляла 18 мВ, а на вспышку 347 нм - 15 мВ. При добавлении 10 мМ гидроксиламина в аналогичный образец ответ на 547 нм составил 16 мВ. в то время как на 347 нм - практически не регистрировался.
↑ Отсутствие трансмембранного переноса протона в фоторецепторном диске при освещении.
Как описано выше, освещение фоторецепторных дисков приводит к генерации трансмембранного потенциала, кинетические параметры которого близки характерным временам перехода метародопсин І-метародопсин II. По аналогии с бактериородопсином фотопотенциал на фоторецепторной мембране диска мог бы возникать вследствие переноса протона, поглощенного из внешней среды, через мембрану внутрь диска. Обратные изменения метародопсина II при фотоиндуцированном переходе в продукт Р460 сопровождаются изменением полярности фотопотенциала. Такое обращение знака фотопотенциала могло бы происходить в результате обратного переноса протона из внутридискового пространства во внешнюю среду.
Выяснение природы фотопотенциала требует решения следующих задач.
- Сопровождается ли возникновение трансмембранной разности потенциалов переносом Н+ через мембрану фоторецепторного диска, как это происходит в бактериальной мембране, содержащей бактериородопсин?
- Сопровождается ли фотоиндуцированный переход метаро-допсина II в продукт Р460 высвобождением Н+[/sup] во внешнюю среду?
- С какой из изохромных форм метародопсина II связана генерация фотопотенциала на мембране диска?
Поглощение протона фоторецепторными дисками при освещении и восстановление эффекта после регенерации обесцвеченного родопсина в присутствии 11-цис-ретиналя. Фотоиндуциро ванные изменения рН исследовались в суспензии фоторецепторных дисков и их фрагментов спектрофотометрически с помощью индикатора рН бромкрезолового пурпурного. Освещение образца вызывает быстрое увеличение рН, которое сопровождается затем медленным подкислением среды. Количественно освещение приводит к поглощению из среды 1,4 ± 0,07 молей Hh на моль родопсина.
Современные методы не позволяют проводить измерения рН в крайне незначительном внутридисковом пространстве (диаметр меньше 1 мкм). Поэтому в экспериментах мы использовали инвертированные диски. Действительно, в этом случае регистрация изменений рН обычными методами в инкубационной среде, содержащей инвертированные диски, фактически, означала бы измерения рН внутри диска.
Как известно, замораживание суспензии фоторецепторных дисков и последующее нагревание до 4 UC приводит к обоазованию дисков с обратной ориентацией мембраны: внутридисковая поверхность мембраны оказывается обращенной во внешнюю среду.
В образцах суспензии после многократного замораживания-размораживания освещение вызывало подщелачивание лишь на 0,27 ± 0,04 моля Na на моль обесцвеченного родопсина (средние результаты по 11 опытам), что составило около 20% эффекта, наблюдаемого в суспензии нормально ориентированных дисков. Таким образом, в суспензии после замораживания и оттаивания не происходит поглощения протона, как в случае дисков с нормальной ориентацией, и не наблюдается фотсиндуцирсианного изменения рН Наблюдаемое в опытах небольшое подщелачивание может происходить, например, за счет примеси неинвертированных дисков. Чтобы это установить, необходимо выяснить соотношение дисков с нормальной ориентацией и инвертированных в полученной смеси.
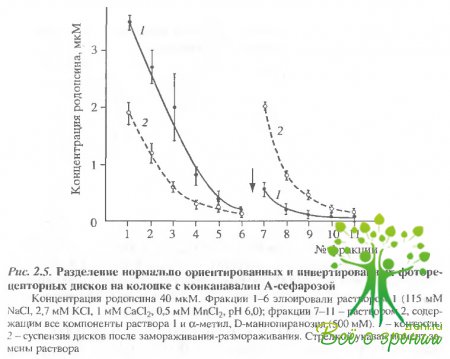
Разделение инвертированных и нормально ориентированных дисков на конканавалин-А-сефарозе. Как отмечалось выше, родопсин является гликопротеидом, к С-концевому пептиду, локализованному с цитоплазматической стороны мембраны, присоединены сахарные остатки. Пои инвертировании фоторецепторных дисков, например, при их замораживании-размораживании эти остатки остатки оказываются обращенными во внутридисковое пространство. Это обстоятельство и использовалось, чтобы получить раздельно фракции дисков с нормальной ориентацией и инвертированные путем их разделения на конканавалин-А-сефарозе.
Через колонку с конканавалин-А-сефарозой пропускали тем- новые образцы суспензии фоторецепторных дисков, не подвергавшиеся замораживанию, и аликвоты той же суспензии после замораживания и оттаивания. Результаты разделения представлены на рис 2.5. В контроле большая часть дисков элюируется раствором 1, т.е. представляет собой диски с нормальной ориентацией.
В образцах, подвергавшихся замораживанию и оттаиванию, примерно половина дисков связывается конканавалином и элюируется раствором 2, содержащим метил-?-О-маннопиранозид, т.е. имеет обратную ориентацию мембраны.
В табл. 2.1 приведены данные по содержанию фракций, полученных после хроматографии на конканавалин-А-сефарозе в контрольных и подвергавшихся замораживанию образцах, выраженные в процентах к исходному количеству родопсина в суспензии, нанесенной на колонку.
Контрольные образцы содержали около 80% нормально ориентированных дисков. В образцах после замораживания и оттаивания около 40% дисков имели нормальную ориентацию, а около 35% - обратную. Около 29% дисков остались необратимо связанными с конканавалином-А в обоих случаях.
Таким образом, суспензия после замораживания-размораживания содержит не только инвертированные диски, но и диски с нормальной ориентацией.
Фотоиндуцированные изменения рН в отдельных фракциях фоторецепторных дисков после хроматографии на конканава-лин-А-сефарозе. В экспериментах использовали фракции 1 и 7, которым соответствовала наиболее высокая концентрация родопсина. В этих фракциях исследовали фотоиндуцированные изменения рН потенциометрическим методом при рН 6,0.
В образцах фракции 1 (нормально ориентированные диски) освещение приводило к поглощению 1,4 ± 0,18 Н+ на моль обесцвеченного родопсина (среднее из 7 опытов). Во фракции 7, содержащей предположительно только инвертированные диски, также наблюдалось подщелачивание (поглощение 0,61 ± 0,08 молей Н на моль обесцвеченного родопсина). Такой эффект мог быть вызван примесью нормально ориентированных дисков, которые и могли бы определять эффект подщелачивания. Для проверки этого фракции 7 и 10 объединяли, осаждали и вновь наносили на конканавалин-А-сефарозу. Распределение по фракциям после такой операции оставалось таким же, как и при первом разделении: 46% - диски с нормальной ориентацией, 32% - инвертированных и 22% - необратимо связывалось с конканавалином.
По-видимому, инвертированные мембранные структуры имеют тенденцию к спонтанному возврату к исходной ориентации. Действительно, величина фотоиндуцированного подщелачивания возрастала по мере хранения образцов и через 2 ч достигала 80% контроля, что свидетельствует о медленном восстановлении нормальной ориентации дисков с течением времени.
В опытах по разделению инвертированных и нормально ориентированных дисков на конканавалин-А-сефарозе интервал времени от момента нанесения на колонку раствора 2 до начала регистрации изменений рН составлял 30-40 мин. Как следует из кривой, представленной на рисунке, эффект поглощения гротона к этому моменту времени должен был бы составить 35-40% эффекта в контроле. Действительно, в то время как поглощение Н+ во фракции 1 совпадает с эффектом в контроле, поглощение Н+ во фракции 7 составляет около 40% от него (табл. 2.2, рис. 2.6). В тех случаях, когда эффект регистрировали в течение 5 мин после размораживания, он составлял ~ 20% от контроля.
Таким образом, наблюдается корреляция между эффектом поглощения Н+ и количеством дисков с нормальной ориентацией. Такая корреляция, очевидно, отсутствовала бы в том случае, если бы инвертированные диски, содержащиеся во фракции 7, элюируемой раствором 2, высвобождали Н+ при освещении. Если бы такой процесс происходил, то при примерно равном содержании дисков с противоположной ориентацией никаких изменений рН в среде не наблюдалось бы, или они были бы очень малы. Следовательно, хотя в наших экспериментах и не удалось получить "чистую" фракцию инвертированных дисков, анализ полученных результатов позволяет сделать вывод об отсутствии фотоиндуцированного трансмембранного переноса протона в ходе фотолиза родопсина.
Высвобождение протона фоторецепторными дисками при фотоиндуцированном переходе метародопсина II в метаро-допсин III. Происходит ли, депротонирование метародопсина II при его распаде и образовании долгоживущего продукта метаро-допсина III Чтобы выяснить это, суспензию сначала освещали светом с ?макс = 500 нм, при этом регистрировался эффект быстрого подщелачивания, а затем примерно через минуту после вспышки образец освещали в течение 10 с светом с ?макс - 365 нм. При этом происходило быстрое снижение оптического поглощения, обусловленное подкислением среды инкубации (рис. 2.7, А). По абсолютной величине эффект составлял 36 ± 4% от эффекта поглощения протона (средние данные по 5 опытам).
Последовательные экспозиции образца к свету с ?макс = 365 нм вызывали постепенное снижение и исчезновение эффекта подкисления. Если суспензию освещали таким светом через 30 мин после вспышки с ?макс = 500 нм, т.е. после завершения термального распада метародопсина I, то эффекта быстрого подкисления не наблюдали (рис. 2.7, Б). Сокращение (Времени жизни метародопснна с помощью гидроксиламина приводило к исчезновению эффекта подкисления при освещении образца светом с ?макс = 365 нм (рис. 2.7, В).
Чтобы убедиться, что изменения оптического поглощения образца были вызваны изменениями рН, а не спектральными изменениями родопсина в процессе фотолиза, были проведены эксперименты, в которых фоторецепторные диски инкубировались в 0,1 M буфере MES при рН 6,0.
Освещение таких образцов светом с ?макс = 500 нм приводило к снижению оптической плотности, связанному с обесцвечиванием родопсина, Изменений рН в образце не наблюдали из-за присутствия буфера с высокой ионной силой. Последующее освещение образца светом с ?макс = 365 нм никаких изменений в поглощении не вызывало (рис. 2.7, Г). Можно полагать, что наблюдаемый эффект отражает обратные изменения конформации молекулы родопсина при переходе в метародопсин III, который спектрально ближе к более раннему продукту фотолиза - метародопсину I.
Связь поглощения протона с образованием изохромной формы метародонсина II. Как было показано выше, при освещении не происходит трансмембранного переноса протона внутрь диска. Однако не исключена возможность переноса поглощенного протона в глубь мембраны. Такой процесс также мог бы привести к генерации фотопотенциала на фоторецепторной мембране. В связи с этим интересно сравнить кинетические характеристики поглощения Н+ с известными параметрами фотопотенциала. При таком сравнении представляется важным также решение вопроса о том, с какой из изохромных форм метародопсина II связаны оба процесса.
Известно, что образование метародопсина II делает альдиминную связь хромофора с опсином доступной для гидроксиламина. В присутствии гидроксиламина равновесие сдвигается в сторону образования оксима, что существенно сокращает время жизни метародопсина II и препятствует образованию более поздних продуктов фотолиза, и это позволяет исследовать вопрос о том, на какой из стадий образования метародопсина II происходи! протонирование. На рис. 2.7 представлен образец записи одного из типичных экспериментов. При освещении суспензии, содержащей избыток гидроксиламина, поглощение протона не происходило, наблюдалось лишь значительное снижение оптического поглощения образца, вызванное вкладом от обесцвечивания родопсина. Таким образом, в присутствии гидроксиламина протонирование родопсина не происходит. Это свидетельствует, по-видимому, о том, что протонирование происходит при образовании более поздней изохромной формы метародопсина II, образование которой блокируется гидроксиламином.
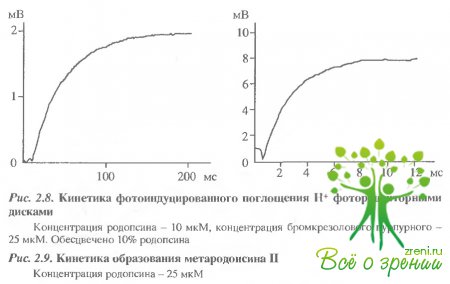
Эти результаты косвенно указывают на то, что две изохромные формы метародопсина II - протонированная и непротонированная - образуются последовательно в ходе фотолиза. О том же свидетельствуют и результаты кинетических измерений с большим временным разрешением (рис. 2.8,2.9) Видно, что т эффекта подкисления составляет -200 мс, а спектральных изменений при образовании метародопсина II ~ 6 мс, что, как указывалось выше, совпадает с постоянной времени генерации фотопотенциала на мембране.
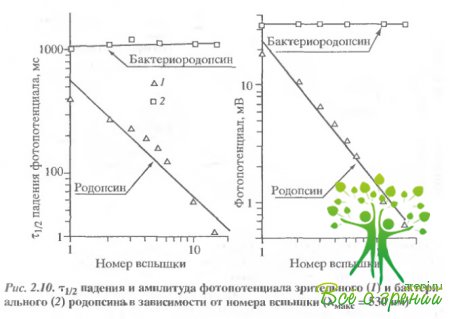
Фотоиндуцированное ускорение спада фотопотенциала; увеличение проводимости мембраны. Существенное отличие в поведении зрительного и бактериального родопсина обнаружилось при исследовании постоянных спада фотопотенциалов. На рис. 2.10 представлены зависимости амплитуды и постоянной времени спада фотопотенциала от номера вспышки.
В случае зрительного родопсина оба эти параметра уменьшаются при увеличении числа вспышек. В случае бактериального родопсина ни амплитуда, ни время спада фотопотенциала не изменялись. Уменьшение амплитуды фотоответа обусловлено обесцвечиванием родопсина. Что касается спада фотопотенциала, то его изменения могут быть обусловлены как изменением емкости, так и изменением проводимости дисковой мембраны. Чтобы выбрать из этих двух возможностей, был проделан следующий эксперимент. Во время освещения образца лазерной вспышкой к коллодиевой пленке прикладывалось внешнее поле. Это приводило к ускорению спада фотопотенциала, что свидетельствует о том, что изменение спада фотопотенциала обусловлено скорее изменением проводимости, чем емкости.
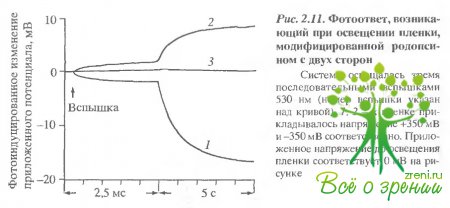
Больший по величине эффект влияния света на проводимость дисковой мембраны был получен в том случае, когда фоторецепторные диски приклеивались к обеим сторонам коллодиевой пленки В такой симметричной системе освещение лазером не приводило к генерации фотопотенциала на пленке. Такой подход позволяет более точно регистрировать изменения сопротивления дисковой мембраны (рис. 2.11).
Как известно, освещение метародопсина II светом с = 380 нм приводит, с относительно низким квантовым выходом, к образованию родопсина (фоторегенерация родопсина). Мы попытались обнаружить обратимость фотопотенциала при фоторегенерации, освещая метародопсин в коллодиевой пленке лазерной вспышкой с длиной волны 347 нм. Освещение в течение 10 с непрерывным светом с ?макс = 480 нм приводило к сильному увеличению проводимости мембраны. Последующее освещение вспышками 530 и 347 нм оказывалось практически неэффективным. Однако освещение вспышкой с максимумом 530 нм вслед за вспышкой 347 нм приводило к значительному эффекту. Вероятно, фотопревращения родопсина приводят к изменению проводимости, в то время как освещение метародопсина II не влияет на эту величину. Что же касается значительного эффекта вспышки 530 нм вслед за 347 нм, то он обусловлен, по-видимому, частичной фоторегенерацией родопсина.
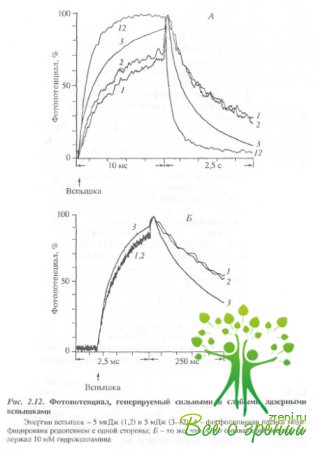
Ранее в ряде работ было показано, что освещений искусственных мембран, содержащих родопсин, приводит к образованию пор, проницаемых для Na+. Cs+, Са2+, глицерина и глюкозы, но не сахарозы. В наших экспериментах исключение из среды NaCl приводило к заметному увеличению постоянной времени спада фотопотенциала, что свидетельствует о том, то ускорение спада обусловлено ион-проницаемыми структурами. В последующей серии экспериментов была сделана попытка оценить характерные времена ускорения спада фотопотенциала. На рис. 2.12, А представлены отнормированные по амплитуде фотоответы на 1-, 2-, 3- и 12-ю вспышки.
Энергия 1-й 2-й вспышек была в 1000 раз меньше, чем 3- и 12-й. Как видно, кинетики ответов на 1- и 2-ю вспышки практически совпадают. Кинетика же спада на сильную вспышку существенно отличается: спад фотопотенциала ускоряется. Более того, создается впечатление, что нарастание фотопотенциала также ускоряется. Частично это происходит оттого, что вклад третьей, миллисекундной, фазы уменьшается из-за ускорения спада фотопотенциала. Соответственно вклад второй микросекундной фазы увеличивается, так как даже после 12 вспышек постоянная спада больше, чем характерное время второй фазы нарастания. Что касается спада фотопотенциала, то лаг период между вспышкой и ускорением спада фотопотенциала, если и существует, то менее 50 мс. Это особенно хорошо видно из рис. 2.12, Б, где показано начало регенерации фотопотенциал а с лучшим временным разрешением.
Действительно, постоянные времени спада в ответ на первую и вторую слабые вспышки практически совпадают. Это означает, что ускорение спада фотоответа вызвано самой вспышкой, а не предшествующим обесцвечиванием родопсина. Когда в раствор добавлялось 10 мМ NН4ОН, чтобы предотвратить накопление метародопсина II и других долгоживущих продуктов фотолиза родопсина, эффект ускорения заднего фронта фот опотенциала не зависел от присутствия гидроксиламина в среде. Аналогичный результат был получен и при прямом измерении сопротивления мембраны, т.е. когда коллодиевая пленка модифицировалась фоторецечторными дисками с обеих сторон.
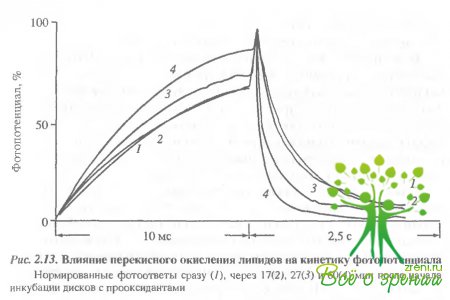
Природа фотоиндуцированных изменений проводимости. Причины изменений приводимость следует искать в изменении тех компонентов мембраны, на которые может воздействовать свет. Известно, что освещение фоторецепторной мембраны приводит к перекисному окислению чипидов и окислению 8Н-групп зрительного пигмента. Мы попытались выяснить, не являются ли эти факторы причиной быстрого изменения проводимости мембраны. Для этого в кювету с дисками, встроенными в плоскую мембрану, добавляли прооксиданты. В ходе инкубации в темноте регистрировались фотоответы на тестовые вспышки небольшой интенсивности, которые сами по себе не вызывали ускорения заднего фронта фотопотенциала. Нормированные фотоответы представлены на рис. 2.13.
Видно, что перекисное окисление вызывает ускорение спада фотоответа. Чтобы установить количественную связь фотоокисления и изменения проводимости, параллельно на той же порции дисков определялась кинетика накопления продуктов перекисного окисления липидов по малоновому диальдегиду (МДА). Оказалось, что сопротивление мембраны начинает уменьшаться при накоплении в мембране 100 нМ МДА на мг родопсина. В следующей серии была исследована кинетика фотоиндуцированного окисления липидов в мембране при тех же условиях освещения, при которых регистрируется изменение проводимости. Концентрацию МДА определяли в пробах, освещенных 5, 10, 15 и т.д. лазерными вспышками. Оказалось, что количество образующихся при этом перекисей значительно меньше тех. которые вызывают значительное изменение проводимости мембраны. Таким образом, хотя перекисное окисление и может вызывать изменение проводимости в мембране, наблюдаемые нами фотондуцированные изменения не могут быть обусловлены этой причиной.
Статья из книги: Молекулярные механизмы зрительной рецепции | Каламкаров Г.Р., Островский М.А..






Комментариев 0