Лечебные меры при близорукости │ Часть 2

Содержание:
Описание
↑ Склеропластические операции
Что касается близорукости высокой степени, то при ней основная задача — предупредить ее прогрессирование и развитие осложнений. Важную роль в этом играют склеропластические операции. Смысл их заключается в наложении своеобразного бандажа, преимущественно на заднюю поверхность глаза, чтобы предупредить дальнейшее растяжение склеры в этом отделе.
Идея укрепления ослабленной склеры при близорукости принадлежит М. М. Шевелеву (1930), который разработал соответствующую операцию на трупных глазах, использовав в качестве трансплантата ленту из широкой фасции бедра.
В клинике операцию укрепления склеры при высокой прогрессирующей близорукости впервые произвел I. Malbran (1954), который использовал для этой цели сухожилие. D. J. Curtin (1961) разработал в эксперименте и клинике операцию меридионального укрепления склеры Х-образным трансплантатом из широкой фасции бедра, который проводят за глазное яблоко с помощью специального инструмента. В нашей стране операцию подобного типа впервые произвели А. П. Нестеров и Н. Б. Либенсон (1967), и после этого склеропластические операции при миопии получили у нас широкое распространение.
Эффект склеропластики при близорукости состоит в прекращении или резком замедлении прогрессирования миопии, а также в небольшом уменьшении степени миопии и повышении остроты зрения. Очевидно, указанный эффект обеспечивают три фактора: 1) механическое укрепление склеральной капсулы глаза путем образования дополнительного каркаса; 2) реваскуляризация склеры; 3) местное стимулирующее (тканевое) воздействие на склеру. Склеропластические вмешательства при миопии можно разделить на две группы: 1) операции, при которых трансплантат укрепляют у экватора и свободный конец его подводят к заднему полюсу глаза, а также операции введения тканевой взвеси в эту область; 2) операции, при которых трансплантaт проходит через задний полюс глаза перпендикулярно передне-задней оси глаза, при этом создаются условия для некоторого натяжения трансплантата и укорочения оси. Этим патогенетически ориентированным операциям следует отдать предпочтение. По-видимому, операции первого типа целесообразнее производи детям с неосложненной близорукостью и менее выраженным прогрессированием процесса, операции второго типа — при более быстром прогрессировании миопии.
Основные показания к операции склеропластики — близорукость, как правило, не менее 4,0—6,0 дптр, быстро прогрессирующая (1,0 дптр и более в год), сопровождающаяся удлинением переднезадней оси, при еще высокой корригированной остроте зрения и отсутствии осложнений на глазном дне. Таким образом, эти операции по своей сути профилактические. Противопоказанием к их проведению являются острые и хронические заболевания глаз. Ниже приводится краткое описание основных склеропластических операций при миопии.
А. П. Нестеров и Н. Б. Либенсон (1967) используют трансплантаты Х-образной и Y-образной формы, выкраиваемые из аутофасции бедра. Y-образный трансплантат они применяют при миопии высокой степени и яйцевидной, как они полагают, форме заднего отрезка глаза во избежание соскальзывания ножек трансплантата с поверхности склеры. Узкие концы его с помощью крючка проводят в верхневнутреннем и нижневнутреннем сегментах глазного яблока, а широкую часть фиксируют в горизонтальном меридиане в 2 мм от места прикрепления наружной прямой мышцы. Авторы впервые предложили укреплять трансплантат с некоторым натяжением, чтобы добиться небольшого укорочения переднезадней оси и уменьшения степени близорукости.
В. С. Беляев и Т. С. Ильина (1972) модифицировали описанный метод, использовав в качестве трансплантата гомосклеру. Донорский глаз разрезают по спирали (рис. 56)
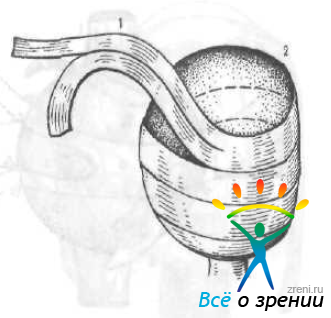
Рис. 56. Схема приготовления ленты трансплантата (1) из склеры донора (2).
и получают ленту размером 6x120 мм. С одного конца ее разрезают на две полосы (3x60 мм каждая). Трансплантат с помощью крючка проводят ретробульбарно (рис. 57)
Рис. 57. Схема ретробульбарного проведения трансплантата.
и фиксируют его узкие ножки четырьмя биошвами к склере на уровне прикрепления внутренней прямой мышцы выше и ниже ее сухожилия. Затем подтягивают широкую часть трансплантата, чтобы освободить зрительный нерв и добиться натяжения трансплантата, и подшивают ее двумя биошвами к склере на расстоянии 4—5 мм кзади от места прикрепления наружной прямой мышцы (рис. 58).
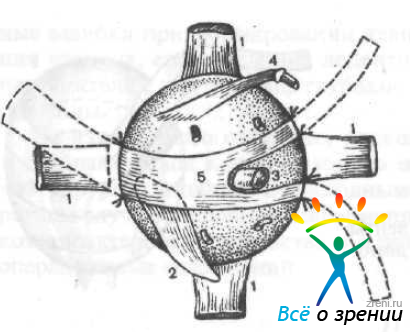
Рис. 58. Схема укрепления трансплантата по Беляеву.
1 — прямые мышцы глаза; 2 — нижняя косая мышца; 3 — зрительный нерв; 4 — верхняя косая мышца; 5 — склеральный лоскут (пунктиром показаны отрезаемые участки).
1 — прямые мышцы глаза; 2 — нижняя косая мышца; 3 — зрительный нерв; 4 — верхняя косая мышца; 5 — склеральный лоскут (пунктиром показаны отрезаемые участки).
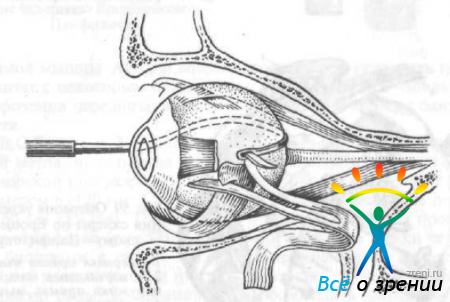
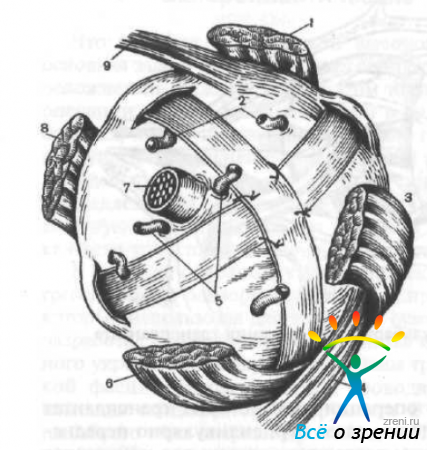
Т. И. Брошевский и Н. И. Панфилов (1970) две полоски широкой фасции бедра, скрепленные в центре швами, заводят за глазное яблоко, затем проводят через заготовленные в склере тоннели и фиксируют швами (рис. 59).
Рис. 59. Операция укрепления склеры по Брошевскому—Панфилову.
1 — верхняя прямом мышца; 2 — вортикозная вена; 3 — наружная прямая мышца; 4 — нижняя косая мышца; 5 — задние длинные ресничные артерии; 6 — нижняя прямая мышца; 7 — зрительный нерв; 8 — внутренняя прямая мышца; 9 — верхняя косая мышца.
1 — верхняя прямом мышца; 2 — вортикозная вена; 3 — наружная прямая мышца; 4 — нижняя косая мышца; 5 — задние длинные ресничные артерии; 6 — нижняя прямая мышца; 7 — зрительный нерв; 8 — внутренняя прямая мышца; 9 — верхняя косая мышца.
Авторы указывают на возможность сдавления трансплантатом зрительного нерва, вортикозной вены и развития вследствие этого таких осложнений, как геморрагический увеит, отслойка сетчатки, атрофия зрительного нерва. Это побудило их разработать новый метод — интерламеллярное укрепление склеры. В меридиональной области глазного яблока образуют интрасклеральные тоннели, в которые осторожно протягивают ленты из гомосклеры или твердой мозговой оболочки шириной 6—7 мм и длиной 22—25 мм (рис. 60).
[banner_centerrs] {banner_centerrs} [/banner_centerrs]
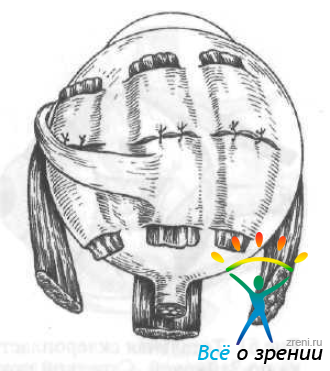
Рис. 60. Интерламеллярное укрепление склеры по Брошевскому —Панфилову.
М. В. Зайкова и В. И. Негода (1970, 1976) используют при склеропластике трансплантаты больших размеров. Операцию производят в трех вариантах: секторообразную, субтотальную и тотальную. В первом случае гомосклеру размером, равным 1/3 или 1/2 окружности донорского глаза, укладывают позади места прикрепления наружной прямой мышцы (с отсечением или без отсечения последней) и подшивают к склере тремя-четырьмя швами, предварительно вырезав в трансплантате выемку для нижней косой мышцы. При этом два задних шва накладывают в средней трети трансплантата в меридианах 8 и 10 часов. При субтотальной и тотальной склеропластике трансплантат (соответственно 2/3, или вся окружность донорской склеры) подводят под всеми прямыми мышцами и фиксируют к склере выше и ниже внутренней прямой мышцы (рис. 61).
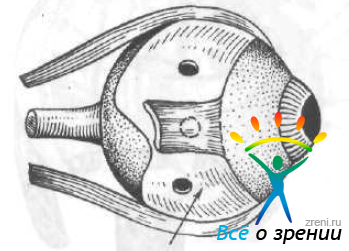
Рис. 61. Тотальная склеропластика по Зайковой. Стрелкой показан трансплантат.
По методу, предложенному А. А. Snyder и F. В.Thompson (1972), операцию производят следующим образом. Предварительно готовят склеральный трансплантат из глаза донора в виде полоски. Его проводят и укладывают на склеру между местом прикрепления нижней косой мышцы и зрительным нервом. Концы трансплантата фиксируют швами к склере кнутри от места прикрепления верхней и нижней прямых мышц (рис. 62).
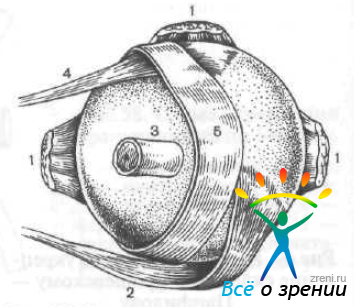
Рис. 62. Операция укрепления склеры по Снайдеру — Томпсону.
1 — прямые мышцы глаза; 2 — нижняя косая мышца; 3 — зрительный нерв; 4 — верхняя косая мышца; 5 — склеральный сосуд.
1 — прямые мышцы глаза; 2 — нижняя косая мышца; 3 — зрительный нерв; 4 — верхняя косая мышца; 5 — склеральный сосуд.
Н. Н. Пивоваров и соавт. (1976) разработали простой метод хирургической профилактики прогрессирования близорукости с помощью гомосклеры. Полоски ее (шириной 5—6 мм, длиной 22—25 мм) погружают под тенонову оболочку (влагалище глазного яблока) до заднего полюса глаза в меридианах 10 часов 30 минут, 1 час 30 минут, 4 часа 30 минут, 7 часов 30 минут и фиксируют одним швом к склере на расстоянии 10—12 мм от лимба (рис. 63).
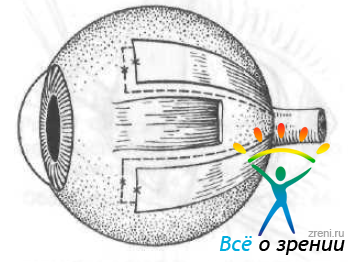
Рис. 63. Склеропластика по Пивоварову и соавт.
Н. Н. Нурмамедов и Г. К. Атамередова (1981) применяют однолоскутную склеропластику с использованием трансплантата из твердой мозговой оболочки. Из нее выкраивают лоскут длиной 46—48 мм и шириной 9—10 мм. На одном конце трансплантата делают дубликатуру в виде кармана длиной 10 мм, сшивая боковые края (рис. 64).
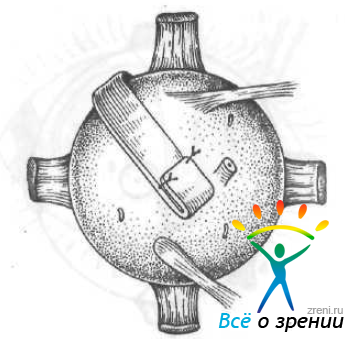
Рис. 64. Однолоскутная склеропластика по Нурмамедову.
Лоскут проводят по склере по направлению к проекции желтого пятна, чтобы дубликатура оказалась за глазом. Передний конец лоскута фиксируют двумя эписклеральными швами, отступя 7 мм от лимба.
Э. С. Аветисов и Е. П. Тарутта (1981) разработали операцию склеропластики для укрепления наиболее растяжимого задненаружного сегмента глазного яблока. Из донорского глаза выкраивают трансплантат в виде полоски от верхней прямой мышцы через задний полюс до нижней прямой мышцы (рис. 65).
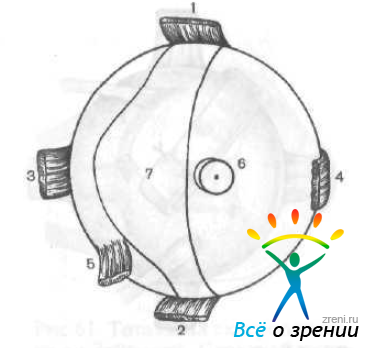
Рис. 65. Выкраивание лоскута из донорского глаза.
1 — верхняя прямая мышца; 2 — нижняя прямая мышца; 3 — наружная прямая мышца; 4 — внутренняя прямая мышца; 5 — нижняя косая мышца; 6 — зрительный нерв; 7 — склеральный трансплантат.
1 — верхняя прямая мышца; 2 — нижняя прямая мышца; 3 — наружная прямая мышца; 4 — внутренняя прямая мышца; 5 — нижняя косая мышца; 6 — зрительный нерв; 7 — склеральный трансплантат.
Ширина верхней части лоскута 7—8 мм, в средней части он расширяется до 12 мм, книзу суживается до 5 мм. Нижнюю часть трансплантата проводят через нижнюю косую мышцу и укрепляют эписклеральным швом под сухожилием нижней прямой мышцы (рис. 66).
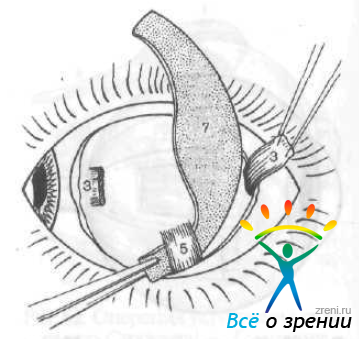
Рис. 66. Проведение нижнего конца трансплантата под нижнюю косую мышцу по Аветисову — Тарутте. Обозначения те же, что на рис. 65.
Трансплантат проводят кзади и фиксируют его передний край эписклеральным швом на заданном (по таблице) расстоянии от лимба. Верхний конец трансплантата укрепляют швом к склере под сухожилием верхней прямой мышцы (рис. 67).
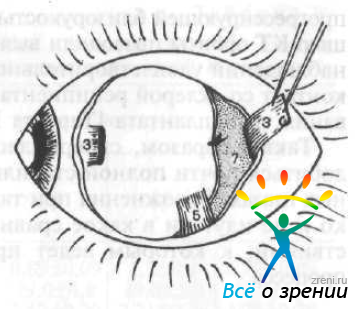
Рис. 67. Фиксация лоскута на нужном месте при помощи швов по Аветисову — Тарутте. Обозначения те же, что на рис. 66.
Разработана операция укрепления склеры трансплантатом большей площади, обработанным полимерной композицией. Такая обработка повышает упруго-прочностные свойства трансплантата, улучшает его фиксацию к поверхности склеры, стимулирует приживление, образование фиброзной ткани и реваскуляризацию. Эта операция особенно целесообразна при повторных вмешательствах, если ранее не удалось добиться стабилизации рефракции [Тарутта Е. П., 1993].
При высокой осложненной близорукости В. И. Савиных (1980) производит операцию, в которой сочетаются укрепление склеры с укорочением глаза, рифлением и задним пломбированием.
Оригинальный способ операции при близорукости предложили М. С. Ремизов и А. И. Грязнов (1981). Они делают четыре разреза конъюнктивы и теноновой оболочки в меридианах между прямыми мышцами, отступя 7—8 мм от лимба. Под тенонову оболочку вводят изогнутую по кривизне глазного яблока, затупленную на конце иглу с широким просветом со шприцем и, продвигая ее конец к заднему полюсу глаза на 15—20 мм, вводят взвесь высушенной и измельченной ткани (аллосклеру или аллохрящ). После наложения швов на тенонову оболочку и конъюнктиву производят массаж глазного яблока через веки для более равномерного распределения взвеси в теноновом пространстве (надсклеральное пространство).
Разработана простая операция введения в теноново пространство одновременно двух жидких биокомпонентов, которые при смешивании тотчас же образуют сгусток, по форме соответствующий задней полусфере глаза [Баталова Т. В., 1983]. Этот сгусток постепенно рассасывается, провоцируя воспаление оболочек глазного яблока, что, как полагает автор, приводит к рубцовому укреплению склеральной капсулы и стабилизации процесса.
Накоплен достаточный клинический материал, позволяющий оценить отдаленные результаты операции укрепления склеры при близорукости. Так, А. П. Нестеров и соавт. (1976) произвели 184 операции. Результаты их в период от 1 года до 7 лет прослежены на 105 глазах. Прогрессирование близорукости отмечено только у 5 % больных. По данным В. С. Беляева и соавт. (1976), в отдаленные сроки (до 7 лет) после 212 операций склеропластики прогрессирования миопии не отмечалось. На неоперированных глазах в 51,5 % случаев наблюдалось прогрессирование близорукости от 0,5 до 4,0 дптр (в среднем на 1,7 дптр) и в 54,2 % — увеличение переносимой коррекции (в среднем на 2,2 дптр).
Оценены результаты операции по методу Э. С. Аветисова и Е. П. Тарутты, произведенной на 112 глазах 85 больных в возрасте от 7 до 22 лет с врожденной близорукостью. Показанием к операции явилось прогрессирование миопии в течение года на 1,0 дптр и более. Срок наблюдения после операции 3—5 лет. Стабилизация близорукости в ближайшие сроки после операции (0,5 года) отмечалась в 94 % случаев. В дальнейшем эффективность операции уменьшалась, хотя темпы роста близорукости были более медленными по сравнению с неоперированным глазом [Юсупов А. А., 1992].
С помощью компьютерной томографии орбиты были изучены состояние склероувеального кольца и комплекса склера — трансплантат, характер расположения трансплантата относительно склеры, степень развития фиброзной ткани, рентгенооптическая плотность склеры у оперированных больных с высокой прогрессирующей близорукостью. Исследования склеры с помощью КТ орбиты позволили выявить в абсолютном большинстве наблюдений удовлетворительное расположение трансплантата, контакт со склерой реципиента, отсутствие признаков рассасывания трансплантата [Тарутта Е. П., 1993].
Таким образом, склеропластические операции позволяют добиться почти полной стабилизации миопии на оперированных глазах. Осложнения при таких операциях развиваются редко и не идут ни в какое сравнение с теми тяжелыми последствиями, к которым ведет прогрессирование миопического процесса.
↑ Безоперационный метод укрепления склеры
Успешно реализована идея безоперационного укрепления склеры при прогрессирующей миопии. Суть метода [Аветисов Э. С. и др., 1981] состоит в том, что под тенонову капсулу в задненаружном отделе глаза инъекционным путем вводят вспенивающуюся полимерную композицию, образующую на поверхности склеры после полимеризации упругий пеногель.
К имплантируемому материалу предъявлялся ряд строгих требований. Он должен: 1) создавать упругий каркас, механическим путем укрепляющий наружную оболочку глаза; 2) стимулировать рост соединительной ткани на необходимом участке и тем самым повышать жесткость и прочность склеры на этом участке; 3) не быть токсичным и не раздражать окружающие ткани глаза и орбиты.
С учетом этих требований для склероукрепляющих инъекций была подобрана специальная полимерная композиция. В ее состав входят этилакрилат, поливинилпирролидон, акриламидгидразил, соли железа, меди и другие компоненты. Этот состав был разрешен для клинического применения и использовался в общей хирургии для заполнения полостей в организме.
Для комплексных экспериментальных биомеханических, биохимических и морфологических исследований было использовано 220 опытных и 78 контрольных глаз кроликов.
Стерильный раствор полимерной композиции готовили непосредственно перед инъекцией путем смешивания сухого и жидкого компонентов препарата в соотношении 1:2,7. После добавления активатора (1 капля перекиси водорода) определенную дозу полученной смеси вводили загнутой иглой для внутримышечных инъекций за глазное яблоко так, чтобы, растекаясь, пеноматериал расположился на склере задненаружного отдела глаза. Вспенивание композиции завершалось примерно через 1 — 1,5 мин после введения, а окончательная полимеризация наступала через 5—7 мин. При этом объем композиции увеличивался в 2—2,5 раза. Формировался эластичный гель с объемной массой около 0,5 г/см3. Энуклеацию глаз производили в сроки от 2 нед до 15 мес.
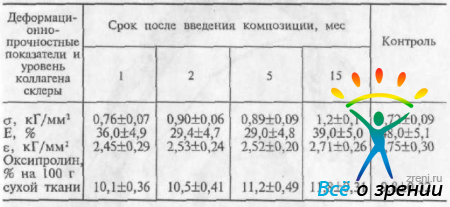
Для оценки воздействия полимерной композиции на биомеханические и биохимические параметры склеральной ткани определяли ее прочностные свойства и уровень коллагена склеры. Методом одноосного растяжения испытывали образцы склеры стандартного размера (4x10 мм), вырезанные в задненаружном отделе глаза, непосредственно контактировавшие с имплантатом. Образцы нагружали с постоянной скоростью до разрыва на универсальной испытательной машине «Instrоn». Определяли механическую прочность (Е), секущий модуль упругости (е), характеризующий жесткость ткани, величину максимальной продольной деформации (е), а также общее количество основного биополимера склеры — коллагена по аминокислоте — оксипролину. Полученные данные приведены в табл. 39.
Таблица 39. Деформационно-прочностные показатели и уровень коллагена склеры (М±m) в различные сроки после введения полимерной композиции
Данные таблицы достоверно показывают (р<0,05), что введение полимерной композиции приводит к увеличению уровня коллагена, а также к существенному улучшению прочностных характеристик участка склеры, контактировавшего с пеногелем: повышается предел прочности ткани склеры, снижается ее растяжимость, модуль упругости возрастает в 1,5 раза. В отдаленные сроки наблюдения (10—15 мес) полученный эффект стабильно удерживался, сохранялся также повышенный уровень коллагена.
Для морфологического исследования глаза фиксировали в 10 % нейтральном формалине. Целлоидиновые срезы окрашивали гематоксилин-эозином и пикрофуксином по методу Ван-Гизона.
В задачи морфологического исследования материалов входило: 1) определение локального скопления вспенивающейся композиции — пеногеля — в месте введения в форме «пломбы»; 2) выявление способности имплантата в условиях орбиты стать пусковым агентом для формирования гранулемы с последующей трансформацией ее в грануляционную, а затем и в зрелую соединительную ткань; 3) выяснение возможности полного рассасывания имплантата; 4) изучение ответной реакции тканей глаза и орбиты на введение вспенивающейся полимерной композиции в зависимости от ее дозы.
При световой микроскопии глаз, энуклеированных через 2 нед от начала эксперимента, выявлено наличие локального скопления пеногеля в месте введения (рис. 68).
Рис. 68. Локальное скопление пеногеля на месте введения.
Его наружную поверхность покрывают тонкие фасциальные листки теноновой капсулы и ближайших экстраокулярных мышц. Как ответ на введенный чужеродный материал наблюдается иммунная реакция в виде скопления макрофагов с формированием гранулемы инородных тел.
Через месяц отмечается прогрессивное развитие этой реакции: среди густых скоплений одноядерных макрофагов появляются гигантские многоядерные клетки. На протяжении последующих 2—3 мес продолжает преобладать макрофагальная резорбтивная реакция, что приводит к некоторому уменьшению объема пеногеля. Обнаруживаются первые проявления фибробластической трансформации в виде эпителиоидных, фибробластических клеток и отдельных тонких пучков коллагеновых волокон как внутри гранулемы, так и на ее периферии на фоне относительно негустой васкуляризации.
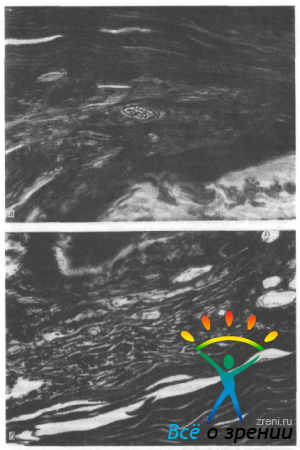
Через 5 мес после введения композиции остатки пеногеля еще обнаруживаются среди макрофагального инфильтрата. Продолжается активная резорбция, увеличивается количество сосудов в гранулеме, формируется нежноволокнистая соединительная ткань на поверхности эписклеры и обращенной в сторону орбиты поверхности гранулемы (рис. 69).
Рис. 69. Активная резорбция, увеличение количества сосудов в гранулеме, формирование нежноволокнистой соединительной ткани на поверхности эписклеры и гранулемы, обращенной в сторону орбиты (а, б).
Спустя 10 мес после начала эксперимента морфологическая картина существенно меняется. Макроскопически гранулема не видна. Микроскопически пеногель выявляется в виде отдельных островков, инкапсулированных разросшейся вокруг соединительной тканью. Резорбция этого чужеродного материала продолжается, но активность процесса снижается, что проявляется в заметном уменьшении гигантских клеток инородных тел и мононуклеарных макрофагов. Следствием этого является неполное рассасывание пеногеля. Между склерой и гранулемой формируется более грубая, чем в срок 5 мес, волокнистая соединительная ткань соответственно расположению гранулемы вблизи экватора или заднего полюса глаза. Сохраняется умеренная васкуляризация гранулемы.
В более отдаленные сроки наблюдения (15 мес) микроскопически продолжают выявляться остатки пеногеля в том или ином количестве при таком же клеточном составе, что и через 10 мес. Однако капсула вокруг остатков гранулемы становится более толстой. Широкие соединительнотканные тяжи внедряются между островками пеногеля. Волокнистая соединительная ткань как между гранулемой и склерой, так и кнаружи от гранулемы становится более грубой.
Следует отметить, что во все сроки наблюдения у 1/3 глаз кроликов вблизи пеногеля удавалось обнаружить редкие скопления лимфоцитов и плазматических клеток, иногда один-два эозинофила. Этот факт свидетельствует о развитии слабовыраженной иммунной реакции, обусловленной, по-видимому, слабыми антигенными свойствами вводимой композиции.
Во все сроки наблюдения осложнений со стороны внутренних оболочек глаза и зрительного нерва не отмечалось. Проявления ответной тканевой реакции в месте введения вспенивающейся композиции в виде скопления сегментоядерных лейкоцитов среди островков пеногеля и скопления макрофагов определялись в трех наблюдениях через 2 нед и в двух через месяц от начала эксперимента при использовании максимальной дозы (0,5—0,6 мл) вспенивающейся композиции, а в дальнейшем совсем не выявлялись. Это позволяет рекомендовать для применения более слабые, но достаточно эффективные дозы (0,05—0,2 мл) вспенивающейся полимерной композиции.
Таким образом, на достаточно большом экспериментальном материале было показано, что инъекция 0,1—0,2 мл полимерной композиции приводит к формированию на поверхности склеры вспененного эластичного геля. Он стимулирует коллагено-образование, служит каркасом для роста соединительной ткани и одновременно действует как упругая механическая «пломба» на поверхности склеры. Замещение введенного пеноматериала по мере его рассасывания новообразованной соединительной тканью приводит к повышению прочностных свойств склеры. Это позволяет рассматривать указанный метод как реальную и достаточно безопасную возможность укрепления склеры без хирургического вмешательства.
Описанная процедура получила название «инъекция склероукрепляющая» (ИСУ) и была успешно апробирована на 30 больных в возрасте от 10 до 44 лет с прогрессирующей близорукостью от 4,0 до 29,0 дптр. Больных мужского пола было 7, женского — 23, 16 пациентов были в возрасте 10—18 лет и 14 — старше 25 лет.
В первой возрастной группе средняя величина миопии составила 7,7 дптр (от 4,0 до 15,0 дптр). Острота зрения с оптимальной коррекцией у 15 больных была равна 0,8—1,0 и у одного ребенка с врожденной высокой прогрессирующей близорукостью — 0,4. Изменения на глазном дне у этих больных, как правило, отсутствовали. Во второй (старшей) возрастной группе были больные с высокой прогрессирующей осложненной близорукостью от 12,0 до 29,0 дптр (в среднем 19,5 дптр) и остротой зрения от 0,02 до 0,5 (в среднем 0,18). У всех больных показанием к применению ИСУ явилось прогрессирование близорукости на 0,75—1,5 дптр в год, сопровождавшееся удлинением переднезадней оси глаза.
Непосредственно после введения вспенивающейся полимерной композиции появлялся отек конъюнктивы в месте введения, в течение 10—15 мин ощущалась болезненность в этом месте. Легкий отек конъюнктивы удерживался в течение 2—3 сут. Трудоспособность больных не нарушалась. Специального лечения не требовалось.
У всех больных при наблюдении до 2 лет отмечена стабилизация близорукости. Острота зрения, коррекция и рефракция, как правило, не изменялись. У 9 больных отмечено повышение остроты зрения с оптимальной коррекцией на 0,1—0,15, у 4 больных — снижение оптимальной коррекции на 0,5—2,0 дптр и у 4 больных — уменьшение статической рефракции на 0,5—1,5 дптр. Ни у одного больного после инъекции не наблюдалось каких-либо осложнений и ухудшения функциональных показателей (остроты зрения и поля зрения) в течение всего периода наблюдения.
Таким образом, клиническая апробация нового безоперационного метода укрепления склеры при прогрессирующей близорукости подтвердила его высокую эффективность, простоту и безопасность, что позволило рекомендовать этот метод для широкого применения.
ИСУ является профилактической процедурой. Ее задача — предупредить прогрессирование миопии и возникновение осложнений. В связи с этим основное показание к применению ИСУ— это близорукость средней или высокой степени при еще полностью сохранившихся зрительных функциях и градиенте прогрессирования 0,5—1,0 дптр в год, особенно у детей и подростков.
ИСУ производят следующим образом. После предварительной подготовки (внутримышечная инъекция 0,7 мл 2 % раствора промедола и 1,0 мл I % раствора димедрола) больного укладывают в горизонтальное положение и инсталлируют 2—3 капли 1 % раствора дикаина в конъюнктивальную полость. Веки расширяют с помощью блефаростата. В верхненаружном квадранте глазного яблока двумя пинцетами захватывают эписклеральные ткани (конъюнктиву и тенонову капсулу), образуя складку, концентричную лимбу, и одновременно поворачивая глазное яблоко книзу и кнутри. В основание складки под тенонову капсулу вкалывают иглу для внутримышечных инъекций, изогнутую по форме глазного яблока. При этом острие иглы направлено кнаружи. Иглу продвигают так, чтобы она свободно скользила по поверхности склеры, а затем ее изогнутый конец поворачивают в направлении заднего полюса глаза. Удерживая глаз и иглу в указанном положении, надевают на иглу шприц с жидкой полимерной композицией, которую готовят ex tempore и в которую перед инъекцией добавляют каплю активатора. Композицию вводят в задненаружном квадранте глазного яблока. Иглу извлекают. Повязку не накладывают.
↑ Последовательность использования склероукрепляющих методов
Детям от 8 лет с прогрессирующей близорукостью средней степени и подросткам с высокой миопией при годичном градиенте прогрессирования не выше 1,0 дптр в качестве первого этапа показана ИСУ. Инъекцию производят сначала на одном глазу, через полгода (при наличии эффекта) — на втором. В случае дальнейшего роста миопии не более чем на 0,5 дптр в год ИСУ повторяют. Возможно проведение до 3 ИСУ на каждом глазу при наличии эффекта от инъекции — временном торможении прогрессирования и заметном снижении его темпов Если на любом этапе лечения годичный градиент прогрессирования увеличивается вновь до 1,0 дптр и более, производят склеропластику.
Детям и подросткам с высокой близорукостью при годичном градиенте прогрессирования более 1,0 дптр на первом этапе производят склеропластику сначала на одном глазу, через год — на другом.
Таким образом, у детей с прогрессирующей близорукостью, особенно при высокой ее степени и темпе прогрессирования, склероукрепляющее лечение должно проводиться в несколько этапов, поскольку однократное воздействие обеспечивает лишь временную стабилизацию процесса.
Повторные склероукрепляющие вмешательства целесообразны и эффективны; они снижают скорость послеоперационного прогрессирования близорукости в 2 раза и полностью прекращают его у части больных.
Разработанная система склероукрепляющего лечения прогрессирующей близорукости у детей и подростков позволяет выбрать нужную тактику и обеспечивает в итоге лучшие результаты лечения у наиболее тяжелого контингента больных: частота возникновения периферических витреохориоретинальных дистрофий снизилась в 2,5 раза по сравнению с контрольной группой и в 1,7 раза по сравнению с результатами однократной склеропластики [Тарутта Е. П., 1993].
----
Статья из книги: Близорукость | Э. С. Аветисов


Комментариев 0