Склероукрепляющее лечение и профилактика осложнений прогрессирующей близорукости

Описание
Ведущая роль склеры в патогенезе высокой прогрессирующей и осложненной миопии ставит ее в положение органа-мишени в плане не только различных неблагоприятных влияний внешней среды, но и возможных лечебных воздействий. Поскольку глубокие триггерные механизмы патологических нарушений в склеральной консуле до сих пор далеки от выяснения, разработка методов ее медикаментозного лечения остается, безусловно, важной и перспективной, но скорее стратегической задачей. Наибольшее развитие на сегодняшний день получили различные хирургические и полухирургические способы укрепления склеры.С момента экспериментальной разработки склеропластики М.М.Шевелевым в 1930 г. и первого ее клинического применения за рубежом и в нашей стране было предложено несколько десятков методик операций, различающихся большей или меньшей сложностью и объемом вмешательства, используемым пластическим материалом и способами его консервации, биомеханическим состоянием, формой, величиной, характером расположения и фиксации трансплантатов к склере, сочетанием в ряде случаев склеропластики с дополнительными вмешательствами: реваскуляризуюшими, гипотензивными. Особенно интенсивно это направление развивалось в СССР, где склеропластическая хирургия была связана с именами известных офтальмологов B.C. Беляева, Т.И. Брошевского, М.В. Зайковой, H.H.
Пивоварова, Э.С. Аветисова, H.A. Пучковской, Е.И. Ковалевского и многих других. Зарубежные клинические исследования по этой проблеме, хоть и появились раньше, однако остались малочисленными. Возможно, здесь сыграла роль традиционно профилактическая направленность отечественной медицины: склеропластические операции, имеющие своей целью прекращение дальнейшего прогрессирования миопии и предотвращение ее осложнений, являются по сути профилактическими.
Многообразие методик склероукрепляющих операций диктует необходимость их классификации. В последние годы в отечественной литературе наиболее принято деление методов склеропластики на 2 основные группы: большие и малые вмешательства. К первым относят все виды операций с использованием цельных трансплантатов, ко вторым — введение под тенонову капсулу на поверхность склеры различных биовзвесей, измельченных тканей, жидкостей.
В свою очередь в первой группе отчетливо выделяются 2 подгруппы: операции бандажирующего типа и упрощенные. Бандажируюшими называют методики склеропластики с использованием Y- и Х-образных трансплантатов, а также появившиеся позже операции с применением трансплантатов в виде лент, располагаемых по вертикальному, горизонтальному или косому меридиану. Во всех случаях трансплантат проходит через задний полюс глаза, располагаясь своей средней частью в проекции макулы, а свободные концы его фиксируются кпереди от экватора в противоположных меридианах. При этом, как правило, добиваются некоторого натяжения трансплантата и плотного контакта его со склерой.
С этих методик начиналась клиническая разработка склеропластики как метода лечения и профилактики миолической стафиломы. Техническая сложность этих способов, особенно на этапах проведения трансплантатов через задний полюс с помощью специальных крючков, натяжения их концов, расслаивания склеры, явилась причиной нечастых, но серьезных осложнений, таких как давление, трансплантатом вортикозных вен, зрительного нерва, отслойка сетчатки, увеит, кровоизлияния на глазном дне, гемофтальм, перфорация склеры инструментом при проведении лоскутов или формировании интрасклеральных тоннелей для их фиксации, глаукома. Это послужило толчком к разработке упрощенных небандажирующих методик, когда один или несколько лоскутов фиксируют у переднего конца к склере в параэкваториальной зоне, а свободные концы их располагают на ее поверхности в направлении заднего полюса. При применении операций этой группы осложнения отмечаются редко и, как правило, не бывают связаны со снижением функций: перфорации склеры иглой при подшивании трансплантатов, хенониты, краевые эрозии роговицы, реже нагноение трансплантата, глазодвигательные нарушения. Последние, по-видимому, связаны с деструктивными и склеротическими изменениями в прилежащих к трансплантату экстраокулярных мышцах. С целью еще большей безопасности операций предлагают бесшовную фиксацию лоскутов, для чего их края заправляют под мышцы или делают на них насечки в виде елочки.
В качестве пластического материала при больших операциях используют аллосклеру, роговично-склеральный трансплантат, брефосклеру, амнион, твердую мозговую оболочку, алло- и аутофасцию, аллосухожилие, пластинку аутохряща, ксенотрансплантат из перикарда коров, а также (в последние годы) синтетические материалы — гемостатическую губку, пористый силикон. лаведпетии и мерсиленовые сетки.
Пожалуй, оптимальными из группы больших склеропластик являются упрошенные варианты бандажирующего типа: методики Снайлера — Томпсона, Аветисова — Тарутты, Н.А. Пучковской и соавт. В этих случаях трансплантаты проходят через задний полюс, укрепляя область развития стафиломы, и в то же время не таят в себе опасности серьезных осложнений.
Еще более простыми и малотравматичными являются разработанные в последние 20 лет операции укрепления склеры различными биовзвесями, вводимыми в теноново пространство с помощью канюли через очень малые разрезы конъюнктивы и теноновой капсулы. После первого применения с этой целью взвеси аллосклеры и аллохряща в физиологическом растворе были предложены паста из аллохряща на дексазоне и канамицине, измельченный аутохрящ, диспергированный сухожильно-фасциальный комплекс «Аллоплант», брефохрящ, взвесь плаценты, смесь аутокрови с гидрокортизоном, бинарный раствор плазмы и тромбина — фибринобразуюших компонентов крови, взвесь талька в сочетании с медикаментами, гелеобразный коллаген.
[banner_centerrs] {banner_centerrs} [/banner_centerrs]
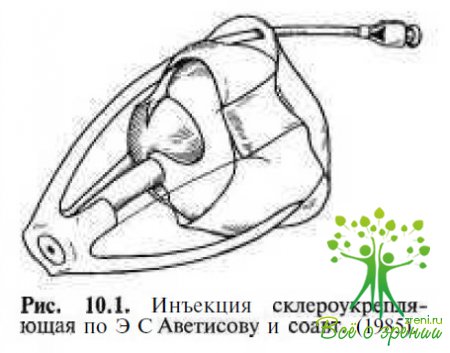
Э.С. Аветисовым и соавт. (1985) разработан безоперационный способ укрепления склеры путем инъекции в теноново пространство вспенивающейся полимерной композиции (инъекция склероукрепляющая — ИСУ), образующей после полимеризации на поверхности склеры упругий пеногель (рис. 10.1).
Длительные (более 2 лет) экспериментальные исследования показали, что введенный пеноматериал, постепенно медленно рассасываясь, стимулирует рост соединительной ткани на поверхности склеры; при этом повышаются ее прочностные показатели и снижается растяжимость. В последнее время для стимуляции биосинтеза коллагена склеры и увеличения числа поперечных связей, стабилизирующих коллагеновое волокно, предложено включать в состав композиции для ИСУ компонент соединительной ткани — препарат хонсурид. Показана в эксперименте эффективность самостоятельных повторных инъекций хонсурида в теноново пространство и под конъюнктиву.
Из осложнений при малоинвазивных вмешательствах отмечались только хемоз конъюнктивы, аллергические реакции, а также в редких случаях диплопия и отек сетчатки в макулярной зоне. Преимуществом малой склеропластики в детской практике является возможность се проведения под местной, а нередко только под эпибульбарной анестезией, что делает эти операции еще более безопасными.
Основными требованиями, предъявляемыми к любому лечебному воздействию, являются его безопасность и эффективность. Если безопасность склероукрепляюших воздействий благодаря усилиям отечественных офтальмологов в настоящее время уже не вызывает сомнений, то их эффективность остается, а вернее сказать, становится предметом дискуссий.
Если 30 лет назад, когда начиналось широкое внедрение склеропластики в клиническую практику, многие считали проблему прогрессирующей близорукости почти решенной, то в последнее время нередкие сообщения о прогрессировании миопии и развитии ее осложнений в отдаленном периоде после операции привели к разочарованию и даже к отказу от склеропластики. Анализ многочисленных данных литературы, а также результатов собственных 20-летних наблюдений позволяет сделать следующие обобщения, касающиеся механизмов действия, а также «срыва» действия склеропластики.
Во-первых, отдаленные результаты при применении всех без исключения методик склеропластики уступают ближайшим.
Во-вторых, результаты и больших (цельными трансплантатами), и малых (взвесями, жидкостями, измельченными тканями) склероукрепляющих вмешательств у детей в возрасте до 12 лет хуже, чем результаты этих же операций у больных более старшего возраста.
В-третьих, все большие методики эффективнее малых: торможение прогрессирования близорукости в 90—100 % оперированных глаз наблюдается в первом случае в течение года, а во втором — полугола после операции. Наконец, у 65-70 % больных в течение этого же срока отмечается торможение прогрессирования, а также улучшение гемодинамики и функционального состояния неоперированных парных глаз.
Все перечисленные факты сегодня находят объяснение с позиций признания единых механизмов действия склеропластики, заключающихся в повышении биомеханической стабильности склеры, тканевом биостимулирующем действии трансплантата, улучшении гемодинамики глаза. Эти процессы обеспечиваются местной клеточной и тканевой реакцией на введенную аллоткань, которая завершается приблизительно через 6 мес (после «малых») — 12 мес (после «больших» операций) полным замещением трансплантата собственной тканью и, таким образом, утолщением склеры в месте его расположения. При этом стихает сосудистая реакция, вызванная выбросом вазоиктивных веществ, запустевают и редуцируются новообразованные сосуды склеры, возвращаются почти к исходному уровню гемодинамические и функциональные показатели оперированных глаз.
Единственным результатом склеропластики в отдаленные сроки остается увеличение толщины и плотности склеры. Но и этот эффект может со временем ослабевать. Как показали проведенные в Московском НИИ глазных болезней им. Гельмгольца исследования, акустическая и рентгенооптическая плотность склеры, достоверно повышающаяся после склеропластики до нормальных или близких к ним значений, в отдаленном периоде у части детей и подростков снижается.
Именно у этих пациентов возобновляется прогрессирование близорукости. Очевидно, в случае резкого нарушения биомеханических свойств склеральной капсулы однократная склеропластика не всегда приводит к их полному восстановлению. Помимо того, известно, что новообразованная соединительная ткань и отдаленные сроки после укрепления склеры подвергается частичной резорбции.
Таким образом, в самом механизме действия склеропластики заложен максимум ее эффективности в течение первого года, благотворное воздействие на состояние парного глаза в течение того же времени и возможность дальнейшего прогрессирования близорукости Эффективность склеропластики зависит от ряда факторов.
Это, во-первых, исходное состояние. склеры в пациента, определяемое как по косвенным признакам (время возникновения миопии, се степень, скорость прогрессирования, длина ПЗО, наследственный фон, общее состояние здоровья), так и с помощью разработанных в нашем институте методов прижизненного исследования склеры по ее акустической и рентгснооптической плотности.
Во- вторых, причины неудовлетворительного исхода склеропластики могут быть заключены в неадекватности самого воздействия: величине, форме, биомеханическом состоянии трансплантата, определяющих длительность его биодеструкции и замещения собственной тканью хозяина, плотности контакта и прочности сращения трансплантата со склерой реципиента, определяющих в итоге биомеханическую устойчивость формирующегося комплекса склера — трансплантат.
Наконец, впервые на основе морфологического исследования трансплантированной склеры в разные сроки после склеропластики подтверждена высказанная еще B.J Curtin (1987) возможность «вовлечения» трансплантата в болезненный процесс склеры пациента, обусловленная миграцией в ходе его приживления из миопической склеры хозяина фибробластов, синтезирующих дефектный коллаген.
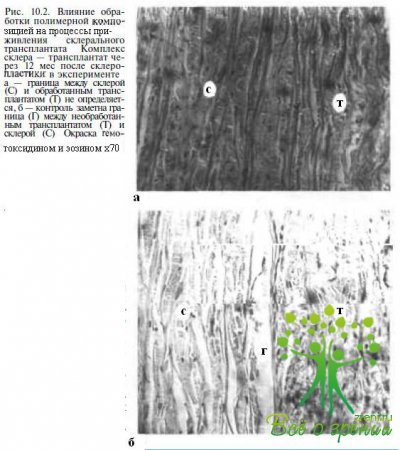
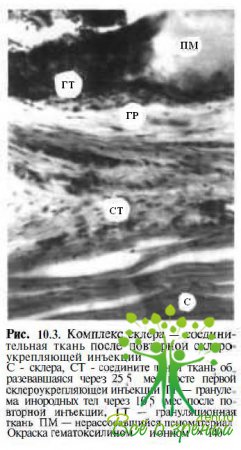
Очевидно, что некоторые из перечисленных факторов недоступны для внешних воздействий, в то время как влияние на другие факторы открывает перспективы повышения эффективности склеропластики. Это касается прежде всего увеличения площади транс-плантата, его специальной обработки, обеспечивающей повышение прочностных показателей, плотности контакта со склерой и надежности фиксации, активации процессов биосинтеза коллагена, стимуляции приживления и новообразования сосудов в формирующемся комплексе (рис. 10.2 и 10.3).
В последние 15 лет такие методики (ИСУ с купиром и укрепление склеры трансплантатом, обработанным полимерной композицией), разработанные в Московском НИИ глазных болезней им. Гельмгольца, показали более высокую клиническую эффективность но сравнению с базовыми методами. Доказанная морфологически возможность замещения природных биодеградирующих материалов дефектным коллагеном реципиента обосновывает целесообразность включения в состав трансплантата нерассасывающихся синтетических тканей и волокон.
С этой целью были предприняты попытки использования силиконовой ревины, в эксперименте апробированы гидрофильные акрилаты и дакроновые протезы, разработано укрепление склеры в клинике лавсановым эксплантатом «Тексплант». Авторы последнего изобретения сообщают о его биологической инертности и высокой (97 %) эффективности в течение 5—6 лет наблюдения, однако в более поздних сообщениях указывается, что стабилизация миопии в отдаленные сроки после склеропластики по Н.Н.Пивоварову с использованием тексплантата составила 75 %. Для повышения эффекта предложено сочетать операцию с рифлением склеры.
Серия трансплантатов с включением нерезорбирующихся волокон: «армированный» (полоска аллосклеры, прошитая в продольном и поперечном направлениях нитями капрона), мерсиленовый (сетчатый трансплантат, сплетенный из шовного материала мерсилена), комбинированный (сплетенный из сочетания капроновых и коллагеновых нитей) — была разработана в эксперименте и апробирована в клинике.
Наибольшая клиническая эффективность как в ближайшем (укорочение ПЗО, повышение реографического коэффициента, запаса относительной аккомодации, оптимальной корригированной остроты зрения), так и в отдаленном (стабилизация рефракции и ПЗО в 92 % случаев в течение 3 лет, наиболее значительное повышение АПС в эти же сроки) послеоперационном периоде отмечена при использовании комбинированного трансплантата.
Это объясняется сочетанным биомеханическим и биостимулирующим действием материала. Предполагают, что продукты распада коллагена оказывают стимулирующее влияние на образование соединительной ткани, активно прорастающей между синтетическими волокнами, образуя биомеханически устойчивый комплекс, и в то же время процессы резорбции коллагеновых нитей сопровождаются теми же тканевыми, клеточными, сосудистыми реакциями, которые присущи аллосклеропластике и оказывают трофическое действие на оболочки глаза.
Однако описанные новые способы укрепления склеры, несмотря на их более высокую эффективность, все же не могут обеспечить 100 % стабилизацию миопии. У части больных речь идет лишь о более длительном периоде торможения, после которого возобновляется прогрессирование близорукости. Как правило, это дети с рано приобретенной или врожденной быстро прогрессирующей близорукостью. Очевидно, следует признать, что в настоящее время не существует метода, способного прекратить прогрессирование миопии у определенной группы больных. Речь должна идти не о методе, а о системе повторных склероукрепляющих вмешательств, предусматривающей определенную последовательность и преемственность методов.
Такая система 15 лет назад была разработана в Московском НИИ глазных болезней им. Гельмгольца и внедрена в клиническую практику.
В обосновании целесообразности и выработке тактики повторных склероукрепляющих вмешательств мы исходили из следующих предположений.
Если реактивные процессы в тканях глаза после трансплантации различных тканей тормозят прогрессирование близорукости в течение какого-то времени, целесообразно вызвать их повторение. Вместе с тем, если необходимый уровень биомеханической устойчивости склеры не был достигнут после склеропластики или вновь снизился в отдаленные сроки после нее, следует дополнить этот эффект повторным вмешательством.
Эти предположения нашли подтверждение в эксперименте, показавшем, что повторное вмешательство ИСУ, проведенное через 12—15 мес после первой инъекции, вновь повышает снижающийся к этому времени уровень биосинтеза коллагена, активирует новообразование и тормозит начавшиеся процессы резорбции соединительной ткани, т.е. продлевает и повышает эффект первого вмешательства.
Выбор метода повторного укрепления склеры в отличие от первого воздействия определяется не только состоянием пациента, но и возможностью осуществить ту или иную операцию, что зависит от характера предыдущего вмешательства. Повторная склеропластика может быть затруднена вследствие Рубцовых сращений конъюнктивы и теноновой капсулы со склерой пациента и старыми трансплантатами. Очевидно, что все виды малой склеропластики с введением измельченных тканей или жидкостей через минимальные разрезы, как правило, не препятствуют повторным операциям и не ограничивают в выборе метода.
По этой причине им следует отдавать предпочтение на первом этапе склероукрепляющего лечения, если только чрезмерное нарушение опорных свойств склеры не делает такое вмешательство бесперспективным. Разработанная система склероукрепляющих воздействий и в целом сформированная в отделе охраны зрения детей и подростков Московского НИИ глазных болезней им. Гельмгольца под руководством проф. Э.С.Аветисова идеология лечения и профилактики осложнений при прогрессирующей близорукости заключаются в следующем.
При прогрессирующей миопии слабой степени пациентам любого возраста показано систематическое проведение медикаментозного и функционального (аппаратного, тренировочного) лечения. Выбор методов такого лечения широк, однако, исходя из позиций трехфакторной теории Э.С.Аветисова, они должны быть направлены прежде всего на коррекцию состоянии аккомодации, гемодинамики, обменных процессов в склере.
Детям с прогрессирующей миопией средней степени, а также подросткам с миопией высокой степени при величине годичного градиента ее прогрессирования (ГГП) не выше 1,0 длтр показаны малая склеропластика или ИСУ сначала на одном глазу, а через полгода (при наличии эффекта) — на другом. В случае дальнейшего роста миопии на 0,5-0,75 дптр в год ИСУ повторяют в той же последовательности. Возможно проведение до 3 малых вмешательств на каждом глазу при наличии эффекта: временного торможения прогрессирования или заметного снижения его темпов. Если на любом этапе лечения ГГП увеличивается вновь до 1,0 дптр или более, производят склеролластику.
Детям и подросткам с миопией высокой степени при ГГП выше 1,0 дптр на первом этапе показана склеропла- стика сначала на одном глазу, через год — на другом. В случаях дальнейшего прогрессирования производят повторное вмешательство: при ГГП ниже 1,0 дптр — малое (ИСУ), в остальных случаях — склеропластику. При этом, если в ходе операции выясняется, что первый трансплантат прочно сращен со склерой, то новый укладывают на свободные участки и фиксируют швами. Если лоскуты не сращены со склерой, образуют складки, дупликатуры, рыхло соединяются со склерой не на всем протяжении или вообще располагаются поверх теноновой капсулы под конъюнктивой (нередкая ошибка выполнения склеропластики по методике Н.Н.Пивоварова), то их целесообразно удалить.
Взрослым пациентам с высокой прогрессирующей близорукостью, длиной переднезадней оси глаза более 27,0 мм и признаками формирования центральной хориоретинальной дистрофии (ЦХРД) рекомендуется склеропластика одним из « бандажирующих» методов (например, по Снайпер — Томпсону или Австисову — Тару. с обязательным включением в состав трансплантата нерассасывающихся синтетических материалов.
В последние годы исследовано влияние плазмохимической обработки синтетических материалов на процессы их приживления в эксперименте и стабилизацию миопии в клинике. Установлено, что обработка синтетического материала в низкотемпературной плазме разряда приводит к образованию на его поверхности модифицированного слоя, обладающего рядом полезных свойств (снижение токсичповышение смачиваемости и др.) и способствующего повышению биосовместимости трансплантата. Клиническая апробация плазменномодифицированных трансплантатов показала их безопасность, ареактивность и высокую эффективность в стабилизации прогрессирующей близорукости.
Разработанная система повторных склероукрепляющих вмешательств применяется нами в течение ПОСДСД- них 15 лет. Длительные наблюдения за больными (более 500 пациентов, получивших в течение указанного периода по 2—3 повторных больших и малых вмешательства на каждом глазу) показали высокую эффективность этой системы не только в снижении скорости прогрессирования близорукости и степени окончательно формирующейся рефракции, но и, что особенно важно, в профилактике возникновения и прогрессировала миопических хориоретинальных осложнений.
Так частота возникновения и прогрессирования периферических витреохориоретинальных дистрофий (ПВХРД) у детей, подростков и молодых людей снизилась в 2,5 раза по сравнению с показателями у неоперированных больных и в 1,7 раза по сравнению с результатами однократной склеропластики. Следует особо подчеркнуть, что в течение 15 лету наблюдаемых нами больных, получивших повторные склероукрепляющие воздействия и, при показаниях, профилактическую лазеркоагуляцию сетчатки., ни в одном случае не возникла отслойка сетчатки.
Отмечено тормозящее влияние склероукрепляющих операций и на развитие ЦХРД. Так, из 37 наблюдаемых нами больных с врожденной миопией выше 10,0 дптр, длиной ПЗО более 28,0 мм и отсутствием ЦХРД до операции в течение 5—11 лет после операции дистрофические изменения в макулярной области оперированных глаз возникли у 5 (13,5 %): в 4 глазах отмечалась сухая форма ЦХРД и в 1 — геморрагическая. На парных неоперированных глазах дистрофические изменении за это же время появились а 8 случаях (21.6 %): сухая форма в 4, геморрагическая в 3, пятно Фукса в 1.
Следует подчеркнуть, что из 5 пациентов с развившимися на оперированных глазах ЦХРД только у 2 операция была произведена в детском возрасте (в 12 и 14 лет), а остальные были старше 10 лет. Поскольку дистрофические изменения в заднем полюсе при патологической миопии развиваются, как правило, в конце 3-го — начале 4-го десятилетия жизни, а условия для их развития в виде деформации оболочек, расстройства гемоциркуляции, нарушения витреоретинальных взаимоотношений складываются гораздо раньше, в период усиленного прогрессирования близорукости, очевидно, что для профилактики ЦХРД (так же, как и ПВХРД) склеропластика должна проводиться именно в этот период.
По нашим наблюдениям, изложенным частично в главе 7, наиболее активно прогрессирование и увеличение ПЗО происходит в возрасте от 11 до 14 лет. При распределении последовательности повторных вмешательств мы рекомендуем проведение больших операций именно в этом возрасте: в 10—11 лет (в зависимости от формы миопии и темпов прогрессирования) на одном глазу и в 12—13 лет на другом.
Следует отметить, что характерное для прогрессирующей осложненной миопии запаздывание дистрофического процесса по отношению к процессу аксиального удлинения глазного яблока в значительной степени затрудняет объективную оценку эффективности склеропластики в его профилактике. С одной стороны, далеко не всякая прогрессирующая близорукость, к счастью, становится осложненной, с другой — для суждения об антидистрофическом действии склеропластики ее следует производить в детском возрасте, а эффект оценивать через 20 лет, что является чрезвычайно сложным с организационной точки зрения. Этим, очевидно, и объясняется противоречивость сообщений.
Одни авторы считают эти операции действенным средством профилактики и лечения при осложненной миопии и при этом отмечают, что улучшение клинико-функциональных показателей сетчатки после склеропластики. более выражено при начальных изменениях глазного дна, чем при IV—V стадии хориоретинальных дистрофий. Повышение зрительных функций при этом объясняют улучшением трофики тканей глаза и обратным развитием нестойких хориоретинальных изменений.
Отмечается положительная динамика в состоянии глазного дна при макулярных геморрагиях, макулярных дегенерациях и даже сформировавшемся пятне Фукса. Это дало толчок к разработке на основе склеропластики хирургических методов лечения дистрофий сетчатки как мионической, так и другой этиологии. При этом склеропластику нередко сочетают с реваскуляризацией и введением лекарственных веществ в теноново или супрахориодальное пространство.
Эти методики особенно активно разрабатывают на основе так называемой трофической коллагено-склеропластики. В качестве лекаре 1- венных препаратов предлагают дексаметазон, фибринолизин, гормон передней доли гипофиза пролактин, сосудорасширяющие препараты, макроэрги, витамины, тауфон и др.
В то же время отмечают временный характер положительного влияния склеропластики на течение ЦХРД, дальнейшее прогрессирование дистрофического процесса, рецидивы кровоизлияний и даже ухудшение состояния глазного дна в результате склеропластики при транссудативно-геморрагической форме ЦХРД. Безусловно, для объективной оценки возможностей склеропластического лечения в снижении тяжести течения столь грозного и до сего дня неизлечимого заболевания, как дегенеративная миопия, необходимы длительные проспективные наблюдения за строго отобранными с учетом известных факторов прогноза репрезентативными группами оперированных и неоперированных больных.
Ближе всех к решению подобной задачи подошли A.B.Свирин и Ш.Осман (2001). Используя разработанную систему мониторинга, критерии прогноза осложненного течения миопии и накопленный творческим коллективом за 20 лет клинический материал, авторы смогли проследить отдаленные результаты склеропластики в течение 8—12 лет и провести сравнительную оценку состояния глазного дна оперированных и неоперированных пациентов. Контрольная группа больных была отобрана и прослежена в то же время, в тех же условиях и по тем же критериям, что и основная.
Отмечено, что на фоне высокого стабилизирующего рефракцию эффекта (83—86 %) коллагеносклеропластика приводит к уменьшению частоты и тяжести развития ЦХРД и ПВХРД, но не устраняет и не предотвращает их полностью. Антидистрофический эффект тем не менее очевиден: различные осложнения, включая кровоизлияния в сетчатку и стекловидное тело, переход в следующую стадию дистрофических изменений в макулярной области, возникновение новых зон ПВХРД и разрывов отмечались у 4,6 % оперированных пациентов при миопии 9,0—14,0 дптр, 14,3 % при миопии 15,0—23,0 дптр (в контроле эти показатели составляли соответственно 16,7—35%,). К сожалению, вес пациенты в указанном наследовании к моменту первого осмотра и проведения операции были в возрасте от 18 лет и старше (средний возраст около 27 лет).
О высоком стабилизирующем эффекте бандажирующей склеропластики у взрослых, но без анализа состояния глазного дна сообщают ПА.Гончар и соавт. (2001) при сроках наблюдения до 10 лет.
Подводя итог накопленному коллективному опыту склеропластического лечения прогрессирующей миопии, следует признать, что, хотя эти операции не являются панацеей от «подлинного социального зла», каковым является осложненная близорукость, они все же способны затормозить процесс растяжения оболочек, замедлить темп прогрессирования, обеспечить подчас достаточно длительный период стабилизации и, таким образом, отсрочить, облегчить или даже предотвратить развитие дистрофических осложнений.
На настоящем уровне наших знаний оптимальным алгоритмом лечения являются повторные склероукрепляющие вмешательства, производимые с учетом известных возрастных тенденций в течении прогрессирующей близорукости и прогностических факторов развития осложнений. Раскрытие самых тонких механизмов патоногенеза осложненной (дегенеративной, патологической) миопии поможет разработать методы целенаправленной и, возможно, безоперационной коррекции нарушенных свойств склеры и других оболочек глаза.
Статья из книги: Зрительные функции и их коррекция у детей | С.Э. Аветисов, Т.П. Кащенко, А.М. Шамшинова.


Комментариев 0