Орган зрения при сахарном диабете (Часть 1)

Описание
Общая характеристика заболеваний органа зрения при эндокринной патологии
Эндокринная система находится в тесной взаимосвязи со всеми другими системами и органами человеческого организма, оказывая большое влияние на их жизнедеятельность. Зрительный анализатор не является исключением, подвергаясь изменениям при всех болезнях желез внутренней секреции.
Несмотря на то, что эндокринный аппарат функционирует в стройной взаимозависимости и нарушение деятельности одной из желез неизменно вызывает цепную реакцию, приводящую к нарушению интимных инкреторных процессов во всей системе, при определенных нозологических формах эндокринной патологии глазная симптоматика весьма специфична.
Иногда она служит первым сигналом начинающегося заболевания, (в частности, при сахарном диабете, некоторых поражениях гипофиза), помогая своевременной постановке диагноза основной болезни, суждению о тяжести ее проявления, прогнозе. Своевременная диагностика изменений глаз также является залогом успешной борьбы со слабовидением и слепотой при заболеваниях эндокринной системы.
В основе патологических изменений лежит генерализованное поражение сосудистой системы организма, т. е. универсальная макро- и микроангиопатия. Это подтверждается результатами исследования ткапей различных органов при помощи световой и электронной микроскопии, позволяющими выявить характерные для диабетической ангиопатии изменения в почках, сетчатке, конъюнктиве, мышцах, плаценте, ткани периферической и центральной нервной системы, поджелудочной железе, слизистой оболочке желудка и кишечника.
Универсальное поражение сосудов является причиной более частого возникновения при диабете по сравнению со здоровыми лицами различных заболеваний сосудистого генеза — инсульта, инфаркта миокарда, гангрены нижних копечностей, желудочных и кишечных кровотечений. Особенно часто поражаются сосуды почек и глаз. По данным, эти изменения встречаются в 78и 98,9%случаев, что нередко приводит больных к инвалидизации.
Распространенность сахарного диабета, частота и тяжесть возникающих осложнений придали ему характер социальной болезни, в связи с чем в 1965 г. при ВОЗ был создан Комитет экспертов по сахарному диабету. В нашей стране осуществляется государственная программа в области изучения распространенности сахарного диабета.
Ведутся поиски новых, более эффективных, инсулинов, проводятся важные исследования по трансплантации поджелудочной железы, пересадке панкреатических островков. Весьма перспективными представляются исследования в области генной инженерии, преследующей цель обеспечения синтеза инсулина. Целью научных исследований является изыскание возможностей наиболее эффективного лечения, а также своевременной профилактики диабета и его сосудистых проявлений.
Изменения век и конъюнктивы.
Больные сахарным диабетом склонны к воспалительным заболеваниям век в виде экземы кожи, блефарита, блефароконъюнктивита, халазиона. Большая частота при сахраном диабете заболеваний кожных покровов объясняется пониженной сопротивляемостью организма к различного рода эндогенным и экзогенным инфекциям и интоксикациям.
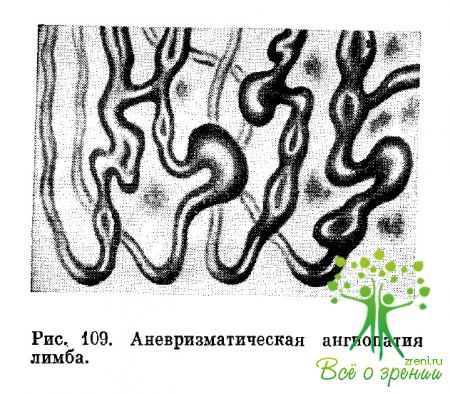
Изменения конъюнктивы глазного яблока можно разделить на две категории. Наиболее информативными для диагностики и оценки течения как самого диабета, так и его осложнений считаются изменения микрососудов лимбальной области. Для них при биомикроскопическом исследовании характерны своеобразные варикозные расширения венозной порции концевых капилляров (рис. 109).
Одновременное расширение венул при диабете обнаружено и в других тканях, например в сетчатке, слизистой оболочке щеки, ногтевом ложе пальцев кисти и стопы. Увеличение диаметра венул конъюнктивы сочетается с повышением индекса, отражающего соотношение диаметра венул и артериол. Расширение венул лимба обнаруживается при латентном диабете.
Этот признак является одним из ранних симптомов заболевания. В дальнейшем, по мере прогрессироваиия основного процесса, происходят выпячивание стенки венулы и формирование микроаневризмы.
В ткани конъюнктивы, в непосредственной близости от микро-аневризмы, можно видеть точечные кровоизлияния или диффузную имбибицию тканевых структур элементами крови. Морфологические изменения, свойственные микроангиопатии, выражаются в утолгцении базальной мембраны венул вследствие накопления в ней ШИК- положительных веществ и изменений микроциркуляции.
Данная терминология (ПАС-положительное вещество) ведет свое начало пическими исследованиями, в частности со способом окраски тканей. Морфологической субстанцией ПАС-положительных элементов являются холестериновые и белковые фракции, мукополисахариды.
Нарушение микроциркуляции в сосудах, бульбарной конъюнктивы впервые обнаружил I. Вйге1 (1975) при использовании стереоскопического микроскопа. У больных сахарным диабетом автор отметил появление внутрисосудистой агрегации эритроцитов, сочетавшейся с ретино- или с нефропатией на фоне длительно существующего диабета.
При анализе результатов биомикроскопических исследований сосудов лимба и сетчатки у больных сахарным диабетом установлено, что лимбальные изменения предшествуют сетчаточным. Это имеет несомненно прогностическое значение. Что касается многочисленных дегенеративных изменений, то они чаще всего локализуются в конъюнктиве открытой части глазного яблока, т. е. в пределах глазной щели, как в наружных, так и во внутренних отделах.
Ее проявление возможно либо в виде отдельных мелких желтовато-белых липоидных вкраплений, что патогномонично для сахарного диабета, либо в виде более крупных рыхлых очагов аморфного вида. Чаще наблюдается пропитывание ткани конъюнктивы глазного яблока аморфным веществом беловато-желтоватого цвета.
Границы участков пропитывания нечеткие, расплывчатые. Биомикроскопически указанные элементы в конъюнктиве хорошо видны при исследовании в темном поле. Гистологическое исследование таких участков пропитывания показало, что они также являются ПАС-положительным веществом, т. е. в основе своей состоят главным образом из холестериноподобных элементов и белка.
От преобладания в этих аморфных отложениях белка или холестерина зависит их цвет (белый при большем количестве белка, желтый — холестерина). Значительное пропитывание ткани конъюнктивы белком почти всегда сочетается с высоким его содержанием в моче и считается плохим прогностическим признаком в общей оценке течения сахарного диабета.
Для случаев превалирования в окраске патологически измененного участка конъюнктивы желтого цвета характерно высокое содержание в крови холестерина (20,8—22,4ммоль/л) и его фракций, в частности??-липопротеидов. Данный факт можно расценивать как один из косвенных признаков, указывающих на необходимость включения в терапию сахарного диабета медикаментозных комплексов с целью более активной нормализации нарушенного жирового или белкового обмена.
Изменения роговой оболочки
встречаются у 20% больных сахарным диабетом и, как правило, не приводят к значительному снижению остроты зрения. Характер этих изменений дистрофический. Клинические проявления патологии весьма разнообразны. Наблюдаются кератопатия, дегенерация роговицы (эпителиальная кератодистрофия, сухой кератоконъюнктивит, центральная или периферическая дегенерация паренхимы, отложение зерен пигмента на эндотелии.
По нашим наблюдениям, наиболее часто развивается эпителиальная точечная кератопатия, сопровождающаяся значительным снижением чувствительности ткани. Высказывается предположение, что перечисленные изменения роговой оболочки у больных сахарным диабетом служат проявлением полиневропатии, возникающей вследствие нарушения микроциркуляции и метаболических сдвигов.
Изменения сосудистой оболочки.
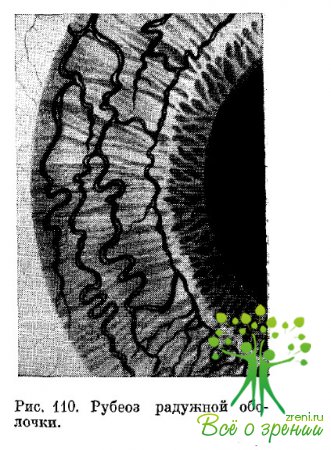
У больных сахарным диабетом такие изменения могут быть как сосудистого, так и воспалительного и дистрофического происхождения. Появляется и довольно быстро развивается сеть мелких новообразованных сосудов. Такое состояние диагностируется как рубеоз радужки (рис. 110).
Новообразованные сосуды в виде тонких петель можно видеть, как правило, между пигментной каймой и сфинктером зрачка. По мере увеличения количества сосудистых стволиков они образуют тонкую сеть, стелющуюся по поверхности радужной оболочки. Впоследствии сосуды могут распространяться па опознавательные зоны угла передней камеры и быть одной из причин повышения внутриглазного давления.
Новообразованные сосуды в радужной оболочке встречаются преимущественно при длительном существовании сахарного диабета и являются одним из проявлений гипоксии тканей глаза. Развитие рубеоза радужки при диабете следует расценивать как один из компенсаторных факторов, возникающих с целью улучшения кровообращения и питания ткани. Первые признаки неоваскуляризации должны привлекать внимание офтальмолога как прямое указание на активацию оксигенации.
Изменения дистрофического характера сводятся к отеку и набуханию пигментного эпителия как радужки, так и цилиарного тела, разрыхлению и дислокации отдельных пигментных клеток, что нередко приводит к образованию крупных беспигментных, просвечивающих в проходящем свете участков в ткани радужной оболочки при одновременном скоплении глыбок пигмента на задней поверхности роговицы или в углу передней камеры.
Иногда в таких случаях вихревые токи внутриглазной жидкости приводят к формированию на поверхности заднего эпителия роговицы фигуры веретена. Скопление большого количества пигмента в дренажной системе угла передней камеры глаза может стать впоследствии одной из причин повышения внутриглазного давления, о чем необходимо помнить при обследовании больного. Симптомы дистрофического характера являются отражением нарушения метаболических процессов.
Изменения в радужной оболочке воспалительного характера клинически могут проявиться в виде ирита, иридоциклита; они встречаются в 3—4%случаев. Течение воспалительного процесса обычно вялое, субклиническое, доброкачественное, что проявляется незначительной перикорнеальной инъекцией глазного яблока.
Иногда имеет место фибринозный выпот в переднюю камеру глаза, что приводит к возникновению задних синехий. Однако чаще такой воспалительный процесс выявляется лишь при гистологическом исследовании биоптатов радужной оболочки, полученных в процессе хирургического вмешательства по поводу катаракты или глаукомы.
В результате вялотекущего пластического диабетического ирита или иридоциклита могут возникнуть гониосинехии, что также служит одной из причин, приводящих впоследствии к повышению внутриглазного давления.
Изменения угла передней камеры глаза.
Характерными изменениями угла передней камеры глаза, способствующими повышению внутриглазного давления и отягощающими течение глаукомного процесса у больных сахарным диабетом, являются усиленная пигментация трабекулы, ее белково-жировое перерождение и уплотнение, разрастание сети новообразованных сосудов, образование гониосинехий.
При сочетании указанных изменений отмечается наиболее злокачественное течение глаукомы. В основе экзогенной пигментации (главным образом области венозного синуса склеры и кольца Швальбе) лежит, как указывалось выше, усиленное разрушение заднего пигментного листка радужной оболочки. Интенсивность пигментных отложений зависит от длительности и тяжести сахарного диабета и бывает иногда настолько выражена, что трабекулярная зона имеет вид сплошной темно- коричневой полоски.
Гониосипехии, возникающие в результате воспалительного процесса, как правило, тонкие, множественные, трабекулярные. Количество и выраженность их также находятся в прямой зависимости от давности и тяжести сахарного диабета.
Тщательная биомикротрабекулоскопия и гистоморфологические исследования корне о склеральных полосок, удаленных во время антиглаукоматозных операций у больных сахарным диабетом, свидетельствуют о резких изменениях ткани дренажной зоны, выражающихся не только в жировой дегенерации и утолщении трабекул, дистрофии и пролиферации эндотелия внутренней стенки венозного синуса склеры, но также в облитерации его просвета вследствие разрастания соединительной ткани.
Эти изменения чаще встречаются у больных с высоким содержанием в крови холестерина (20,8—31,2ммоль/л), р-лииопротеидов и значительными отложениями холестерина в тканях конъюнктивы и сетчатки. У данной категории больных в клиническом течении сахарного диабета преобладает выраженное нарушение жирового обмена. Как указывалось выше, в углу передней камеры глаза встречаются новообразованные сосуды, иногда в виде сети, закрывающей трабекулярную зону, что в значительной степени влияет на отток внутриглазной жидкости.
Естественно, что указанные изменения дренажной системы камерного угла являются следствием нарушения всех видов обмена веществ при диабете и могут быть причиной расстройства гидродинамики глаза и в значительной степени способствовать осложненному течению уже имеющегося первичного глаукомного процесса.
Умение правильно интерпретировать изменения угла передней камеры глаза при диабете помогает в выборе патогенетического медикаментозного и хирургического лечения глауком, создавая определенные возможности предупреждения осложнений, возникающих как в процессе проведения операции, так и в послеоперационном периоде.
У лиц, страдающих сахарным диабетом, глаукома встречается в 4—5 раз чаще (10,8%), чем у лиц без диабета. В 8,5% случаев глаукома протекает по типу первичной (чаще простой); в 2,3% —по типу вторичной. В клинической характеристике глаукомы при диабете можно отметить укорочение эластокривых, их высокое начало, снижение секреции и оттока камерной влаги.
Анатомические изменения в углу передней камеры глаза, развывшиеся вследствие диабетического процесса, являются одним из факторов, влияющих на состояние офтальмотонуса и гидродинамику глаза. Они ухудшают как течение, так и прогноз глаукоматозного процесса.
Изменение хрусталика.
У больных сахарным диабетом возможны два варианта катаракт, истинная диабетическая катаракта и старческая катаракта, развивающаяся на фоне сахарного диабета. При уточнении диагноза катаракты необходимо учитывать не только клиническую, в частности биомикроскопическую, характеристику имеющихся помутнений хрусталика, но также?данные, характеризующие течение основного заболевания, т. е. сахарного диабета.
Истинная диабетическая катаракта встречается редко, по сведениям многих авторов, лишь в 2—6% случаев. Обычно этот тип катаракты наблюдается только у молодых лиц, страдающих тяжелой формой юношеского диабета, получающих большие дозы инсулина: чаще всего это лица в возрасте до 30—35 лет. Содержание сахара в крови у них обычно высокое (16,6+19,4ммоль/л).
Для таких больных характерны резкие колебания уровня сахара в крови с возможностью развития коматозных состояний. Созревание истинной диабетической катаракты происходит быстро, иногда толчкообразно. Провоцирующим моментом в таких случаях является резкое снижение или повышение содержания сахара в крови.
При дифференциальной диагностике данной катаракты большая роль принадлежит ее биомикроскопической характеристике, в частности учету зоны появления первых помутнений вещества хрусталика. Ею является зона отщепления, располагающаяся рядом с передней и задней капсулами хрусталика (рис. 111).
При осмотре хрусталика необходимо обращать внимание па своеобразный вид уже развывшихся помутнений, которые более выражены в задних кортикальных слоях и имеют характерную картину. Обычно по виду они напоминают хлопья снега, комки ваты, пористый туф, имеют серо-белую окраску.
Помутнения перемежаются с зонами выраженной гидратации коркового вещества в виде симптомов диссоциации коры, водяных щелей и субкапсулярных вакуолей. Очень важно, что именно у больных детским или юношеским диабетом катаракта нередко сочетается с сосудистыми изменениями в виде наличия новообразованных сосудов в радужной или сетчатой оболочках.
У этих же лиц катаракта может сочетаться с вялотекущим притом. Выявление в предоперационном периоде указанных изменений позволяет офтальмо хирургу принять соответствующие профилактические меры с целью уменьшения геморрагических и воспалительных осложнений, которые являются главной причиной низкой остроты зрения после операции экстракции катаракты.
Гораздо чаще у больных сахарным диабетом имеет место старческая катаракта. По нашим наблюдениям и данным других авторов, она встречается в среднем у 70% больных. Обычно это лица пожилого возраста, страдающие сахарным диабетом в среднем 5—7 лет. Заболевание у них протекает благоприятно, без резких колебаний уровня сахара в крови, при его невысоких подъемах (6,6—8,3 ммоль/л).
Что касается клинической, в частности биомикроскопической, характеристики старческой катаракты при сахарном диабете, то следует отметить, что она практически не отличается от других возрастных (старческих) катаракт. Помутнения обычно локализуются в корковой, ядерной или субкапсулярной зонах хрусталика, не занимая полосу отщепления коры от передней и задней капсулы.
Отличительным симптомом этих катаракт может служить быстрое прогрессирование помутнений. Кроме того, у таких больных, как и у больных с истинной диабетической катарактой, нередко имеются изменения со стороны радужной оболочки (новообразованные сосуды, постиритические симптомы в виде задних синехий).
О патогенезе диабетической катаракты не существует единого мнения. Считается, что развитие помутнений хрусталика обусловлено непосредственной инсулиновой недостаточностью. Подтверждением этой точки зрения являются случаи регрессирования и даже полного исчезновения начальной катаракты под влиянием инсулинотерапии. Лечение катаракты в основном хирургическое.
Учитывая большой процент осложнений геморрагического и воспалительного характера, с целью их профилактики необходимо тщательное обследование больных данной категории в предоперационном периоде, для чего необходима консультация хирурга, терапевта, оториноларинголога, фтизиатра, эндокринолога.
В предоперационном периоде нет необходимости снижать содержание сахара в крови, приближая его к норме. На хирургическое лечение больной может быть направлен при тех цифрах, которые являются для него обычными, даже если они достигают 11,1— 19,4 ммоль/л. С целью профилактики гипогликемических состояний и связанных с ними осложнений целесообразно уменьшение доз инсулина на 4—16 ЕД как в день операции, так и в первый день после нее. Инсулин пролонгированного действия следует заменять на этот срок простым инсулином, изменяя соответственно дозу.
Изменения стекловидного тела.
Проявляются нарушением его прозрачности. Причиной этого являются сосудистые (кровоизлияния), воспалительные (экссудация) и дистрофические (деструкция стекловидного тела, отложение холестерина) процессы. Возможны грубые изменения с формированием глиальной ткани и образованием интравитреальных тяжей.
Кровоизлияние в стекловидное тело может произойти как из ванных, располагающихся в ткани сетчатки или стекловидном теле. По характеру и локализации кровоизлияния отличаются разнообразием. Они могут возникнуть в любой стадии диабетической ангиоретинопатии.
Появление крови в стекловидном теле всегда расценивается в качестве элемента, характеризующего начало более злокачественного течения как местного, глазного, так и основного процессов. Имеются наблюдения, показывающие, что после первого кровоизлияния в стекловидное тело продолжительность жизни больного сахарным диабетом составляет в среднем 3—5 лет.
Опыт показывает, что кровь в стекловидном теле никогда полностью не рассасывается. В результате любой, даже самой активной рассасывающей, терапии на месте кровоизлияния всегда остается нежная «пленка», в которой гистологически выявляются волокна соединительной ткани и деформированные элементы крови.
В дальнейшем пленчатые структуры начинают пролиферировать во всех направлениях, пронизывая новые порции стекловидного тела. Со временем пролиферативные тяжи служат проводниками при врастании в стекловидное тело новообразованных сосудов.
Дегенеративные изменения стекловидного тела, проявляющиеся разжижением, распадом фибриллярного остова, отложением холестеринсодержащих веществ в форме так называемых астероидных телец (рис. 112), возникают вследствие вяло текущего воспалительного процесса в радужной оболочке и цилиарном теле, а также дистрофии тканей глазного яблока.
При этом в разжиженном стекловидном тело появляются множественные, подвижные, округлые, мелкие включения серо-белого или желтоватого цвета. На остроту зрения они обычно не влияют, но могут затруднять офтальмоскопическое исследование. Лишь в последнее время указанные изменения стали связывать с сахарным диабетом. Отмечено, что у лиц с астероидными тельцами в стекловидном теле сахарный диабет встречается в 5раз чаще, чем обычно.
При исследовании содержания холестерина в крови у группы больных с наличием в стекловидном теле астероидных телец установлено, что средний уровень его 8,3 ммоль/л. Это же относится к содержанию жиров и других липидов, которое также является повышенным.
У больных сахарным диабетом нередко отмечаются задняя отслойка стекловидного тела, уплотнение и на рушение прозрачности его задних отделов. Это объясняется выхождением в полость стекловидного тела протеина из новообразованных сосудов диска зрительного нерва и сетчатки.
Изменения сетчатой оболочки и зрительного нерва.
Диабетическая ангиоретинопатия является наиболее тяжелым проявлением сахарного диабета. По данным литературы, она возникает в 30—90%случаев. Разноречивость сведений, вероятно, объясняется разнообразием клинического материала различных авторов (разные сроки заболевания сахарным диабетом, различные формы тяжести местных и общих проявлений заболевания).
Клинический материал кафедры офтальмологии ЦОЛИУВ (2000 больных при длительности наблюдения 15 лет) позволяет сделать вывод о том, что изменения сетчатой оболочки, обнаруживаемые в разные сроки от начала заболевания сахарным диабетом, имеют место в 98,9% случаев. При учете симптоматики воспалительного или дистрофического характера со стороны других анатомических структур глазного яблока можно с уверенностью говорить об изменении органа зрения при сахарном диабете в 100% случаев.
Следует подчеркнуть, что своевременная диагностика и правильная интерпретация получаемых данных возможна лишь благодаря специальным методам обследования, включающим биомикроофтальмоскопию, гониоскопию, флюоресцентную ангиографию, электрофизиологические исследования, допплерографию, количественную характеристику агрегационной способности эритроцитов.
Современные методы исследования позволяют выявить диабетическую ангиоретинопатию на раннем этапе развития сахарного диабета, даже при латентном его течении, что является одним из оснований, позволяющих считать диабетическую ангиоретинопатии не осложнением, а проявлением сахарного диабета, т. е. одним из обязательных его симптомов.
Исследователи, трактующие диабетическую микроангиопатию как осложнение сахарного диабета, в качестве основного довода приводят наблюдения, свидетельствующие о том, что наибольшая частота микроангиопатий имеет место лишь при длительном течении диабета. Другим подтверждением этого взгляда служат сообщения о значительном превалировании частоты диабетической микроангиопатии у больных с недостаточной компенсацией процесса.
Однако наблюдения за больными группами больных свидетельствуют о том, что прямая зависимость между частотой проявлений диабетической микроангиопатии н степенью компенсации сахарного диабета существует не всегда.
Отсутствие прямой связи между диабетической микроангиопатией и длительностью диабета, а также наличием гипергликемии констатировал F. Collens (1969), который наблюдал клинические формы ретинопатии и нефропатии у больных латентным диабетом, а также в случаях нормальной толерантности к глюкозе.
В дальнейшем отечественные авторы также отмечали микроангиопатию сетчатки у больных с небольшой длительностью заболевания, при латентном диабете и предиабете, а также у лиц с наследственной предрасположенностью к данному заболеванию.
Таким образом, в настоящее время концепция, рассматривающая микроангиопатию сетчатки как осложнение сахарного диабета, поставлена под сомнение. Все большее число авторов рассматривает ее в качестве обязательного довольно раннего симптома заболевания.
Международный симпозиум «Диабетическая микроангиопатия» был почти полностью посвящен патологии тканевой оксигенации. Проблема тканевой гипоксии непосредственно связана с нарушениями транспортировки кислорода и его утилизации тканями. Большую роль в развитии тканевой гипоксии играет изменение клеточной функции, что выражается в извращении внутриклеточного метаболизма глюкозы.
Это приводит к увеличению осмотического давления, клеточному отеку, нарушению структуры клетки. Извращение клеточной функции способствует накоплению ШИК-положительных веществ в цитоплазме лейкоцитов и клеточных мембранах.
Большое внимание привлекают исследования, касающиеся нарушения ауторегуляции микроциркуляции. По современным представлениям, в механизме ауторегуляции кровотока участвуют прекапиллярные и преартериалыше сфинктеры, которые регулируют кровенаполнение сосудов.
В частности, снижение парциального давления кислорода в тканях сопровождается увеличением кровенаполнения сосудов в результате релаксации сфинктеров и раскрытия дополнительных капилляров. I. Ditzel (1976) считает, что в основе диабетической микроангиопатии лежит болезнь ауторегуляции, первично нарушающая венозную часть микроциркуляции. Кроме того, нарушение кровотока связано с изменяющейся при диабете вязкостью крови.
Исследованиями, проведенными М. И. Беляевой (1981), доказано ее увеличение, а также определенная зависимость от длительности заболевания диабетом. Как повышение вязкости крови, так и увеличение агрегации эритроцитов связывают с изменением состава плазменных белков, возрастанием холестерина в крови и его фракций. В патогенезе диабетической микроангиопатии большая роль отводится также усилению агрегации тромбоцитов, изменению фибринолитической активности сыворотки крови, гиперпродукции минералокортикоидов, иммуногенным сдвигам.
Таким образом, на уровне современных достижений офтальмодиабетологии патогенез диабетической микроангиопатии схематично представляется следующим. В результате генетических или приобретенных дефектов секреции инсулина создаются условия для превалирования необычного пути превращения глюкозы в сорбит, что влечет за собой ряд других патологических изменений (увеличение в крови содержания сорбита, холестерина и его фракций, повышение агрегации эритроцитов и тромбоцитов, увеличение вязкости крови и т. д.).
На изменения вязкости крови и гемоциркуляции сосуды реагируют изменением просвета, увеличением порозности стенки, дилатацией крупных и окклюзией мелких сосудистых ветвей. Окклюзия капилляров макулярной области приводит к тканевой гипоксии. Она вызывает ответную реакцию компенсации в виде расширения венул, увеличения тканевого кровотока и увеличения содержания в эритроцитах 2,3-дифосфоглицерата.
Эта пока функциональная микроангиопатии клинически характеризуется расширением сосудов сетчатки. Она существует различное время, пока не исчерпываются резервы компенсации организма. Позже возникают изменения в системе нейрорегуляции, гемостаза, кровотока и клеточной функции, что способствует утолщению базальной мембраны сосудов системы микроциркуляции. Это свойственно клинически выраженным формам ретино-, нейро- и нефропатии.
О колоссальных компенсаторных возможностях организма по отношению к расстройствам углеводного обмена свидетельствует тот факт, что у больного с отягощенной наследственностью офтальмолог нередко диагностирует сосудистые изменения в виде макро- или микроангиопатии задолго до выявления сахарного диабета.
Как указывалось выше, причинами сосудистых изменений, развивающихся у больных сахарным диабетом, являются нарушения состава крови (увеличенное содержание холестерина и его фракций, повышенная агрегация эритроцитов и тромбоцитов, накопление минералокортикоидов и др.).
Из перечисленных изменений крови наиболее опасно избыточное количество холестерина и холестериновых фракций, поскольку это ведет к увеличению вязкости крови и замедлению кровотока, увеличению агрегации кровяных элементов, нарушению микроциркуляции.
В результате этого усиливаются проникновение и отложение в основное соединительнотканное вещество сосудистой стенки белковых и жировых молекул, мукополисахаридов — основных компонентов шик положительных веществ. Тем самым повышается пропускная способность сосудистой стенки со значительным увеличением ее порочности.
Этот процесс развивается параллельно как в крупных, так и в мелких сосудах, причем характер происходящих в них изменений примерно одинаков: пропитывание стенки сосуда ПАС-положительным веществом,, компенсаторная (в связи с медленным током крови) дилатация сосуда, образование микро- и макроаневризм. В мелких сосудах рано развивается окклюзия, чем и объясняется более раннее проявление диабетической микроангиопатии в регионе расположения капилляров, в частности в макулярной области сетчатки.
Они возникают вслед за поражением капиллярной сети, развиваясь из предсуществующих капилляров, и не должны интерпретироваться как проявление неоваскуляризации. Подобно аневризмам эти варикозные коллатеральные капилляры имеют выраженную эндотелиальную пролиферацию. Следует отметить, что истинные микроаневризмы, как и последующая неоваскуляризации, характерны лишь для сетчатки. Они не встречаются в других тканях и органах.
Однако такие элементы могут развиваться не только при диабетических поражениях глазного дна, но и при других заболеваниях. К ним можно отнести гипертоническую ретинопатию, полицитемию, болезнь Такаясу, синдром дуги аорты, болезнь Илзаг венозный тромбоз и ряд других заболеваний, при которых имеют место нарушения кровообращения, гипоксия и первичное нарушение эндотелия сосудов.
Ретильные микроаневризмы имеют собственный жизненный цикл: они трансформируются через 12—24мес. после появления вследствие гиалинизации или тромбирования просвета. Обычно эти процессы сочетаются. На фоне дилатации капиллярной сети и микроаневризм, повышенной порозности сосудистой стенки и замедленного кровотока развивается отек сетчатки. Одновременно с этим ткань сетчатой оболочки в отдельных местах имбибируется ШИК-положительными элементами, которые именуются «твердые экссудаты» или «сухие» дегенеративные очаги.
L. Vanko (1974) проведено изучение компонентов, входящих в состав твердых экссудатов, которые, как и отек, локализуются преимущественно в заднем полюсе глаза. Оказалось, что они состоят из липопротеинов, гликопротеинов и фосфолипидов с примесью нейтрального жира. В настоящее время не осталось сомнения в источнике формирования «экссудатов». Их составные элементы образуются в крови, что подтверждается первоначальным появлением отложений в окружности пораженного сосуда, отличающегося повышенной проницаемостью стенки. Этот факт обнаруживается при флюоресцентной ангиографии.
При диабетической ангиоретинопатии, кроме «твердых экссудатов», возможно образование ватообразных, белых, с нечеткими границами очагов. Эти очаги, или, как их называют, «мягкие экссудаты», выявляются в сетчатой оболочке в виде изолированных белых зон.
Они расцениваются как инфаркты сетчатки, возникающие в связи с острой артериолярной окклюзией, и по локализации соответствуют зонам отека ткани. Однако существует мнение, что патоморфологической основой «мягких экссудатов» являются белки и их фракции. Указанные «экссудаты» располагаются обычно в области заднего полюса глаз, в зоне радиальных прекапилляров.
Их обратное развитие происходит значительно медленнее, чем аналогичных экссудатов, возникающих при гипертонической болезни. Появление «мягких экссудатов» при диабетической ретинопатии рассматривается как неблагоприятный прогностический признак. Большую помощь при оценке некоторых аспектов патогенеза диабетической ангиоретинопатии и расшифровке особенностей ее клинического проявления оказала флюоресцентная ангиография — контрастное исследование сосудов. Применение этой методики в офтальмологии дало возможность изучать сосудистую сеть глаза до уровня капилляров, где и начинается поражение сосудов при сахарном диабете.
Вопрос о классификации изменений сетчатой оболочки при диабете окончательно не решен. Существуют классификационные схемы, включающие более или менее детальное описание симптоматики и систематизацию различных фаз течения диабетической ангиоретинопатии.
Все авторы разделяют процесс на две клинические формы — не пролиферативную (иногда эта форма носит на-звание «простой») и пролиферативную. Важно отметить, что переход одной формы в другую составляет тот патологический сдвиг, который характеризуется распадом зрительных функций.
Первая классификация изменений глазного дна при сахарном диабете была предложена Е. Jaeger более 100лет назад. С тех пор возникло множество других классификационных схем. Одни из них являются устаревшими, так как не отражают суть патологического процесса, другие построены с учетом последних достижений в офтальмодиабетологии, но являются слишком детальными, основываются на симптоматике, которая служит базисом для проведения лазеркоагуляции сетчатки.
В практической работе советских офтальмологов получили признание в основном отечественные классификации. К ним относится классификация В. П. Лекишвили и Э. К. Чкопия (1973), разработанная на кафедрах офтальмологии и эндокринологии Тбилисского института усовершенствования врачей, классификация К. В. Трутневой и Н. А. Михайловой (1978), созданная в Московском научно-исследовательском институте глазных болезней им. Гельмгольца совместно с сотрудниками диабетологического отделения Института экспериментальной эндокринологии ж химии гормонов АМН СССР. Наибольшее распространение получила классификация, предложенная М. Л. Красновым и М. Г. Марголисом в 1966 г. и несущая в себе элементы патогенетической характеристики процесса по стадиям и формам клинического проявления с учетом возможного присоединения к диабету склеротических и гипертонических изменений глазного дна.
Статья из книги: Терапевтическая офтальмология | Краснов М.Л.; Шульпина Н.Б..




Комментариев 0