Диффузные воспалительные заболевания соединительной ткани и сосудов | Часть 1.

Содержание:
Описание
↑ Ревматизм
Ревматизм — острое рецидивирующее инфекционно-аллергическое заболевание с локализацией патологического процесса в соединительной ткани многих органов. Болезнь может принимать хроническое течение. Ревматизм — весьма распространенная болезнь. Особенно большое социальное значение имеет ревматическое поражение детей и юношей.
В настоящее время общепризнано, что основным этиологическим фактором ревматизма является b-гемолитический стрептококк группы А, что подтверждается бактериологическими, энзимологическими, иммунологическими и эпидемиологическими исследованиями.
Решающим доказательством стрептококковой этиологии ревматизма является обнаружение в крови больных стрептококковых антигенов (стрептогиалуронидаза, стрептолизины) и их антител (антистрептогиалуронидаза, антистрептолизины).
Стрептококковая инфекция является необходимым, но не единственным условием при возникновении и развитии ревматизма. Важное значение в развитии заболевания придается индивидуальной иммунологической реактивности организма, предшествующей сенсибилизации организма. Согласно данным А. И. Нестерова, в патогенезе ревматизма существенную роль играют нейрогенные нарушения. Как показывают клинические наблюдения, в развитии болезни определенную роль играют и эндокринные расстройства. Простуда, переохлаждение, травмы, интеркуррентные заболевания и другие факторы могут содействовать развитию или обострению ревматизма.
В свете последних данных известную роль в развитии ревматизма могут играть генетически обусловленные факторы. Вирусная теория происхождения ревматизма не получила подтверждения.
Патоморфология заболевания изучена достаточно подробно. Основу морфологических изменений при ревматизме составляют процессы системной прогрессирующей дезорганизации соединнтельной ткани органов и утенок сосудов и иммунопатологические процессы. А. И. Струков и В. В. Серов (1979) выделяют 4 фазы дезорганизации соединительной ткани: мукоидное набухание, фибриноидные изменения, клеточные реакции (гранулематоз) и склероз. Из 4 фаз только первая — мукоидное набухание, является обратимой. Особенно типичным для ревматизма морфологическим изменением является образование ашофф-талалаевских гранулем. Цикл развития гранулемы по Талалаеву продолжается 3—4 мес. Склероз является заключительной стадией ревматического поражения соединительной ткани.
Не всегда развитие морфологических изменений в органах и тканях проходит все четыре фазы. В ряде случаев гранулематозная стадия может выпадать и тогда развивается так называемый первичный склероз.
Наряду со специфическими изменениями в соединительной ткани могут развиваться и неспецифические изменения в виде отека и диффузной клеточной инфильтрации. К числу неспецифических тканевых реакций относятся и васкулиты в системе микроциркуляторного русла. Обнаружение этих неспецифических реакций приобретает особое диагностическое течение в межприступном периоде и прп латентных формах заболевания.
Клиника ревматизма характеризуется большим многообразием. Это обусловливается, во-первых, тем, что хотя при ревматизме наиболее часто страдает сердце, могут пораниться самые различные органы и системы (нервная система, легкие, почки, кожа, серозные оболочки, эндокринные железы, суставы), и, во-вторых, тем, что течение заболевания может быть острым, подострым, затяжным, непрерывно рецидивирующим и латентным. Кроме того, заболевание может находиться в активной или неактивной фазе.
В основе острых форм ревматизма и его обострений лежат, как правило, гуморальные иммунные реакции гиперчувствительности немедленного типа. В сыворотке крови при этом появляются антитела к различным антигенным компонентам стрептококка, что и используется в диагностике ревматизма (ACЛ-0, АСК, АСГ и др.).
Клеточные иммунные реакции гиперчувствительности замедленного типа лежат обычно в основе хронических и латентных форм ревматизма, что проявляется, в частности, увеличением в крови количества плазматических клеток и Y-глобулинов.
↑ Поражения глаз при ревматизме
Заболевания глаз при ревматизме наблюдаются весьма часто— от 14 до 28% по данным различных авторов [Дворжец М. А., 1931; ТНершевская О. И., 1964]. Особенно часто страдают сосуды сетчатки и увеального тракта. Описаны также ревматические увеиты, ретиниты, склериты и кератиты.
Склериты при ревматизме часто сочетаются с иридоциклитами и могут осложняться склерозирующим кератитом. Субъективные симптомы — боль, светобоязнь, слезотечение, бывают выражены в той мере, в какой в процесс вовлечен передний отдел сосудистой оболочки. Склеральный фокус (иногда два и больше) располагается в склере около лимба или реже над цилиарным телом. Инъекция конъюнктивальных, эписклеральных и перикорнеальных. сосудов придает фокусу темно-красный, часто с фиолетовым оттенком цвет. Воспалительный процесс разрешается через несколько недель, при этом в результате резорбции инфильтрата и разрушенной склеральной ткани склера в зоне бывшего фокуса истончается и приобретает вид сероватого пятнышка. Заболевание может рецидивировать, поражая различные участки перилимбальной зоны склеры.
Значительно реже, чем узелковый склерит, при ревматизме наблюдается анулярный склерит. В таких случаях воспалительный процесс захватывает в виде кольца весь перилимбальный отдел склеры.
Склерозирующий кератит является частым осложнением склерита. От склерального фокуса в строму роговицы в виде языка врастает белесоватого цвета слабоваскуляризованный инфильтрат. Течение болезни длительное, нередки рецидивы. В конечном счете инфильтрат замещается рубцовой тканью, образуется бельмо роговицы.
Ревматический иридоциклит может сочетаться со склеритом или возникать самостоятельно. Поражение может быть как односторонним, так и двусторонним. Обычно иридоциклит при ревматизме носит диффузный, негранулематозный характер с серозным или серозно-фибринозным экссудатом, иногда с выпотом в стекловидное тело и мелкими роговичными преципитатами. При правильном и своевременном лечении прогноз хороший. Воспалительный процесс купируется без последствий для зрения.
Ревматический иридоциклит нередко рецидивирует. Мы наблюдали двух молодых женщин с рецидивирующим передним увеитом то на одном, то на другом глазу. Рецидивы возникали весной и осенью и провоцировались в одном случае простудой, а в другом совпадали с началом менструального цикла. Каждый следующий рецидив иридоциклита протекал тяжелее предыдущего. Вначале он имел характер серозного, затем серозно-фибринозного и впоследствии — пластического, с образованием стромальных задних синехий, заращением зрачка. В конечном итоге через 4—5 лет после начала заболевания оба глаза полностью ослепли, развилась гипотония и субатрофия глазных яблок. Следует отметить, что такое тяжелое течение болезни наблюдается редко и, как правило рецидивы ревматического иридоциклита хорошо поддаются лечению.
[banner_centerrs] {banner_centerrs} [/banner_centerrs]
Значительно реже, чем диффузные, встречаются гранулематозные ревматические иридоциклиты с образованием серовато-розовых узелков преимущественно в зрачковой зоне радужной оболочки. Заболевание протекает подостро и оставляет после себя небольшие атрофические участки стромы радужной оболочки на месте узелков [Шершевская О. И., 1964].
Лечение ревматических склеритов и иридоциклитов включает использование медриатических, кортикостероидных и других противовоспалительных средств, тепловых процедур и в части случаев антибиотиков. С целью рассасывания экссудата, задних синехий, помутнений стекловидного тела и роговой оболочки можно использовать инъекции химотрипсина и лидазы, электрофорез и фонофорез с папаином и гиалуронидазой.
Ревматические хориоидиты и хориоваскулиты детально описаны О. И. Шершевской (1962). Хориоидальные очаги беловато-желтого цвета, имеют небольшие размеры. Вокруг очагов в зоне депигментации можно видеть склерозированные хориоидальные сосуды, пролиферативные шварты, а в некоторых случаях — сероватые вуалеобразные полосы экссудата и периваскулярные муфты. Автор считает, что ревматические хориоваскулиты могут протекать изолированно, без хориоидита. В конечном счете образуются ограниченные очаги склерозированных хориоидальных сосудов.
Увеальный воспалительный процесс может служить причиной ретинита, ретинальных васкулитов и периваскулитов [Пеньков М. А., Аврущенко Н. М., 1975], образования ретинальных и витреальных преципитатов, деструктивных изменений в стекловидном теле. Вместе с тем ретиноваскулиты и ретиниты при ревматизме чаще носят самостоятельный характер. В. П. Загородняя (1975) полагает, что симптомы микроангиопатии сетчатки можно обнаружить при первой атаке заболевания с последующим развитием склероза этих сосудов.
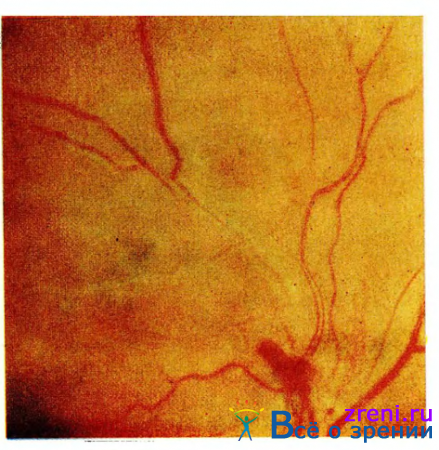
Для ревматических васкулитов характерно образование серого или белого цвета относительно компактных и плотных на вид муфт, а иногда и таких же по цвету сопровождающих сосуды полос (рис. 29).
Рис. 29. Васкулит.
Процесс может захватить как артерии, так и вены. Чаще поражаются сосуды на периферии сетчатки, но в процесс могут вовлекаться и крупные ветви. Поскольку воспалительный процесс захватывает не только адвентицию, но и всю сосудистую стенку, то просвет сосуда в зоне поражения в той или иной мере суживается. Около сосуда могут быть видны мелкие геморрагии и сероватые ретинальные фокусы. В типичных случаях эти изменения не оказывают влияния на зрение и остаются не замеченными больными. Они обнаруживаются только при контрольном исследовании врачом-офтальмологом. В конечном итоге муфты и геморрагии рассасываются без каких-либо последствий.
Значительно тяжелее васкулиты протекают в тех случаях, когда за счет воспалительного процесса и, возможно, тромбирования возникает окклюзия пораженного сосуда. Чаще страдают отдельные ветви центральных сосудов сетчатки, но может развиться и острая непроходимость основных сосудистых стволов [Шубина Л В., 1965].
При решении вопроса о механизме непроходимости центральной артерии сетчатки следует помнить, что у больных ревматизмом имеются условия для эмболической окклюзии без какого-либо поражения ретинальных артерий. Дифференциальный диагноз между воспалительным и эмболическим характером окклюзии сосуда не всегда возможен. В этом отношении может быть полезньш детальное исследование глазного дна не только пораженного, но и второго глаза. Обнаружение ретинального периваскулита позволяет заподозрить воспалительный характер окклюзии.
Следует отметить относительно благоприятный прогноз в таких случаях. Интенсивное противовоспалительное лечение с местным применением кортикостероидов в сочетании с сосудорасширяющими препаратами и осторожным применением фибринолитических (стрептокиназа) препаратов и антикоагулянтов нередко позволяет в той или иной мере восстановить зрение даже при окклюзии основного ствола центральной артерии сетчатки.
Наиболее тяжелые случаи ретиноваскулитов сопровождаются выраженными изменениями в сетчатке [Рубин И. В., 1965]. При этом появляются отек диска зрительного нерва и сетчатой оболочки, многочисленные геморрагии, экссудативные ретинальные очаги, включая фигуру макулярной звезды, преретинальный фиброз.
Как уже отмечалось выше, ревматические поражения увеального тракта, сетчатки и внутриглазных сосудов протекают относительно доброкачественно и в большинстве случаев хорошо поддаются лечению. Следует иметь в виду, однако, что они нередко рецидивируют и рецидивы могут быть более тяжелыми, чем первоначальное поражение. Поэтому больные ревматизмом должны систематически осматриваться врачом-офтальмологом.
Терапия ревматических поражений хориоидеи и сетчатки основана на лечении основного заболевания, назначаемого врачом-интернистом или ревматологом. Появление глазных симптомов ревматизма указывает на обострение процесса и на необходимость интенсификации противоревматического лечения. В выраженных случаях при значительных изменениях внутриглазных сосудов, хориоидеи или сетчатки рекомендуется провести курс лечения пара- или ретробульбарными инъекциями глюкокортикоидов (ежедневно, 10—15 инъекций на курс). Для рассасывания экссудатов, шварт и геморрагий в фазе обратного развития процесса можно назначать тканевую терапию, внутримышечные инъекции лидазы или химотрипсина, лечение препаратами пчелиного яда, электро- и фонофорез папаина или лидазы.
↑ Коллагенозы
Коллагенозы — групповое понятие, объединяющее несколько заболеваний, при которых отмечается диффузное поражение соединительной ткани и сосудов. К настоящему времени доказано, что при коллагеновых болезнях наблюдаются глубокие нарушения иммунологического гомеостаза, поэтому некоторые ученые возражают против названия «коллагенозы» и полагают, что целесообразнее выделять группу заболеваний соединительной ткани с иммунными нарушениями.
В этиологии и патогенезе коллагеновых заболеваний до сих лор остается много неясного, но несомненно то, что в основе их лежат иммунопатологические реакции, возникающие в ответ на ту или иную инфекцию, а возможно и вирусы [Bole G., 1975]. Имеются основания предполагать, что определенное значение для развития коллагеновых заболеваний имеют генетические и экологические факторы [Струков А. И., Серов В. В., 1979]. Провоцирующими факторами могут быть лекарственная непереносимость, охлаждение, чрезмерная инсоляция, травмы, эндокринные расстройства и др.
Аутоиммунный механизм патогенеза характерен для коллагеновых болезней. Начальным звеном иммунопатологического процесса является стимуляция иммунокомпетентной системы каким-либо антигеном, по-видимому, специфичным для каждой нозологической формы (бактерии, вирусы и др.). В дальнейшем в процесс включаются аутоантигены с усиленной выработкой аутоантител. По современным представлениям большую роль в возникновении аутоантигенов играют лизосомы, носители кислых гидролаз.
По данным советских авторов [Струков А. И., Бегларян А. Г., 1963], процесс дезорганизации соединительной ткани при коллагеновых заболеваниях проходит четыре фазы: мукоидное набухание, фибриноидное набухание, развитие клеточных реакций и некроза, развитие склероза. У одного и того же больного могут одновременно наблюдаться различные фазы дезорганизации соединительной ткани, что свидетельствует о постоянно прогрессирующем волнообразном течении коллагеновых болезней.
Под влиянием лечения кортикостероидами и иммунодепрессантами существенно изменяется как клиническая картина, так и патоморфология заболевания. В частности, при назначении указанных лечебных средств существенно могут уменьшаться фибриноидные и экссудативные процессы. Явления склероза и клеточные реакции, напротив, при этом могут усиливаться.
Большинство клиницистов в группу заболеваний соединительной ткани с иммунными нарушениями включает следующие болезни: системную красную волчанку, ревматоидный артрит, склеродермию, дерматомиозит, узелковый периартрит, ревматизм, анкилозирующий спондилоартрит и некоторые другие. Ниже будут рассмотрены те из них, при которых часто наблюдаются поражение органа зрения, в частности системная красная волчанка, на примере которой будут показаны тонкие механизмы повреждения тканей, свойственных в той или иной степени заболеваниям с иммунными нарушениями.
↑ Системная красная волчанка
В последние десятилетия накопилось достаточно клинических и экспериментальных данных, позволяющих рассматривать системную красную волчанку (СКВ) как один из ярких примеров "аутоиммунного заболевания. В изучении этого страдания достигнуты большие успехи, однако точный механизм развития его остается еще не раскрытым. В патогенезе СКВ в настоящее время рассматриваются два основных аспекта: 1) нарушение иммунологической регуляции; 2) генетическая предрасположенность.
Иммунологическое направление в изучении СКВ стало ведущим после открытия М. Hargraves и соавт. в 1948 г. феномена волчаночных клеток. Дальнейшее изучение гуморальных иммунных реакций при СКВ выявило широкий спектр аутоантител, направленных против клеточного ядра, ДНК, форменных элементов крови, факторов свертывания крови, ткани почек, печени, миокарда, кожи. Циркулирующие в крови больных СКВ антитела к ДНК в присутствии комплемента образуют растворимые комплексы с ДНК, по общепринятому сейчас представлению, обусловливают развитие волчаночного нефрита в результате фиксации комплексов на базальной мембране клубочков, что выявляется с большой степенью достоверности при СКВ методом иммунофлюоресценции 1Серов В. В. и др., 1973]. Однако само по себе наличие иммунных комплексов не означает обязательного развития деструкции тканей. Для этого процесса имеют значение факторы, влияющие на передвижение иммунных комплексов, местные тканевые условия, класс антител, их комплементсвязывающая активность, тропность к антигену, способность к освобождению вазоактивных субстанций в реакциях с антигеном, так как именно от последних зависит, где депозирует комплекс. В нормальных условиях выделение иммунных комплексов является функцией ретикулоэндотелиальной и мононуклеарной фагоцитарной систем, поэтому выведение иммунных комплексов зависит не только от их структуры, но и от состояния и возможностей ретикулоэндотелиальной системы, местных тканевых факторов — сосудистой проницаемости и состояния сосудистой стенки. Известно, что электронно-химическая структура базальной мембраны гломерул играет значительную роль в пассаже иммунных комплексов через капиллярную стенку клубочков. Циркулирующие антитела, относящиеся к комплементфиксирующему классу IgG-1 и IgG-2, обнаруживаются при СКВ вместе с компонентами комплемента в поврежденной почке и коже.
Если участие иммунных комплексов в патогенезе отдельных синдромов очевидно, то точное биологическое значение и патогенетическая роль аутоантител, несмотря на длительное и углубленное изучение, до сих пор неясны.
В настоящее время перспективу понимания патогенеза аутоиммунных заболеваний и, в частности, СКВ связывают с представлением о нарушении иммунологической регуляции. Этому способствовало открытие тимусзависимых и тимуснезависимых систем иммунитета. Методом экспериментальной иммунологии было показано, что основным этапом регуляции в иммунной системе является взаимодействие Т- и В-лимфоцитов и их субпопуляций различной функциональной направленности, среди которых ведущую роль играют Т-клетки-регуляторы, получившие название помощников, усилителей и супрессоров. Т-лимфоциты-помощники усиливают продукцию антител В-лимфоцитами. Точный механизм этого эффекта, названного кооперацией, еще неизвестен, но факт зависимости продукции антител при стимуляции тимусзависимости антигенами В-лимфоцитов и Т-лимфоцитов теперь уже не вызывает сомнений. Среди Т-лимфоцитов, кроме клеток-помощников, существуют клетки-убийцы (киллеры), способные реагировать с тканевыми антигенами, и клетки-супрессоры, ответственные за естественную иммунологическую толерантность к аутологичным компонентам. Если по какой-либо причине наступает количественный или качественный дефицит Т-лимфоцитов-супрессоров и нарушается регуляторное равновесие между Т-клетками-помощниками и супрессорами, то возрастает активность Т-клеток-эффекторов и В-лимфоцитов, и это проявляет себя гиперпродукцией аутоантител и деструктивным эффектом лимфоцитов в тканях.
Нарушениям клеточного иммунитета в патогенезе аутоиммунных заболеваний отводится в последние годы ведущая роль. Одним из подтверждений этой концепции явилось изучение морфологических проявлений СКВ и других аутоиммунных заболеваний, характеризующихся продуктивными клеточными реакциями с инфильтрацией пораженных органов и тканей лимфоидными и макрофагальными клетками, что свидетельствует о реакциях гиперчувствительности замедленного типа. Примечательно, что морфологическое исследование синовиальной жидкости и лимфоидных инфильтратов синовиальной ткани пораженных суставов выявило значительное преобладание тимусзависимых лимфоцитов в них при ревматоидном артрите и в инфильтратах печени при ХАТе [Траянова Т. Г., 1977]. Обнаружено, что при ревматоидном артрите нарастание активности заболевания сопровождается статистически достоверным увеличением не только количества Т-лимфоцитов в синовиальной жидкости, но и появлением продуктов активированных Т-клеток, так называемых лимфокинов, непосредственно участвующих в повреждении тканей. Имеющиеся сообщения о хорошем лечебном эффекте при СКВ и ревматоидном артрите дренирования грудного протока (где Т-лимфоциты составляют 88 %) также свидетельствуют об участии Т-лимфоцитов в патогенезе этих заболеваний.
Несмотря на наличие убедительных доказательств патогенетической роли нарушений клеточного иммунитета при СКВ, до сих пор нет единого мнения о характере направленности этих нарушений. Рядом авторов установлен факт клеточной анергии, тогда как другие исследователи с неменьшей убедительностью доказали формирование гиперчувствительности замедленного типа к ядерным и тканевым антигенам. Предположение о дефиците клеточного иммунитета при СКВ основано на выявлении гипо- или ареактивности больных при внутрикожном введении стандартных или бактериальных антигенов, снижения способности лимфоцитов под влиянием неспецифических митогенов трансформироваться в бласты. Обнаруженное в последние годы снижение абсолютного и относительного количества Т-лимфоцитов в периферической крови больных в периоды высокой клинической активности СКВ (деструктивная фаза заболевания) (до 18—32%) и восстановление количества их в периоды ремиссии практически до нормального уровня (до 55—75%) являются существенным подтверждением этой гипотезы. Аналогичный дефицит Т-лимфоцитов имеется и при аутоиммунном заболевании новозеландских мышей — экспериментальной модели СКВ, дефицит клеточного иммунитета у которых доказан.
Разработка новых методических подходов, использование реакций, адекватно отражающих иммунологические процессы, происходящие в организме, применение специфических антигенов показали, что у больных СКВ иммунные реакции клеточного типа к ядерным и тканевым (специфическим) антигенам повышены. Таким образом, выясняются как будто противоречивые факты: с одной стороны, уменьшение количества Т-лимфоцитов, обеспечивающих клеточный иммунитет в организме, снижение показателей неспецифического клеточного иммунитета, а с другой — выраженная гиперчувствительность замедленного типа к специфическим антигенам.
Разрешение этих противоречий стало возможным после обнаружения особой популяции Т-лимфоцитов, обладающих супрессорной функцией, обеспечивающих толерантность к аутоантигенам и контролирующих аутоантительный ответ В-лимфоцитов и иммунные реакции Т-лимфоцитов-эффекторов. Этому способствовало изучение такой близкой к условиям клиники модели СКВ, как аутоиммунный синдром у черных новозеландских мышей и их гибридов. У мышей линии NZB и гибридов NZB х NZW, преимущественно у самок, в возрасте 140—250 дней спонтанно развиваются практически все симптомы СКВ: гемолитическая анемия, иммунокомплексный гломерулонефрит, очень похожий на люпус-нефрит человека. Характерная черта этих состояний — продукция необычных антител, таких, как антинуклеарные и антитканевые, антитела к нативной ДНК, положительный феномен LE-клеток. В связи с тем, что по клиническим проявлениям и иммунологическим нарушениям аутоиммунные заболевания новозеландских мышей и СКВ близки, работы по выяснению механизмов развития этого мышиного заболевания чрезвычайно важны для понимания патогенеза СКВ, изучения преморбидного периода, подхода к этиопатогенетической терапии.
У гибридных новозеландских мышей N. Talal (1976) получил прямые доказательства потери с возрастом супрессорной функции Т-лимфоцитов. Введение таким мышам антилимфоцитарного глобулина вызывает усиление аутоиммунных реакций, и это обусловлено угнетением активности Т-лимфоцитов-супрессоров. Напротив, введение супернатантной жидкости после культивирования нормальных клеток селезенки с конкавалином-А (активатор Т-лимфоцитов-супрессоров) гибридным мышам в раннем возрасте оказывается эффективным профилактическим средством развития аутоиммунных заболеваний у мышей. Эти эксперименты еще раз подтверждают важную роль Т-лимфоцитов-супрессоров в патогенезе аутоиммунных болезней.
В экспериментах с неонатальной тимэктомией и последующей пересадкой вилочковой железы от животных различного возраста доказано, что в основе срыва толерантности и развития аутоиммунного заболевания у мышей линии NZB и, как предполагают многие исследователи, при СКВ лежит дефект вилочковой железы. Показано, что одной из причин аберрантной дифференцировки Т-клеток является нарушение функции ретикулоэпителиальных клеток вилочковой железы, секретирующих тимозин. Пересадка вилочковой железы от молодых животных старым приводит к быстрому повышению уровня гуморального тимусного фактора, а также восстанавливает способность Т-лимфоцитов отвечать на митогены. Введение экзогенного тимозина мышам линии NZB снижает продукцию антител В-лимфоцитами на Т-независимые антигены и восстанавливает супрессорную функцию Т-клеток у старых животных. Кроме того, тимозин значительно ослабляет явления аутоиммунного поражения, в частности снижается уровень антител к ДНК и РНК.
В вилочковой железе тимэктомированных больных СКВ обнаруживаются те же гистологические изменения, что и у мышей линии NZB. У больных СКВ также замечено снижение уровня тимозина. И при СКВ, и у мышей линии NZBXNZW выявлены тимоцитотоксические аутоантитела; появление их у мышей совпадает с угнетением большинства Т-клеточных функций, поэтому можно предположить, что эти антитела могут участвовать в развитии Т-клеточной дисфункции и при СКВ. Высказано предположение, что антитела к Т-лимфоцитам-супрессорам вызывают подавление генерации этих клеток, препятствуют передаче супрессорного сигнала В-лимфоцитам и Т-лимфоцитам-эффекторам, что создает условия для гиперпродукции аутоантител В-лимфоцитами и деструкции клеток-мишеней Т-лимфоцитами-киллерами. Однако точный механизм формирования дефектности супрессорной системы Т-лимфоцитов в настоящее время еще не известен; возможно что определенную роль может играть персистирующая вяло текущая вирусная инфекция.
В последние годы значительно возрос интерес к изучению генетических нарушений при СКВ. По данным различных авторов, СКВ развивается у 5—10% близких родственников больных СКВ. У членов семьи пациентов обнаружены более высокий уровень иммунного гамма-глобулина, широкое распространение ревматоидного фактора, антинуклеарных антител. У некоторых родственников выявляются волчаночные клетки и ложноположительные реакции на сифилис. Изучение факта семейного возникновения СКВ и других диффузных заболеваний соединительной ткани привело к рассмотрению этой группы болезней с точки зрения генетической детерминированности нарушений иммунологического гомеостаза.
Исследование хромосомного аппарата клеток кожи больных СКВ обнаружило изменения кариотипа, преимущественно в сторону снижения количества хромосом, наличия хромосом V пары с пробелами длинного плеча, которые в клетках пораженной кожи встречались почти вдвое чаще, чем в клетках клинически здоровой кожи [Егоркина Д. А., 1977].
В настоящее время обсуждается зависимость между возникновением СКВ и генетическими маркерами HLA-системы. Недавние работы показали связь между СКВ и HLA-AB-гаплотипами в семьях с множественными случаями СКВ. Вместе с тем обнаружение различных гаплотипов, сходных в разных семьях, указывает на то, что более чем HLA-A- и В-гены может иметь значение какой-то сцепленный генетический фактор. Оказалось возможным выделить антиген HLA-D зоны на В-лимфоцитах, причем обследование с помощью современных генетических методик семей, в которых было более одного случая СКВ, выявило тесную связь болезни с аллоантигенами определенных В-лимфоцитов. Однако для развития генетически обусловленной СКВ недостаточно лишь генетических маркеров, необходимы разрешающие факторы внешней среды (вирусные инфекции, инсоляция, лекарственные воздействия, контакт с больными СКВ), которые, как правило, приводят к формированию неспецифических иммунных нарушений организма, реже вызывают продукцию антинуклеарных антител и даже отдельные симптомы болезни, не приводя к клиническим проявлениям развернутой СКВ. И только некоторые генетически предрасположенные лица под влиянием внешних разрешающих факторов заболевают СКВ.
Дальнейшее изучение роли генетических нарушений при СКВ позволит не только углубить представление о патогенезе заболевания, но и, возможно, найти подход к первичной его профилактике.
Близким к генетической теории возникновения СКВ является предположение, высказанное в самое последнее время, о том, что природа люпусного диатеза кроется в генетически обусловленной недостаточности по W-ацетилтрансферазе [Подымов В. К., 1979], однако эта концепция не подкреплена еще научно-практическими наблюдениями и нуждается в дальнейшей разработке.
На основании приведенных данных представляется правомочным следующее предположение патогенеза органных повреждений при СКВ. У лиц с генетическим предрасположением инфицирование тимоцитотропными вирусами приводит к нарушению функции вилочковой железы, снижению уровня тимозина с последующим угнетением активности Т-лимфоцитов-супрессоров. В таких условиях происходит срыв толерантности. В-лимфоциты, не контролируемые в достаточной степени, начинают усиленную выработку аутоантител, широкий спектр которых и определяется в сыворотках больных СКВ. Антитела к ДНК в присутствии комплемента образуют растворимые комплексы, фиксирующиеся при определенных условиях на капиллярной стенке гломерул или сосудов других органов и создают очаги повреждения тканей. Т-лимфоциты-эффекторы, вышедшие из-под контроля Т-лимфоцитов-супрессоров, инфильтрируют различные органы и при встрече со специфическим антигеном в тканях вырабатывают лимфокины, способствующие повреждению клеток-мишеней.
Наиболее заметным глазным проявлением СКВ, которое следует принимать во внимание при диагностике этого заболевания, является ретинопатия [Маланова Н. Л, Павлова Л. Т., 1975]. Последняя характеризуется появлением мягких, ватообразных очагов в перипапиллярной области сетчатки. Клинические очаги выглядят так же, как и при гипертонической ретинопатии. Они представляют собой очаговые инфаркты в слое нервных волокон и гистологически проявляются образованием цитоидных тел и отеком терминальных нервных волокон. В более тяжелых случаях обнаруживаются также геморрагии, отек диска зрительного нерва и сетчаткой.
Следует отметить, что своевременное лечение СКВ позволяет предупредить развитие ретинопатии. Поэтому в настоящее время в развитых странах поражение сетчатки при этом заболевании встречается значительно реже, чем ранее. Так, по данным D.Н. Gold и соавт. (1972), частота ретинопатии при СКВ в одном из районов Англии за последние годы уменьшилась с 28 до 3,3%.
Лечение СКВ включает использование салицилатов, антималярийных медикаментов (хлороквин), кортикостероидов и в наиболее упорных случаях иммуносупрессивных средств. Следует отметить, что при длительном лечении большими дозами хлороквина может развиться ретинопатия, которая ошибочно может быть принята за проявление системной красной волчанки. Диагноз осложняется и тем, что отмена препарата не всегда предупреждает дальнейшее прогрессирование процесса в сетчатке [Gold D. Н., 1975].
↑ Склеродермия
Склеродермия (системный прогрессирующий склероз) — прогрессирующее соединительнотканно-сосудистое полисиндромное заболевание, в основе которого лежат фиброзно-склеротические процессы.
Этиология и патогенез до конца не выяснены. В последние годы обсуждается вопрос о вирусной природе заболевания. Предрасполагающими моментами являются генетические факторы и нейроэндокринные сдвиги. Установлено увеличение биосинтеза коллагена и неофибриллогенеза (по эмбриональному типу), что имеет прямое отношение к безудержному фиброзу, свойственному системной склеродермии. Большое значение уже на ранних стадиях болезни имеют нарушения микроциркуляции и реологических свойств крови в виде повышения вязкости агрегации тромбоцитов, способствующих развитию тромбоваскулитов (В. А. Насонова).
Системной склеродермией болеют преимущественно женщины зрелого возраста. Заболевание, как правило, развивается медленно; острое и подострое течение болезни встречается реже. Первыми проявлениями болезни бывают или синдром Рейно, или артралгии, или умеренное нарушение трофики, реже — повышение температуры тела, похудание и астеническое состояние. Начавшись с одного или нескольких указанных признаков, заболевание со временем приобретает черты генерализованного, многосиндромного страдания.
Самым характерным признаком склеродермии является поражение кожи, особенно лица и конечностей. Сначала оно проявляется распространенным плотным отеком, не оставляющим ямки после надавливания. Затем развиваются уплотнение и атрофия кожи («мумификация»). Кожа у больных склеродермией становится необычно пестрой: участки пигментации чередуются с участками депигментации, отек — с атрофией, выявляются телеангиэктазии, гнойнички и язвочки. Весьма характерно облысение.
Поражение суставов с упорной артралгией и выраженной деформацией наблюдается у подавляющего большинства больных (80—90%). Несмотря на выраженную деформацию суставов, рентгенологически определяются весьма умеренные изменения. Характерным признаком является остеолиз концевых, а иногда и средних фаланг пальцев. Мышечный синдром (фиброзирующий интерстициальный фиброз) проявляется сначала уплотнением, а затем атрофией мышц. Фиброзирующие изменения в мышцах, коже и сухожилиях приводят в конечном итоге к развитию контрактур. Отложение солей кальция в подкожной клетчатке наблюдается почти у каждого третьего больного.
Сердце и сосуды поражаются почти у всех больных. Склеродермический кардиосклероз сопровождается болями в области сердца, одышкой, различными нарушениями ритма. Патологический процесс может локализоваться и в эндокарде, и в перикарде. И тем не менее сердечная недостаточность при склеродермии развивается сравнительно редко. С поражением сосудов связано развитие синдрома Рейно, телеангиэктазий, гангрены пальцев, тяжелых висцеральных поражений, в частности почек, желудочно-кишечного тракта. Весьма характерным симптомом является дисфагия. В легких обычно развивается диффузный или очаговый пневмосклероз с преимущественной локализацией в базальных отделах и адгезивный плеврит.
При склеродермии поражаются вегетативный и центральный отделы нервной системы (полиневриты, вегетативная неустойчивость, склероз сосудов головного мозга) и железы внутренней секреции с развитием полигландулярной недостаточности.
Поражение слизистых оболочек наблюдается при склеродермии весьма часто и протекает в виде хронического конъюнктивита, нередко с утолщением и уплотнением кожи век. Особенно тяжело поражение глаз протекает при одновременном вовлечении в процесс околоушных и других слизистых желез. В таких случаях заболевание протекает по типу сухого синдрома (синдрома Сьегрена). Синдром Сьегрена при системной склеродермии наблюдали
Е. М. Тареев (1965), Е. Herrington и J. Dewar (1951), М. Shearn (1960). Описаны также укорочение сводов конъюнктивальной полости, эписклерит и ретинопатии с единичными ватообразными очагами.
Продолжение в следующей статье: Диффузные воспалительные заболевания соединительной ткани и сосудов | Часть 2.
---
Статья из книги: Патология органа зрения при общих заболеваниях | Комаров Ф.И., Нестеров А.П., Марголис М.Г., Бровкина А.Ф.


Комментариев 0