Хирургическое лечение

Содержание:
Описание
В 1857 г. A. Graefe произвел первую антиглаукоматозную операцию — иридэктомию. В течение почти 50 лет эта операция была по существу единственной. В 1887 г. А. Н. Маклаков предложил первую фистулизирующую операцию, которую он назвал косой склеротомией. Однако только после опубликования работ F. Lagrange (1906) и R. Elliot (1909) фистулизирующие операции заняли господствующее положение среди методов хирургического лечения глаукомы. В 40-х и особенно 50-х годах широкое распространение получает иридэнклейзис — операция ущемления радужки в лимбальном разрезе склеры, предложенная еще в 1903 г. A. Herbert и усовершенствованная S. Holth (1907).Наиболее совершенный вариант фистулизирующих операций, неточно названный трабекулэктомией, появился в 60-х годах [Касимов Т. Я., 1966; Cairns J., 1967]. Большое количество модификаций этой операции направлено на улучшение ее эффективности. К ним можно отнести трабекулостомию [Груша О. В., Соколовский Г. А., 1981], трабекулоцистостомию [Краснов М. М., 1980], различного рода интрасклеральные имплантации [Краснов М. М. и др., 1984; Абрамов В. Г. и др., 1985; Егоров Е. А., Бабушкин А. Э., 1987; Черкунов Б. Ф., 1988].
Особое положение в истории развития хирургического лечения глаукомы занимают циклодиализ и операции на цилиарном теле. Идея и техника циклодиализа была предложена L. Heine (1905). Эта операция не получила распространения, так как часто давала лишь временный эффект. Однако в отдельных случаях, особенно при афакической глаукоме, ее производят и в настоящее время.
A. Vogt (1936) разработал методику частичного выключения цилиарного тела с помощью перфорирующей диатермокоагуляции. В дальнейшем было предложено несколько новых методик хирургического воздействия на цилиарное тело или питающие его сосуды, цель которых — уменьшить скорость образования водянистой влаги.
Более ясное представление о механизмах повышения внутриглазного давления при глаукоме послужило основанием для разработки патогенетически обоснованных способов хирургического лечения первичной глаукомы [Краснов М. М., 1967]. Среди них следует отметить методы неполной фистулизации дренажной системы глаза: в одних случаях создают фистулу между передней камерой и шлеммовым каналом (трабекулотомия), в других — между последним и субконъюнктивальным пространством (синусотомия).
В 1968 г. М. М. Краснов разработал метод хирургического расширения УПК при хронической ЗУГ. Эта операция получила название «иридоциклоретракция». Из новых операций следует отметить склерангулореконструкцию [Пучков С. Г. и др., 1972] и глубокую склерэктомию [Федоров С. Н., 1974]. Авторы полагают, что в результате этих операций водянистая влага всасывается в склеральные и внутриглазные сосуды. Неперфорирующий вариант глубокой склерэктомии позволяет снизить ВГД без вскрытия глазного яблока [Соловьева Г. М., Козлов В. И., 1987]. Существенные успехи достигнуты в лечении неоваскулярной и злокачественной глаукомы а также некоторых других сложных случаев вторичной глаукомы.
Количество антиглаукоматозных операций, описанных в литературе, очень велико и ежегодно увеличивается. Ниже будут рассмотрены только те из них, которые изучены в нашей клинике и используются нами в повседневной работе. Сведения о других операциях читатель может найти в «Руководстве по глазной хирургии» (1988).
↑ Показания к операции
В настоящее время не существует общепринятого мнения относительно показаний к хирургическому лечению глаукомы. Диапазон взглядов на эту проблему широк: от рекомендации производить оперативное вмешательство сразу же после установления диагноза глаукомы до полного отказа от хирургического лечения. По нашему мнению, нельзя согласиться с крайними мнениями. Во многих случаях отказ от операции или несвоевременное ее выполнение приводит к прогрессирующему падению зрительных функций и слепоте [Козлов В. И., Поскачина Т. Р., 1984]. Вместе с тем антиглаукоматозные операции, особенно фистулизирующие, далеко не безобидны.
Фистулизирующие операции позволяют создать новые пути оттока водянистой влаги из глаза. В отличие от лазерных вмешательств их эффективность не зависит от состояния дренажной системы оперируемого глаза. С помощью этих операций можно снизить ВГД до нормального уровня в любой стадии глаукомы и при любом исходном значении офтальмотонуса. Вместе с тем фистулизирующим операциям присущи и серьезные недостатки. У 10—25% оперированных больных в отдаленные сроки после операции возникает рубцовая блокада склеральной подушечки или склеральной фистулы [Абрамов В. Г. и др., 1988]. Особенно часто это осложнение наблюдается у больных молодого и среднего возраста. Повторные операции в таких случаях часто также неэффективны. Неприятным осложнением является постепенное истончение конъюнктивы в зоне операции с образованием кистозной конъюнктивальной подушечки, которая может наползать на роговицу. Помимо того, что такая подушечка вызывает постоянные неприятные ощущения у больного, она представляет большую опасность из-за возможности возникновения эндофтальмита.
Основным недостатком всех разновидностей фистулизирующих операций является грубое нарушение гидродинамики глаза. Водянистая влага из задней камеры глаза переходит в переднюю, в основном не обычным путем, через зрачок, а выбирая более легкий путь — через колобому радужки. Отсюда основная часть вновь образованной влаги сразу же оттекает из глаза через склеральную фистулу. Таким образом, большая часть передней камеры заполнена влагой, которую можно назвать застойной, так как она обновляется очень медленно. Свежие порции жидкости проходят укороченный путь из задней камеры в фильтрующую подушечку. Происходит как бы шунтирование естественных циркуляторных путей водянистой влаги. Новый путь (шунт) соединяет накоротке заднюю камеру глаза с субконъюнктивальным пространством.
В результате этого нарушается питание трабекулярного аппарата и хрусталика. У многих больных в первые месяцы и годы после успешной операции развивается и быстро прогрессирует катаракта. После операции значительно ускоряются также дистрофические изменения в естественных путях оттока, особенно в трабекулярном аппарате. Последний к тому же забивается продуктами метаболизма, мукополисахаридами, клеточным детритом и гранулами пигмента из-за резкого снижения эффективности функциональных механизмов промывания и очистки фильтрующей системы глаза. В результате, если фильтрующая подушечка с течением времени блокируется рубцом, то ВГД повышается значительно выше того уровня, который был до оперативного вмешательства. На таких глазах снижается и гипотензивный эффект медикаментозной терапии и лазерного излучения, так как эти методы основаны на стимуляции естественных путей оттока.
Опасные последствия для глаза может иметь временная или постоянная гипотония, развивающаяся после антиглаукоматозных операций. К ним относятся внутриглазные геморрагии, кистозная макулярная дистрофия, преретинальный фиброз и в особенно тяжелых случаях атрофия глазного яблока. Частой причиной снижения зрительных функций после антиглаукоматозной операции служит катаракта.
Таким образом, есть серьезные доводы «за» и «против» хирургического лечения глаукомы. С учетом этого можно сформулировать только ориентировочные показания к выполнению оперативных вмешательств при различных клинических формах глаукомы.
Лечение ОУГ и хронической ЗУГ начинают с использования консервативных методов. При недостаточной эффективности медикаментозной терапии показано оперативное (или лазерное) вмешательство. В понятие «недостаточная эффективность» входят повышенное ВГД, прогрессирующие изменения поля зрения или ДЗН при офтальмотонусе в зоне высокой нормы. Операция показана также во всех случаях, когда больной по тем или иным причинам не выполняет назначения врача либо не может систематически проверять ВГД, а также состояние глаз и зрительных функций.
При лечении закрытоугольной глаукомы с относительным зрачковым блоком и «ползучей» глаукомы рекомендуется раннее оперативное вмешательство. Операция прерывает механизм, который вызывает блокаду угла передней камеры корнем радужки. Консервативное лечение при этой форме глаукомы имеет вспомогательное значение. Хирургическое лечение особенно показано в начальной стадии заболевания, когда еще нет вторичных изменений в углу передней камеры и дренажной системе глаза. В связи с этим при остром приступе глаукомы в одном глазу рекомендуют с профилактической целью производить иридэктомию (лучше лазерную) и на втором глазу, который находится в преглаукоматозном состоянии.
В генезе закрытоугольной глаукомы с плоской радужкой относительный зрачковый блок не играет существенной роли. При этой форме глаукомы предпочтение отдают консервативным методам (миотикам) и только при их неэффективности производят операцию.
При витреохрусталиковом блоке обычные антиглаукоматозные операции не только неэффективны, но и, как правило, приводят к ухудшению состояния глаза. После иридэктомии и фистулизирующих операций хрусталик смещается кпереди и явления заднего блока усиливаются. При этой форме глаукомы хирургическое лечение показано только в случае отсутствия эффекта от консервативной терапии. Больного следует предупредить об опасности операции.
При остром приступе закрытоугольной глаукомы операцию производят не позднее чем через 1 сут после поступления больного в стационар при неэффективности медикаментозного лечения. Если же приступ удается купировать с помощью консервативных методов, то операцию можно отложить на несколько дней, с тем чтобы прошли остаточные воспалительные явления. Однако не следует затягивать с операцией на длительный срок во избежание возникновения нового приступа глаукомы.
Большие трудности возникают при решении вопроса о целесообразности хирургического лечения больных с далеко зашедшей глаукомой на единственном видящем глазу. A. Haas (1949) указывает, что операция в таких случаях часто ведет к слепоте, и рекомендует ограничиться медикаментозным лечением. Однако Н. Б. Лукова и соавт. (1987) пришли к выводу, что глаукома с низкими функциями на единственном глазу не является противопоказанием к хирургическому лечению. Этот вывод соответствует и нашему опыту. Вместе с тем следует учитывать индивидуальные особенности больного, его общее состояние и возраст. Если ранее была выполнена операция на слепом глазу, то результаты операции также необходимо принять во внимание. Очень часто операции дают сходные результаты и сопровождаются одинаковыми осложнениями на обоих глазах. Особое внимание следует обратить на вторичную злокачественную глаукому. Если она возникла на одном глазу, то следует ожидать этого осложнения и на втором.
[banner_centerrs] {banner_centerrs} [/banner_centerrs]
↑ Операции, нормализующие циркуляцию водянистой влаги внутри глаза
В эту группу входят операции, устраняющие последствия зрачкового и хрусталикового блоков:
- иридэктомия,
- иридоциклоретракция,
- экстракция хрусталика,
- удаление жидкости из дополнительной камеры.
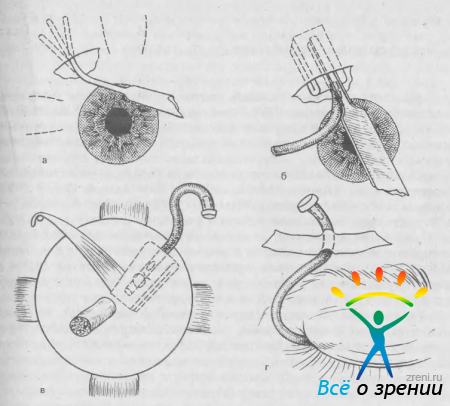
Иридэктомия. Операция устраняет последствия зрачкового блока, создавая новый путь для движения жидкости из задней камеры в переднюю. В результате выравнивания давления в камерах глаза исчезает бомбаж радужки и открывается угол передней камеры.
Техника иридэктомии заключается в следующем. В верхненаружном сегменте глазного яблока приготовляют небольшой конъюнктивальный лоскут шириной около 3 мм. При такой локализации лоскута верхневнутренний сегмент остается свободным и в последующем здесь может быть выполнена другая операция, например трабекулэктомия. Лоскут отсепаровывают до лимба, и на 0,5 мм кзади от последнего производят несквозной разрез лимбосклеральной ткани длиной около 2 мм. На края разреза накладывают препараторный шов. Затем лезвием бритвы по надрезу вскрывают переднюю камеру. Если разрез склеры сделан перпендикулярно к поверхности склеры, то обычно корень радужки вставляется в рану самопроизвольно или при легком надавливании на ее заднюю губу. В противном случае радужку приходится извлекать пинцетом. Иридэктомия должна быть периферической, но ее не следует делать очень маленькой. После иридэктомии зрачок должен занять правильную позицию. Если он подтянут кверху, то это свидетельствует об ущемлении в ране волокон радужки. Их следует освободить струей солевого раствора при легком разведении краев раны или шпателем. Если камера опорожнилась во время операции, то ее восстанавливают тем же раствором, завязывают препараторный шов и закрывают 1—2 стежками рану конъюнктивы.
Иридэктомию можно произвести и с помощью роговичного разреза, без конъюнктивального лоскута. В этом случае разрез также следует делать перпендикулярно к поверхности роговицы.
После иридэктомии движение жидкости через зрачок прекращается, исчезает слой жидкости между краем зрачка и передней поверхностью хрусталика, легко образуются задние синехии. В связи с этим в течение нескольких дней после операции инстиллируют в глаз атропин и кортикостероиды, конъюнктивальный шов снимают на 6-й день.
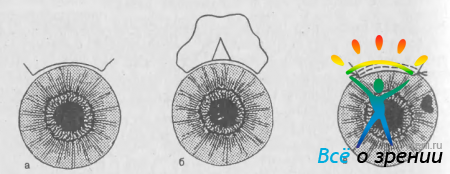
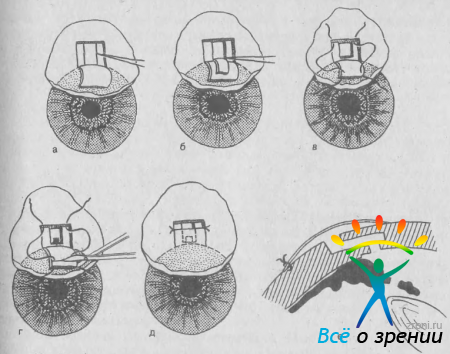
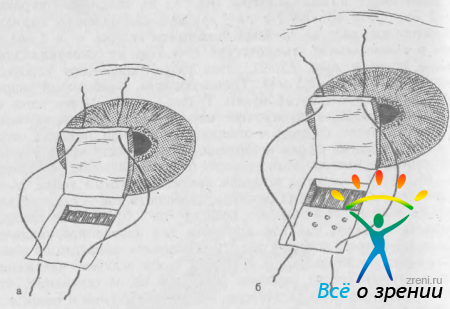
Иридоциклоретракция. Иридоциклоретракцию по М. М. Краснову (1968) производят с целью открыть угол передней камеры в глазах с органическим передним блоком. Автором предложена следующая техника. После выкраивания конъюнктивального лоскута по обе стороны от прямой мышцы сначала намечают, а затем отсепаровывают две П-образные послойные полоски склеры (рис. 58).
Рис. 58. Иридоциклоретракция по М. М. Краснову. Объяснение в тексте.
Концы полосок не доходят до лимба на 3—4 мм. По передней границе расслоения (у основания полосок) в 4 мм от лимба делают сквозные разрезы остающихся слоев склеры. Через разрезы проводят шпатель, с помощью которого отслаивают цилиарное тело и радужку от фильтрующих отделов склеры (циклодиэлиз). Полоски склеры заправляют внутрь, их концы должны выступать за корень радужки.
↑ Фистулизирующие операции
Фистулизирующие операции привлекают офтальмохирургов несложной техникой и высокой эффективностью. Стойкая нормализация офтальмотонуса после операций такого типа наблюдается в 70—90% случаев. Поскольку фистулизирующие операции улучшают отток жидкости из глаза, который обычно затруднен при глаукоме, их до известной степени можно рассматривать как патогенетически обоснованные вмешательства.
После фистулизирующих операций образуются два типа конъюнктивальных подушечек: плоская и кистозная. Подушечка первого типа представляет собой участок слегка приподнимающейся отечной, мутной конъюнктивы в области фистулы, нечетко отграниченный и несколько анемичный. Офтальмотонус снижается до нормального уровня, но может быть и выше нормы. Никогда не бывает гипотонии. Коэффициент легкости оттока обычно не превышает 0,30 мм3/мин на 1 мм рт.ст., часто бывает в пределах низкой нормы или даже патологическим.
Кистозная подушечка состоит из щелей, наполненных жидкостью, с тонкими просвечивающими стенками. Контуры подушечки четко очерчены, нередко она имеет неровную, бугристую поверхность и значительно проминирует кпереди. Иногда такие подушечки имеют тенденцию сползать на роговицу. Внутриглазное давление снижается в большей мере, чем при плоских подушечках, вплоть до развития гипотонии. Коэффициент легкости оттока находится в пределах нормальных значений или даже выше нормы (больше 0,5— 0,6 мм /мин на 1 мм рт.ст.). Кистозные подушечки у некоторых больных имеют тенденцию прогрессивно растягиваться и истончаться с течением времени. Одновременно уменьшается и сопротивление оттоку жидкости из глаза.
Механизм образования фильтрующих подушечек заключается в действии водянистой влаги на соединительную ткань. Исследования в культуре ткани показали, что нормальная камерная влага подавляет развитие фибробластов [Herschler J. et al., 1980]. Вместе с тем вторичная водянистая влага ускоряет пролиферацию этих клеток [Radius R. et al., 1980].
Характер послеоперационной подушечки зависит от состава и количества влаги, находящейся в подконъюнктивальном пространстве. Определенное значение, по-видимому, имеют индивидуальные особенности, природа которых неясна. Мы неоднократно наблюдали больных, у которых после фильтрующих операций образовывались подушечки одинакового характера на обоих глазах. При заращении фистулы на одном глазу часто наблюдается такой же результат и на другом, даже если при этом была произведена более радикальная операция.
Из фильтрующей подушечки жидкость оттекает двумя путями — трансконъюнктивальным и субконъюнктивальным, всасываясь в венозную сеть. Трансконъюнктивальный путь был описан F. Verhoeff (1913). Е. Seidel (1921) разработал флюоресцеиновую пробу, которая позволяет наблюдать фильтрацию жидкости через эпителий, покрывающий фильтрационную подушечку. После успешной корнеосклеральной трепанации обычно обнаруживался положительный флюоресцеиновый тест. Отток жидкости через конъюнктиву усиливался при надавливании на глаз, а у некоторых больных он появлялся только во время компрессии глазного яблока. Это дало основание Е. Seidel считать, что в стенке подушечки образуются поры или канальцы, по которым жидкость оттекает в конъюнктивальную полость.
Существование трансконъюнктивальной фильтрации водянистой влаги при кистозных подушечках наглядно показали М. Galin и соавт. (1966), которые с этой целью использовали присоску. Прозрачную присоску накладывали так, что фильтрующая подушечка оказывалась внутри нее. В присоске создавалось разрежение в 50 мм рт. ст. Через 5—7 мин в ней собиралось достаточное для анализа количество жидкости, содержание аскорбиновой кислоты в которой было столь же высоким, как и в камерной влаге.
Другой путь оттока жидкости из подушечки заключается во всасывании ее из подконъюнктивального пространства в сосудистую сеть конъюнктивы и эписклеры. Скорость всасывания при разлитых подушечках выше, чем при ограниченных. В глазах с плоской фильтрующей подушечкой этот путь оттока является единственным.
В некоторых случаях в результате постепенного закрытия фистулы конъюнктивальная подушечка перерождается, заполняясь гипертрофированной субконъюнктивальной тканью. Для предупреждения рубцевания подушечки и фистулы с успехом используют 5-флюрурацил [Rubosky Н. S., Ruderman J., 1989]. Препарат в дозе 0,2 мл вводят под конъюнктиву тотчас после операции и затем через день еще 2—4 раза. Для устранения кистозной подушечки используют повторные криокоагуляции или пластику. Хорошие результаты мы получали от имплантации тонкого слоя трупной склеры или роговицы (5—7 мм) между конъюнктивой и склерой в зоне фистулы. Имплантат фиксируют к склере двумя швами.
Трабекулэктомия. J. Cairns (1968) описал операцию, при которой субсклерально удаляют участок глубокой пластинки склеры, содержащий участок трабекулярной диафрагмы и шлеммова канала. Он назвал эту операцию трабекулэктомией, полагая, что водянистая влага получает прямой доступ в перерезанные концы канала, минуя трабекулу. Однако в дальнейшем было установлено, что такой механизм оттока наблюдается в редких случаях. Чаще перерезанные концы канала сдавливаются и затем рубцуются. Более тою, оказалось, что аналогичные результаты могут быть получены и в том случае, если в удаляемом участке ткани содержится не трабекула, а роговица [Джалиашвили О. А., Гулякевич Л. Н., 1981]. Полагают, что после трабекулэктомии отток влаги из глаза происходит как через поверхностный склеральный лоскут, так и через фистулу. формирующуюся по его краю.
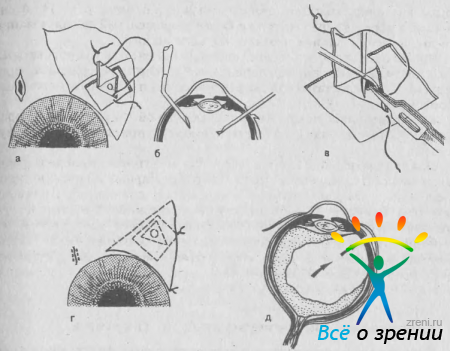
Трабекулэктомию, как и все фистулизирующие операции, начинают с приготовления конъюнктивального лоскута. Используют два типа лоскутов: основанием к лимбу и основанием к своду. Для получения лоскута первого типа производят дугообразный разрез конъюнктивы и теноновой капсулы в 7—8 мм от лимба. Тенонову капсулу отсепаровывают от склеры до лимба. В области лимба не всегда можно выделить его переднюю границу тупым путем. Это связано с тем, что тенонова капсула разделяется у лимба на два листка: один прикрепляется к задней, а другой — к передней границе роговичного лимба. Если задний листок плотный, то его следует рассечь ножницами. Тонкий листок легко отодвигается кпереди скребцом. Термокаутером или нагретым мышечным крючком прижигают кровоточащие сосуды, а также те сосудистые веточки, через которые пройдет разрез склеры. Прижигания должны быть поверхностными, без грубого нарушения структуры ткани.
Для приготовления конъюнктивального лоскута основанием к своду производят перитомию у лимба на протяжении около 8 мм и один или два радиальных надреза длиной 2—3 мм (рис. 59).
Рис. 59. Формирование конъюнктивального лоскута основанием к своду. а — разрез конъюнктивы; б — обнаженный участок лимба и склеры; в — лоскут фиксирован у лимба двумя швами.
По окончании операции лоскут фиксируют у лимба 2—3 швами. При использовании такого лоскута после операции реже возникает послеоперационный птоз, но возможно подтекание водянистой влаги между швами.
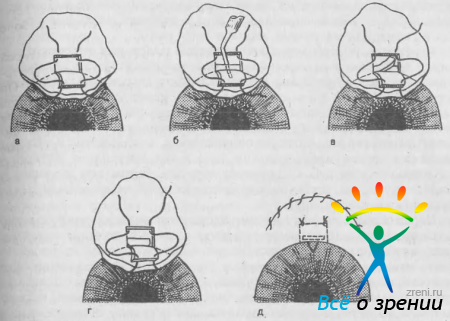
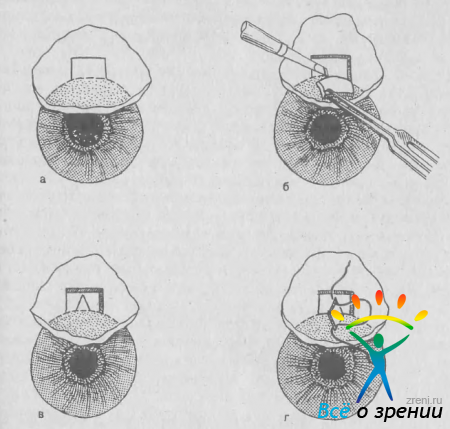
Следующий этап операции — приготовление поверхностного склерального лоскута основанием к лимбу. Размеры лоскута варьируют от 3 до 5 мм, толщина — от 1/3 до 1/2 толщины склеры, форма может быть треугольной, квадратной или трапециевидной. При выкраивании лоскута следует избегать крупных сосудов, идущих от эмиссария. Склеральный лоскут отсепаровывают от глубокой пластинки склеры до появления прозрачной роговичной ткани и в зависимоси от его формы на края лоскута накладывают 1 или 2 препараторных шва (рис. 60).
Рис. 60. Трабекулэктомия. а — приготовление лоскутов конъюнктивы и склеры; б — разрез глубокой лимбальаой пластинки и введение пузырька воздуха в переднюю камеру; в, г — иссечение участка глубокой пластинки; д — лоскуты склеры и конъюнктивы фиксированы швами.
Узким ножом прокалывают роговицу у лимба в стороне от зоны операции. Прокол роговицы не является обязательным элементом операции. Он удобен для восстановления передней камеры, если она опорожняется к концу операции. Поскольку раны роговицы врастают очень медленно, этот же прокол используют для введения воздуха в переднюю камеру в тех случаях, когда в ближайшие дни после операции возникает цилиохориоидальная отслойка. При высоком ВГД в момент прокола можно выпустить часть водянистой влаги, придавливая ножом заднюю губу раны.
Участок глубокой корнеосклеральной пластинки иссекают лезвием, трепаном или кусачками. Мы предпочитаем использовать алмазное лезвие, которым сначала делают сквозной разрез ткани тотчас кпереди от шлеммова канала или через канал. Разрез идет параллельно лимбу через всю ширину склерального кармана. Через него в переднюю камеру вводят небольшой пузырек воздуха для предупреждения ее полного опорожнения в дальнейшем. Второй такой же разрез производят на 1—1,5 мм кпереди от первого в роговичной части субсклерального кармана. Затем тем же лезвием иссекают участок глубокой корнеосклеральной ткани между двумя описанными разрезами.
Через образовавшийся дефект производят периферическую иридэктомию. Иридэктомическое отверстие должно быть шире склерального, чтобы волокна радужки не ущемлялись в ране. Этого достигают, немного смещая радужку в стороны при ее иссечении. Для окончательного отделения радужки от лимбальной раны последнюю придавливают одним шпателем через конъюнктивальный и склеральный лоскуты, а другим поглаживают роговицу от периферии к центру. Затем завязывают препараторный шов (или швы).
Большое значение имеет тщательное зашивание раны конъюнктивы и теноновой оболочки. Для того чтобы конъюнктивальный лоскут и склера не срослись, между ними постоянно должен находиться слой жидкости. Если жидкость подтекает между швами, то фильтрующая подушечка или совсем не образуется, или бывает очень ограниченной по площади. Непрерывный шов обеспечивает лучшую герметизацию раны, чем узловой.
Нельзя сшивать конъюнктиву, не обращая внимание на то, попадает ли в шов тенонова оболочка. Если последнюю не сшить, то ее передняя губа загибается в сторону лимба и прирастает к склере, ограничивая площадь фильтрующей подушечки. При сшивании одной конъюнктивы нарушается герметичность раны и не исключено прорезывание шва.
Если передняя камера опорожнилась во время операции, то ее следует восстановить на операционном столе. С этой целью через прокол роговицы из шприца с тонкой инъекционной иглой вводят изотонический раствор хлорида натрия, часть которого через склеральный разрез выходит под конъюнктиву. Операция заканчивается субконъюнктивальным введением дексазона и антибиотика. В глаз инсталлируют 1% раствор атропина. Больному разрешают ходить через 2 ч после операции.
Трабекулэктомия с увеальным карманом. Операция этого типа отличается от обычной трабекулэктомии тем, что блок глубокой пластинки лимбосклеральной пластинки иссекают так, чтобы обнажился и участок цилиарного тела. Эту модификацию мы применяем с 1970 г. [Нестеров А. П., 1971]. С. Н. Федоров (1974) значительно увеличил размер увеального кармана. Операция Федорова известна под названием «глубокая склерэктомия». После операции водянистая влага оттекает как в субконъюнктивальное, так и в супрацилиарное пространство.
По нашему опыту, эта операция более травматична, чем обычная трабекулэктомия. После нее чаще наблюдаются гифемы и цилиохориоидальная отслойка, но и гипотензивный эффект бывает более выраженным и устойчивым.
Субсклеральная клапанная трабекулотомия. Разработанная нами операция — клапанная трабекулотомия — имеет целью уменьшить травматичность фистулизирующих вмешательств [Нестеров А. П. и др., 1983]. Начальные этапы операции такие же, как и при трабекулотомия. После приготовления конъюнктивального и склерального лоскутов иссекают среднюю пластинку склеры ( 1/3 ее толщины) в пределах склерального кармана. Этот этап операции имеет важное значение и его не следует исключать. Сквозной разрез глубокой пластинки склеры производят через шлеммов канал или по склеральной шпоре (рис. 61).
Рис. 61. Клапанная трабекулотомия (схема). Объяснение в тексте.
Двумя радиальными насечками формируют внутренний клапан шириной 2 мм. Передние концы насечек должны заходить в роговицу. Клапан содержит роговицу, кольцо Швальбе, трабекулу, а иногда и склеральную шпору. Производят периферическую иридэктомию. Закрывают швами наружный склеральный и конъюнктивальный лоскуты.
Главная особенность операции заключается в том, что глубокую пластинку склеры не иссекают, а из нее выкраивают небольшой клапан. Средние слои склеры непосредственно над клапаном иссекают, что приводит к образованию интрасклерального резервуара, из которого жидкость может оттекать не только под конъюнктиву, но и в интрасклеральную венозную сеть. В связи с удалением значительной части склеральной ткани в зоне фистулы уменьшается возможность ее рубцового закрытия. Внутренний клапан до некоторой степени регулирует отток водянистой влаги и ВГД, по крайней мере в первые дни после операции, уменьшает тенденцию к развитию гипотонии, а следовательно, и цилиохориоидальной отслойки. Вместе с тем при повышении ВГД клапан смещается кнаружи, тем самым увеличивая отток жидкости по вновь сформированным путям. Стойкая нормализация ВГД в отдаленные сроки после этой операции наблюдалась в 80% случаев. Клапанная трабекулотомия может быть дополнена образованием увеального кармана путем иссечения полоски из глубокой склеральной пластинки кзади от склеральной шпоры (рис. 62).
Рис. 62. Клапанная трабекулотомия с увеальным карманом (схема).
Трабекулэктомия с интрасклеральным каналом. Операция разработана с целью предотвращения возникновения низко расположенной, наползающей на роговицу кистозной подушечки [Нестеров А. П. и др., 1986].
После приготовления конъюнктивального лоскута выкраивают прямоугольный склеральный лоскут (5х5 мм) основанием к лимбу. Его отсепаровывают на 1/3 толщины склеры и укорачивают ножницами на 1 мм. Затем под ним формируют интрасклеральный канал. Для этого наносят два радиальных разреза через средние слои склеры (рис. 63, 1).
Рис. 63. Трабекулэктомия с интрасклеральным каналом (схема). Объяснение в тексте.
Разрезы идут от роговицы параллельно краям склерального кармана на расстоянии 1 мм от каждого из них. Среднюю часть склеральной пластинки, ограниченную надрезами (толщиной около /з толщины склеры), иссекают (рис. 63, 2). Таким образом в склеральном кармане формируют канавку длиной 5 мм и шириной 3 мм (рис. 63, 3). В переднем конце канавки производят трабекулэктомию и иридэктомию так, как описано выше (рис. 63, 4). Поверхностный склеральный лоскут укладывают на место и фиксируют двумя швами (рис. 63, 5). Таким образом формируют склеральный канал, открытый с одной стороны в переднюю камеру, а с другой — в подконъюнктивальное пространство в 4 мм от лимба. Конъюнктивальный разрез закрывают непрерывным швом. На рис. 63, 6 схематично показан ход интрасклерального канала.
После этой операции нормализация ВГД в отдаленные сроки отмечена у 92% больных (из 48 наблюдавшихся).
Резекция эписклеры в хирургии глаукомы. Наиболее частой причиной неудач при фистулизирующих операциях является рубцевание фильтрующей подушечки. Источником рубцовой ткани являются теноновая капсула и особенно часто эписклера. Действительно, эписклеральный слой в отличие от собственно склеры содержит большое количество кровеносных сосудов и клеточных элементов. Известно также, что эписклера плотнее склеры и менее проницаема для жидкости [Черкасова И. Н., Нестеров А. П., 1976]. результаты изучения особенностей строения и проницаемости лимбальной зоны склеры послужили основанием для использования резекции эписклеры в качестве одного из этапов фистулизирующих операций.
Техника эписклеральной резекции очень проста (рис. 64).
Рис. 64. Резекция эписклеры (схема). а — намечен и б — отсепарован участок эписклеры; в, г — в образовавшемся кармане приготовляют склеральный лоскут для фистулизирующей операции.
После приготовления конъюнктивального лоскута и коагуляции сосудов с помощью лезвия очерчивают, а затем отсепаровывают и удаляют участок эписклеры размером 6x8 мм. При этом крупные сосуды, связанные с эмиссариями, не затрагивают. Затем в зоне, лишенной эписклеральной ткани, производят операцию по выбору хирурга. Сразу после операции формируется широкая, диффузная конъюнктивальная подушечка. Рубцевание подушечки позже 6 мес было отмечено только в 8% случаев (92 операции).
Показаниями к резекции эписклеры служат молодой возраст больного, неудача предыдущей операции на том же или парном глазу. Эписклеральную резекцию не следует производить на глазах с тонкой, атрофичной конъюнктивой, при высокой миопии и у престарелых больных.
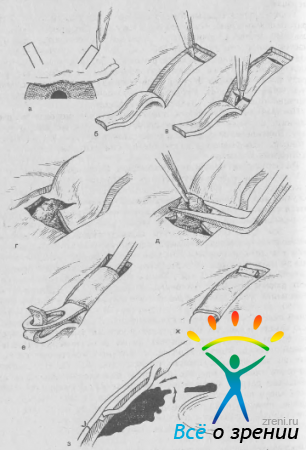
Фильтрующая иридоциклоретракция. Операцию производят с 1981 г. Техника ее заключается в следующем [Нестеров А. П., Колесникова Л. Н., 1984]. После приготовления конъюнктивального лоскута и коагуляции эписклеральных сосудов намечают (рис. 65, 1)
Рис. 65. Фильтрующая иридоциклоретракция (схема). Объяснение в тексте.
и отсепаровывают до лимба (точнее до прозрачной роговичной ткани) две радиальные полоски склеры (на 2/3 ее толщины) шириной 1,5—2 мм (рис. 65, 2). По дну каждого склерального кармана производят два разреза глубокой пластинки склеры — в 5 мм от лимба и в лимбальной зоне, отступя 1—1,5 мм от основания склеральной полоски (рис. 65, 3). Этот разрез дополняют короткой насечкой (длиной 1—1,5 мм). Таким образом, лимбальный разрез имеет форму перевернутой буквы Т (рис. 65, 4). Через один из лимбальных разрезов производят периферическую иридэктомию (рис. 65, 5). Затем шпатель с отверстием на конце проводят через задний склеральный разрез и супрацилиарное пространство в переднюю камеру и выводят наружу через передний лимбальный разрез (рис. 65, 6). В отверстие шпателя вводят свободный конец склеральной полоски. Извлекая шпатель, свободный конец полоски выводят из заднего склерального разреза (рис. 65, 7). Не следует натягивать полоску, так как при этом она плотно придавливает Т-образный разрез, который должен обеспечить фильтрацию водянистой влаги после операции. Для того чтобы ослабить натяжение полоски, нужно слегка надавить шпателем на ее основание, что вызовет смещение полоски кпереди. Рану конъюнктивы и теноновой оболочки закрывают непрерывным швом. На рис. 65, 8 показано положение склеральной полоски после операции.
Фистулизирующая иридоциклоретракция позволяет устранить блокаду УПК, расширить угол камеры, сформировать новый путь ттока жидкости через Т-образный лимбальный разрез, зияние которого обеспечивается интерпозицией в нем склеральной полоски. Последняя также предупреждает чрезмерно быструю фильтрацию жидкости из глаза и послеоперационную гипотонию. Можно думать и об усилении увеосклерального оттока из-за формирования циклодиализной щели и расширения супрацилиарного пространства.
Основным показанием к операции служит повышение ВГД в глазах с ЗУГ при наличии органической блокады УПК. Стойкий гипотензивный эффект после этой операции (без медикаментов) получен в 73% случаев.
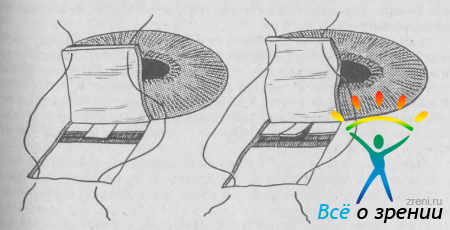
Субсклеральная синусотомия с диатермотрабекулоспазисом. Конъюнктивальный и склеральный лоскуты приготовляют так, как описано выше (рис. 66).
Рис. 66. Субсклеральная синусотомия (схема). а — приготовлен склеральный лоскут, иссечена наружная стенка шлеммова канала, б — нанесенные на склеру диатермокоагуляции вызвали растяжение трабекулярной стенки канала.
Толщина склерального лоскута около 1/3 толщины склеры. Под лоскутом над зоной шлеммова канала иссекают пластинку ткани примерно такой же толщины. Цель этого этапа операции — создание пространства между трабекулой и поверхностным склеральным лоскутом. Упомянутая пластинка склеры нередко включает в себя и всю наружную стенку синуса. Если же над шлеммовым каналом остался тонкий слой ткани, то его осторожно вскрывают лезвием бритвы на протяжении всего склерального кармана. Кзади от склеральной шпоры пуговчатым электродом наносят 3—5 диатермоприжиганий. При этом можно видеть существенное (в 1,5—2 раза) расширение трабекулярнрой стенки синуса и усиление фильтрации водянистой влаги через нее. Склеральный лоскут укладывают на место. Конъюнктивальный разрез закрывают непрерывным швом.
Преимущество описанной техники заключается прежде всего в ее простоте. Во время операции не вскрывают ни переднюю камеру глаза, ни супрахориоидальное пространство. Растяжение трабекулы достигается за счет сморщивания склеры и мышцы Брюкке под влиянием диатермии и последующего рубцевания, поэтому в отличие от описанной выше операции исключается уменьшение эффективности вмешательства из-за ослабления или прорезывания шва.
Профилактическая задняя склерэктомия. Цилиохориоидальная отслойка — наиболее частое и неприятное осложнение фистулизирующих операций. Известно, что задняя склерэктомия, выполненная с профилактической целью во время операции, снижает в несколько раз частоту этого осложнения [Нестеров А. П. и др., 1986; Лукова Н. Б. и др., 1987]. Профилактическая склерэктомия может быть с одинаковым успехом выполнена в верхнем и нижнем сегментах глаза. В нашей клинике ее производят при всех фистулизирующих операциях в верхнем сегменте глаза под общим конъюнктивальным лоскутом. Маленький (1,5 мм) треугольный сквозной склеральный лоскут выкраивают и удаляют в 4—5 мм от лимба в стороне от зоны основной операции или на дне интрасклерального кармана.
↑ Операции, уменьшающие скорость образования водянистой влаги
Механизм действия почти всех операций, уменьшающих скорость образования водянистой влаги, сводится к ожогу или отморожению отдельных участков цилиарного тела либо к тромбозу и выключению питающих его сосудов. Локальные температурные воздействия осуществляют с помощью диатермокаутера, электролиза или криоаппликатора.
Циклокриокоагуляция. Операцию чаще производят в нижнем сегменте глазного яблока под местной, эпибульбарной анестезией. Ретробульбарную анестезию следует применять только при наличии болевого синдрома и раздражении глаза. На конъюнктиву склеры в зоне операции протяженностью от 180 до 200° на 4—5 мин помещают полоску ваты, смоченную анестезирующим раствором (обычно 1—2% раствором дикаина). Пуговчатый или плоский наконечник криоаппликагора диаметром 1—3 мм прикладывают и слегка прижимают к конъюнктиве склеры так, чтобы его передний край находился в 3—4 мм от лимба. Удалять наконечник лучше после его отогревания, в противном случае можно повредить конъюнктиву. Всего наносят 6—8 аппликаций равномерно на протяжении 180-200°
Длительность каждой аппликации зависит от способа охлаждения наконечника: 40 с при использовании углекислоты, 30 с — закиси азота и 6 с — жидкого азота. По нашим данным, чем быстрее замораживаются ткани, тем слабее болевые ощущения во время oперации, менее выражена и более ограничена воспалительная реакция вне зоны контакта тканей глаза с аппликатором. Гипотензивный эффект операции также более выражен при использовании для охлаждения закиси азота и жидкого азота.
После операции в течение нескольких дней в оперированный глаз инсталлируют антибактериальные и кортикостероидные препараты. При недостаточной эффективности операции ее можно повторить через 2—3 нед.
Криокоагуляция показана при афакической глаукоме как вторая операция (при неудаче трабекулэктомии) и при абсолютной глаукоме.
Циклодиатермия. Используемая нами техника циклодиатермии заключается в следующем. После ретробульбарной и поверхностной анестезии с помощью ватного тампончика, смоченного раствором дикаина, наносят 12—15 диатермоприжиганий. Мы используем игольчатый электрод, который вкалываем через конъюнктиву на глубину 1,5 мм. Длительность каждого прижигания 4—5 с. Прижигания наносят в 2 ряда в шахматном порядке на расстоянии 3—5 мм от лимба. Показания к операции и послеоперационное лечение такие же, как и при циклокриокоагуляции.
↑ Операции при неоваскулярной глаукоме
При неоваскулярной глаукоме традиционные фистулизирующие операции неэффективны из-за повторных геморрагий в переднюю камеру и блокады фистулы новообразованной фиброваскулярной тканью. Удовлетворительные результаты получены от введения в УПК трубчатых имплантатов [Алексеев Б. П., Кабанов И. Б., 1986; Molteno A., 1969, 1986; Krupin Т. et al., 1980]. При лечении некоторых сложных случаев вторичной глаукомы получены хорошие результаты глубокой склерэктомии в сочетании с введением в зону фистулы гидрогелевого имплантата [Мороз З. И. и др., 1984]. Ниже описаны операции, выполняемые в нашей клинике.
Фильтрующая витрэктомия (склерцикловитрэктомия). Сущность операции заключается в осуществлении витрэктомии и создании субсклеральной фистулы в зоне плоской части цилиарного тела. Это обеспечивает снижение ВГД и постоянный отток за пределы глаза витреальной жидкости, содержащей вазоформативные факторы, которые обусловливают возникновение рубеоза радужки и УПК. По-видимому, этим объясняется резорбция неоваскулярной мембраны в первые дни после операции [Батманов Ю. Е. и др., 1985].
Этапы операции представлены на рис. 67.
Рис. 67. Фильтрующая витрэктомия (схема). а — начальные этапы операции (объяснение в тексте); б — витрэктомия; в — циклоэктомия; г — конечные этапы операции; д — положение цилиосклеральной фистулы после операции.
Сначала формируют конъюнктивальный и (после удаления участка эписклеры размером 6x6 мм) склеральный лоскуты в зоне плоской части цилиарного тела в верхневисочном сегменте глазного яблока. Затем иссекают участок глубокой пластинки склеры размером 1,5х1,5 мм. В другом сегменте глаза производят радиальный разрез конъюнктивы и прокол склеры, через который в полость стекловидного тела вводят иглу, соединенную с изотоническим солевым раствором. С помощью этой системы в глазу поддерживают постоянное давление — около 10 мм рт. ст. Через первое отверстие в склере, после прокола цилиарного тела, в полость стекловидного тела вводят наконечник витреотома и производят субтотальную витрэктомию. Витреотом и иглу извлекают, иссекают небольшой участок плоской части цилиарного тела, склеральный и конъюнктивальный лоскуты закрывают швами.
Упрощенный вариант этой операции (без использования витреотома) описан Н. М. Сергиенко и соавт. (1989).
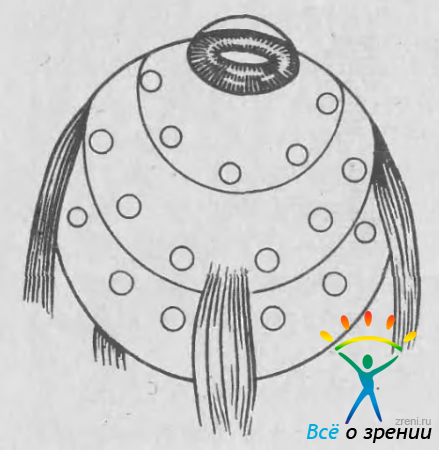
Панретинальная криотерапия в сочетании с циклокриокоагуляцией. Операция показана в тяжелых случаях диабетической ретинопатии, осложнившейся неоваскулярной глаукомой [Колесникова Л. Н. и др., 1985]. С помощью перитомии и радиальных насечек конъюнктивы обнажают склеру по всей окружности глаза. Под прямыми мышцами проводят швы-держалки. Наносят три ряда криоаппликаций: первый ряд на расстоянии 3 мм от лимба, второй — 7 мм, третий — 12 мм (рис. 68);
Рис. 68. Положение криоаппликаций на глазном яблоке при выполнении панретинальной криотерапии и циклокриокоагуляции.
экспозиция 15—20 с, расстояние между аппликациями 2,5—3 мм. На радиальные насечки конъюнктивы накладывают швы.
У половины оперированных достигнута нормализация ВГД, сочетавшаяся с уменьшением калибра и количества новообразованных сосудов в радужке.
Механизм действия операции заключается в деструкции, а затем атрофии значительных зон сетчатки, находившихся до операции в состоянии ишемии. Это приводит к уменьшению выделения вазопролиферативных факторов. Одновременно уменьшается продукция водянистой влаги и снижается ВГД.
↑ Хирургическое лечение злокачественной глаукомы
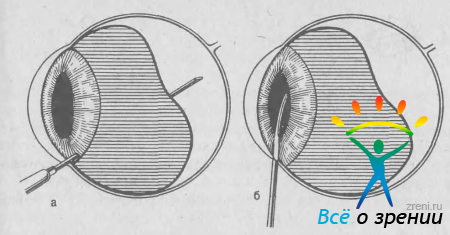
Различают факическую и афакическую злокачественную глаукому. Последняя хорошо поддается хирургическому лечению, основной принцип которого заключается в удалении части содержимого из полости стекловидного тела, восстановлении передней камеры и вскрытии передней гиалоидной мембраны. Эту операцию обычно производят с помощью витреотома. В отсутствие последнего через прокол роговицы и периферическую колобому радужки в глаз вводят иглу Цур—Неддена. Шприцем отсасывают 0,75—1 мл жидкости из заднего отдела стекловидного тела. Через тот же роговичный прокол в переднюю камеру вводят пузырек воздуха и затем ножом Сато вскрывают переднюю гиалоидную мембрану (рис. 69).
Рис. 69. Витреорепозиция при злокачественной афакической глаукоме: после удаления ретровитреальной жидкости (а) производят дисцизию передней гиалоидной мембраны (б).
Роговичную рану закрывают швом.
Следует отметить, что использование ультразвукового витреотома [Мовшович А. И., Батманов Ю. Е., 1983] существенно повышает эффективность операции.
Хирургическое лечение факической злокачественной глаукомы представляет собой более трудную задачу, так как вскрытие передней гиалоидной мембраны сопряжено с риском повреждения хрусталика. А. И. Мовшович и Ю. Е. Батманов (1983) предложили производить витрэктомию через плоскую часть цилиарного тела с помощью ультразвукового витреотома. Ультразвуковое облучение вызывает разжижение стекловидного тела и повышение проницаемости гиалоидной мембраны. Таким образом наряду с уменьшением объема заднего сегмента глаза достигается выравнивание давления по обе стороны от гиалоидной мембраны. Это приводит к восстановлению передней камеры и оттока жидкости по естественным путям.
Наиболее радикальными методами хирургического лечения факической злокачественной глаукомы являются описанная выше фильтрующая витрэктомия и витрэктомия в сочетании с экстракцией хрусталика.
↑ Некоторые новые операции
Непроникающая глубокая склерэктомия [Федоров С. Н. и др., 1989]. После приготовления конъюнктивального и склерального лоскутов иссекают глубокую пластинку склеры над цилиарным телом (оставляя только тонкий, местами перфорированный слой) вместе с наружной стенкой шлеммова канала и участком корнеосклеральной ткани кпереди от канала. При этом обнажаются вся корнеосклеральная трабекула и периферия десцеметовой оболочки. При появлении выраженной фильтрации водянистой влаги операцию заканчивают наложением швов на склеральный и конъюнктивальный лоскуты. Операция показана при открытоугольной глаукоме. Н. М. Сергиенко и соавт. (1993) предложили дополнить эту операцию лазерной трабекулотомией. Через 10—14 дней после непроникающей глубокой склерэктомии под контролем гониоскопа с помощью импульсного ИАГ-лазера (энергия импульса 1,9 мДж, диаметр — 25 мкм, экспозиция — 20 не, количество импульсов — 20—35) вскрывают трабекулярную диафрагму. Авторы отмечают безопасность и высокую эффективность новой двухэтапной операции.
Глубокая склерэктомия с эксплантодренированием [Чеглаков К). А., 1989]. Сущность операции заключается в том, что в дополнение к глубокой склерэктомии производят подшивание гидрогелевого эксплантата (6x3 мм) под склеральным лоскутом так, чтобы его внутренний конец входил в переднюю камеру на глубину около 1 мм. Эксплантат полиметилэтиленгликоль представляет собой гель, содержащий 70% воды. В отличие от гидрофобных имплантатов он не травмирует ткани реципиента [Мороз 3. И. и др., 1985]. Показанием к операции служит тяжело протекающая вторичная глаукома.
Хирургическая декомпрессия зрительного нерва [Шмырева В. Ф. и др., 1989]. Разработаны два метода декомпрессии ДЗН: трансвитреальный и экстрасклеральный. Сущность обоих методов заключается в расширении склерального канала, через который проходят волокна зрительного нерва, путем рассечения склерального кольца вокруг него.
При трансвитреальном подходе нож проводят к ДЗН через плоскую часть цилиарного тела (в 5 мм от лимба) и стекловидное тело. Под биомикроскопическим контролем в бессосудистой зоне делают разрез склерального кольца на глубину 1 мм.
При экстрасклеральном подходе разрезают конъюнктиву, отсекают внутреннюю прямую мышцу, поворачивают глаз кнаружи и ножом Сато рассекают склеральное кольцо у зрительного нерва на протяжении 4 мм (глубина разреза около 1 мм). Пришивают мышцу на место и рану конъюнктивы закрывают швом.
После декомпрессии зрительного нерва авторы наблюдали расширение склерального канала, улучшение кровоснабжения сетчатки и зрительного нерва, повышение зрительных функций.
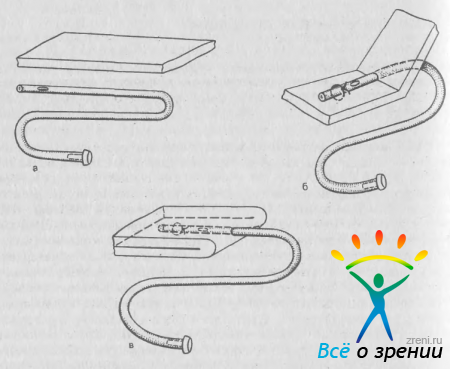
Субтеноновая имплантация инфузионной системы. Цель операции — обеспечить введение медикаментов в задний отдел тенонова пространства для стимуляции гемодинамики и обменных процессов в заднем сегменте глаза и зрительном нерве [Нестеров А. П., Басинский С. Н., 1991]. Инфузионная система (ИС) состоит из сложенной вдвое полоски коллагеновой губки (30х6 мм) и силиконовой трубки (рис. 70).
Рис. 70. Приготовление инфузионной системы. а — подготовлены полоска коллагеновой губки и силиконовая трубка; б — трубка введена между двумя листами губки и фиксирована швом; в — инфузионная система, подготовленная к имплантации.
После разреза конъюнктивы и теноновой оболочки в верхневисочном сегменте глаза коллагеновую губку проводят в теноновую щель к заднему полюсу глазного яблока. Разрез конъюнктивы закрывают непрерывным швом, а свободный конец силиконовой трубки выводят на лоб и фиксируют с помощью липкой ленты (рис. 71).
Рис. 71. Субтеноновая имплантация инфузионной системы. а — разрез конъюнктивы и подготовка канала в теноновом пространстве; б — введение в канал коллагеновой губки; в — положение имплантата относительно других структур глаза; г — силиконовая трубка фиксирована на лбу больного.
В послеоперационном периоде через трубку вводят лекарственные препараты (сосудорасширяющие, антиагреганты, антиоксиданты). Длительность курса лечения 7—10 дней, после чего трубку удаляют. Имплантацию ИС можно сочетать с антиглаукоматозной операцией. По нашим данным, существенное расширение поля зрения было отмечено у 80% из 76 больных с ОУГ.
----
Статья из книги: Глаукома. Нестеров А.П.


Комментариев 0