Энтоптические и электрофизиологические методы исследования | Современная офтальмология

Содержание:
Описание
В последние годы тяжелые повреждения органа зрения в разных странах мира стали одной из основных причин инвалидности по зрению и слепоты. В значительной части случаев эти повреждения приводят к выраженному нарушению прозрачности преломляющих сред глаза, делающему невозможным офтальмоскопическое исследование.Наряду с расширением возможности оказания помощи больным в настоящее время остро встает вопрос о выработке четких показаний к той или иной лечебной тактике. При этом на первый план выступает предоперационная оценка функционального состояния зрительного анализатора.
Обычно применяемые в клинике прогностические тесты, такие как определение светопроекции и цветоразличения, использование специального локализатора и ряд других, не являются надежными, могут создавать ошибочное представление о состоянии сетчатки и зрительного анализатора в целом.
В этих условиях большое значение придавалось поиску и клинической апробации других прогностических тестов, характеризующихся прежде всего большей информативностью. В клиническую практику были внедрены энтоптические методики прогноза, отличающиеся простотой, доступность отсутствием необходимости в наличии специальной аппаратуры, и электрофизиологические методы, большая часть которых характеризуется объективностью результатов.
В данном разделе мы остановимся на некоторых теоретических основах электрофизиологических и энтоптических методов исследования и опишем конкретные методики, применяемые в клинике глазных болезней ВМедА для оценки функционального состояния зрительного анализатора, в том числе и при повреждениях органа зрения.
↑ ЭНТОПТИКА
Под термином «энтоптические феномены» (ЭФ) (ento — внутри, opto— вижу) понимают субъективные зрительные ощущения, возникающие у исследуемого под влиянием раздражения зрительного анализа- юра различными как адекватными, так и неадекватными раздражителями: световыми, механическими, электрическими, рентгеновскими.
Являясь субъективными, ЭФ обусловлены в своем происхождении реакцией определенных объективных структур, что позволяет использовать некоторые из них для оценки функционального состояния зрительного анализатора.
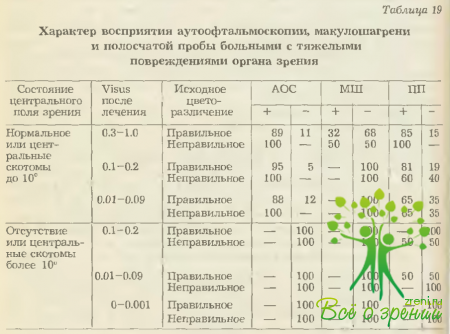
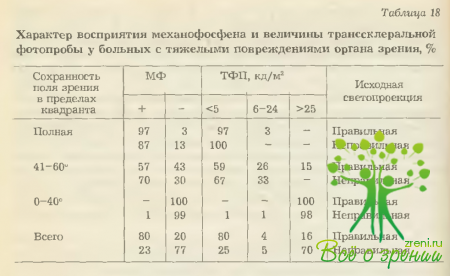
Комплекс используемых в нашей клинике энтоптических феноменов включает в себя исследование механофосфена (МФ), определение транссклерального фотопорога (ТФП), аутоофтальмоскопию (АОС), полосчатую световую пробу (ПП) и феномен макулошагрени (МШ).
↑ Фосфен давления, или механофосфен
Энтоптическое явление в виде бесцветного свечения, возникающего в ответ на механическо раздражение глаза (нажим, толчок, удар и пр.), получило название «фосфена давления», или «механофосфена» (МФ). Исследование проводится в затемненной комнате в условиях изоляции от осторонних световых и звуковых раздражителей после двукртной ингилляционной анестезии.
Кончиком стеклянной глазной палочки производится кратковременное надавливание на склеру глазного яблока не менее 12 мм от лимба поочередно во всех четырех квадрантах иеридиань (1-2, 4-5, 7—8, 10-11 часов). Взгляд исследуемого должен быть направлен в сторону, противоположную квадранту стимуляции. При надавливании на глазное яблоко фосфен имеет вид темного пятна и окружающего его светлого кольца или ободка.
Результат считается положительным, если фосфен не только улавливается, но и правильно локализуется (в квадранте, противоположном квадранту стимуляции); отрицательным— если фосфен не воспринимается. При невозможности трансконъюнктивальной стимуляции исследование механофосфена можно выполнить путем давления на глазное яблоко через веки.
Е. Stigler в центре темного пятна наблюдал более светлую зону, а также слабые фосфеновые кольца в области желтого пятна. Ю. П. Резников (1971) при небольших величинах давления описывает фосфен в виде светлого пятна, а появление темного центра со светлым ободком — при увеличении давления.
Положительный результат механофосфена свидетельствует о сохранности сетчатки в квадранте механической стимуляции. По данным Н. Н. Пивоварова, В. В. Сосновского, В. В. С сновского и соавт., Н. Kraning, J. Pelts (1960), S. F. Bowen (1963), D. Cornberg, V. Gorr, D. Cornberg, W. Ehrich и др., диагностическая ценность механофосфена значительно превосходит метод определения светопроекции.
Использование механофосфена для определения топографии m слоек сетчатки показало совпадение конфигурации отслоек с данным периметрического и офтальмоскопического контроля в 90—94 % случаев. Была показана высокая степень корреляции между данными периметрии и результатами исследования механофосфена при различной патологии органа зрения.
При отслойках сетчатой оболочки механофосфен в зонах отслоения не вызывается. В случае прилегания сетчатки после операции механофосфен, как правило, снова регистрируется. Его же отсутствие с достаточной долей вероятности свидетельствует о функциональной несостоятельности сетчатки в зоне исследования.
При глаукоме результат исследования механофосфена зависит w стадии заболевания. Отсутствие механофосфена при раздражении через склеру на максимальном удалении от лимба свидетельствует о сужении! поля зрения, как минимум, до 35—40° от точки фиксации.
При периферической пигментной абиотрофии механофосфен, как правило, отсутствует.
При миопической болезни наблюдается «сдвиг» границы возникновения механофосфена в глубину от лимба, увеличение порогов его возникновения. При выраженных дегенеративных изменениях на глазном дне механофосфен в участках дегенерации может не вызываться.
При поражении зрительного нерва и вышележащих отделов арт тельного анализатора механофосфен отсутствует в квадрантах, соответствующих выпавшему полю зрения.
↑ Транссклеральный фотопорог
О применении транссклерального просвечивания для оценки состояли зрительного анализатора сообщали в своих работах О. Veraguth (1906), J. Dimmer (1921), Н. Koellner (1921), J. Birnbacher (1922), D. Cornberg,. Ehrich и др. Наиболее детально возможности этого феномена были учены в работах Н. Н. Пивоварова, который назвал его «феном просвечивания»; В. В. Сосновского, предложившего приминение «транссклеральный фотопорог» как более соответствующий его физиологической сущности.
Для проведения этого исследования можно использовать электроофтальмоскоп с диафаноскопической насадкой, имеющий вмонтированный в рукоятку реостат (модель ЭО-61) или склеральную лампу иных моделей с регистрацией величины тока, подаваемого на осветитель. Условия определения транссклерального фотопорога аналогичны таковым при исследовании механофосфен.
Наконечник диафаноскопа приставляется к склере предварительно анестезированного глаза на удалении 12—14 мм от лимба меридианах 1-2, 4—5, 7-8, 10—11 часов. Передвигая ручку реостата и ем самым увеличивая яркость света, фиксируется сила тока, при которой исследуемый замечает появление светлорозового пятна в квадранте, тротивоположному квадранту стимуляции. Как и при исследовании меха- и фосфна, проверку ТФП начинают со здорового (лучшего) глаза.
↑ Аутоофтальмоскопия
Впервые энтоптический феномен видения собственных ретинальных сосудов описал в 1813 г. Stembuch Много времени его изучением занимался Пкинье именем которого он часто и называется. Из всех методов его исследования наибольшее распространение получил следующий: наконечном склеральной лампы транссклерально (после анестезии) или транспальпебрально выполняются ритмические качательные движения.
Наличие четкой картины «сосудистого дерева», по единодушному мне- u многих авторов, свидетельствует о функциональный данности центральных отделов сетчатки. Размеры исследуемого поля зависят от места приложения источника света к склере. В случае симального отстоения от лимба в позиции приведения глазного яблока становится доступным для исследования височное поле зрения до 45' от точки фиксации, при этом происходит расширение и назальной части поля зрения до 20°.
Проводя исследование феномена подобным образом во всех участках глазного яблока, можно оценить функциональную сохранность центральных отделов сетчатки вплоть до внутренних границ поля зрения, определяемых с помощью механофосфена и транссклерального фотопорога, т. е. 35-40° от точки фиксации.
О возможности использования аутоофтальмоскопии для оценки функционального состояния центральных отделов сетчатки при помутнении преломляющих сред переднего отдела глаза сообщали различные авторы. По их данным, при наличии дефектов в поле зрения в виде центральных и парацентральных скотом энтоптически в соответствующих участках поля зрения также определяются выпадения в картине «сосудистого дерева». При распространении патологии на центральные участки в аутоофтальмоскопической картине определяются выпадения вплоть до полного отсутствия аутоофтальмоскопии.
↑ Феномен макулошагрени
Впервые энтоптический феномен, получивший название «макулошагрени» (МШ) был описан Мюллером в 1842 г. Он наблюдается при тех же условиях, что и вышеописанный феномен при АОС. Одновременно с появлением фигуры «сосудистого дерева» в точке фиксации исследуемым определяется бессосудистая зона, в центре которой на более темном фоне видны мелкие светлые двигающиеся точки.
Отдаленное внешнее сходство с рисунком шагрени дало основание Гельмгольцу дать такое название феномену. Если механизм возникновения феномена остается до сих пор неясным, то его макулярная локализация в настоящее время не вызывает сомнений Сообщения об использовании этого феномена в клинической практике сделали S. Bowen (1963), D. Cornberg, W. Ehrich, С. W. Tyler (1978), В. В. Сосновский. Они отмечают незначительную наглядность феномена.
[banner_centerrs] {banner_centerrs} [/banner_centerrs]
Даже в контрольной группе (здоровые глаза) его положительный результат регистрировался в 36—60 % наблюдений.
Видение макулошагрени свидетельствует о возможности получения М после лечения высокого центрального зрения — 0.5 и более. Исключением из этого является амблиопия.
↑ Световая полосчатая проба
J. Primrose опубликовал сообщение о новом методе оценки функционального состояния центральных отделов глазного дна у больных с катарантами. Цилиндр Мэддокса, приставленный к глазу исследуемого, освещяется светом от ручного офтальмоскопа.
При нормальном состоянэд Ж сетчатки пациент видит световую полосу, направленную перпендикулярно призм цилиндра Мэддокса. Изменяя положение цилиндра, исследуемого просят каждый раз указывать направление световой полосы.
Правильная ориентация световой полосы свидетельствует о функциональной сохранности центральных отделов сетчатки и возможности получения достаточно высокого зрения.
Диагностическая ценность энтоптических феноменов при повреждениях органа зрения была детально изучена нами на достаточно большом клиническом материале.
При этом в качестве критериев состояния периферических отделов сетчатки (и, соответственно, периферического поля зрения) рассматривались результаты исследования механофосфена и транссклерального фотопорога (соотносимые с данными светопроекции), а центрального отдела сетчатки (и в какой-то степени остроты зрения) — данные аутоофтальмоскопии, полосчатой пробы и феномена макулошагрени (соотносимые с характером цветоразличения). Полученные результаты приведены в табл. 18, 19.
Для оценки функционального состояния периферических отделов сетчатки по данным исследования механофосфена и транссклерального фотопорога выделяются следующие группы прогноза:
- значительное сужение поля зрения в пределах исследуемого квадранта (сохранность 40—0°) — отрицательный результат механофосфена и повышение транссклерального фотопорога более чем в 5 раз вплоть до его отсутствия;
- незначительное сужение поля зрения в пределах исследуемого квадранта (сохранность 50-41°) — повышение транссклерального фотопорога до 5 нормальных порогов даже при положительном результате механофосфена;
- практически нормальное поле зрения — положительный результат механофосфена при нормальном транссклеральном фотопороге.
Для оценки функционального состояния центральных отделов сетчатки по данным исследования аутоофтальмоскопии, феномена макулошагрени и полосчатой пробы целесообразно выделить следующие группы прогноза:
- сохранность зрение не менее 25 от точки фиксации, возможность получения остроты зрения не менее 0-6 — положительные результаты всех указанных исследований;
- сохранность центрального поля зрения не менее 25° от точки фиксации, возможность получения остроты зрения не менее 0.1-0.2;
- при наличии центральных скотом их размер не превышает 5° — положительные результаты аутоофтальмоскопии и полосчатой пробы;
- сохранность центрального поля зрения менее 25° от точки фиксации либо наличие центральных скотом 10 и более— отрицательный результат аутоофтальмоскопии и полосчатой пробы; возможная острота зрения — не более 0.03.
↑ ЭЛЕКТРОФИЗИОЛОГИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
В последние десятилетия в клинической офтальмологии все более широкое признание стали находить электрофизиологические методы исследования (ЭФИ), такие как электроретинография, электроокулография, регистрация вызванных потенциалов зрительной коры, исследование электрической чувствительности, функциональной подвижности зрительного анализатора и ряд других.
Многочисленные исследования показывают, что применение этих методов в клинике способствует более качественной диагностике, позволяет определить уровень поражения и оценить динамику патологического процесса и эффективность лечения.
Все методы ЭФИ можно разделить на два класса: объективные и субъективные. Принципиальное различие между ними состоит в том, что в первом случае регистрируются электрические потенциалы, возникающие как суммарный результат перемещения ионных токов в различных отделах органа зрения, а во втором — электрический ток служит неспецифическим раздражителем, вызывающим те или иные зрительные ощущения у пациента.
Прежде чем перейти к описанию отдельных электрофизиологических методов, необходимо отметить, что вследствие очень незначительных величин потенциалов, регистрируемых объективными ЭФИ, и их большой зависимости от многочисленных факторов, в каждой лаборатории ЭФИ и для каждой системы аппаратуры должна быть определена своя норма, которая обязательно указывается вместе с результатами конкретного исследования.
↑ ЭЛЕКТРОРЕТИНОГРАФИЯ И ЕЕ ДИАГНОСТИЧЕСКИЕ ВОЗМОЖНОСТИ
Под электроретинографией (ЭРГ) понимают метод регистрации многофазной биоэлектрической реакции клеточных элементов сетчатки возникающей под действием светового раздражителя.
Внедрение ЭРГ в клиническую практику стало возможным лишь после того, как для ее регистрации стали применяться электронные усилители (Cooper S. et al., 1933), а также электроды, вмонтированные в контактные линзы. В нашей стране первые работы по записи ЭРГ у человека были выполнены П. О. Шпильберг. Ею был разработан специальный тип фитильковых электродов, вскрыт ряд технических закономерностей, не потерявших значение до настоящего времени.
Дальнейшая разработка и внедрение в клинику ЭРГ в отечественной офтальмологии во многом связано с деятельностью лаборатории физиологической оптики (ныне — Лаборатория клинической физиологии зрения им. С. В. Кравкова НИИ глазных болезней им. Гельмгольца).
В настоящее время в клинической офтальмологии наибольшее применение находят общая (ганц-фельд), локальная (макулярная, зональная), ритмическая и паттерн-электроретинограммы, которые позволяют оценить функциональное состояние различных отделов сетчатки.
↑ ОБЩАЯ (ГАНЦ-ФЕЛЬД) РЕТИНОГРАММА
Общая ретинограмма представляет собой суммарный биоэлектрический потенциал, регистрируемый в ответ на засвет всей площади сетчатки (ганц-фельд — все поле). Он регистрируется между активным электродом на роговице и референтным электродом, чаще всего накладываемым на мочку уха.
Обязательным является использование третьего, заземляющего электрода. В качестве активного электрода могут быть использованы контактные линзы, роговичные электроды-крючки (электрод Ардена), тонкие нити из специального сплава, закладываемые за нижнее веко (цит. по Шамшиновой А. М). В нашей клинике в последнее время применяется электрод-присоска в виде пустотелой полусферы с матовым передним стеклом (модель Говардовского В. И., Шамшиновой А. М., Голубцова К. В.), обеспечивающий равномерный засвет всей площади сетчатки (рис. 61).
Для достижения ганц-фельд-эффекта допустимо использовать стимуляторы в виде полусферы с матовым покрытием (по типу адаптометра АДМ1 с подключенным источником света.
В качестве стимулятора чаще всего применяется импульсная лампа-вспышка, генерирующая импульс белого света длительностью не более 5 мс и интервалом интенсивностей на поверхности роговицы 1,5—3,0 кд/м2.
Учитывая малые амплитудные значения регистрируемых параметров, для получения достоверных результатов необходимо использовать усилители биопотенциалов.
Для записи сигнала могут применяться как чернильнопишущие регистрирующие устройства (типа энцефалографа), так и осциллографы. В первом случае анализ полученных результатов более трудоемок и осуществляется исследователем. Современные достижения компьютерных технологий позволяют совместить и значительно упростить регистрацию и анализ получаемых данных.
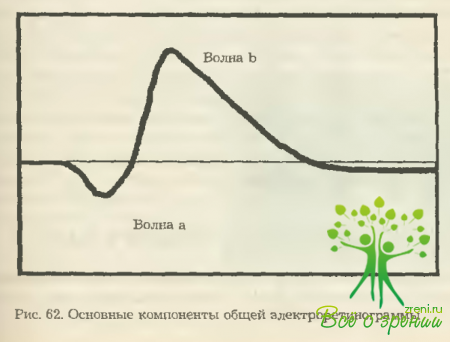
В общей электроретинограмме здорового человека можно выделить следующие компоненты: негативную (ниже изолинии) «а»-волну, позитивные «b»-, «с»- и «d»-волны. Причем последние две регистрируются далеко не всегда, лишь при определенных условиях стимуляции и регистрации. Каждую из волн характеризуют два параметра: амплитуда волны (в микровольтах) и латентность, т. е. время от момента стимуляции до пика волны (в миллисекундах) (рис. 62).
Не останавливаясь детально на природе электрогенеза указанных ямпонентов общей ЭРГ, необходимо дать основы их интерпретации.
Волна «а» представляет собой потенциал, отражающий активность фоторецепторного слоя сетчатки. Амплитуда ее существенно меньше, чем редуюшей позитивной волны «b», которая характеризует электрическую активность нейронов второго клеточного уровня сетчатки (биполяров с зозможным вкладом горизонтальных и амакриновых клеток) и мюллеровыких глиоцитов.
Это наиболее стабильный и клинически значимый параметр общей ЭРГ. Параметры ее изменяются при различных условиях регистрации: при умеренной световой адаптации амплитуда ее уменьшается, а латентность укорачивается; после 4—6 минут нахождения пациента в темноте амплитуда увеличивается, время ее кульминации несколько замедляется; после 12 минут темновой адаптации волна «b» достигает своей максимальной величины.
Увеличение интенсивности стимулирующего света приводит к увеличению амплитуды волны «b», но лишь до некоторого «насыщенного» уровня, после которого усиление стимула уже практически не сказывается на характеристиках ЭРГ. В специальных условиях регистрации в ЭРГ определяется медленная позитивная волна «с».
Считается, что своим происхождением она обязана пигментному эпителию. Однако из-за значительной вариабельности ее параметров, непостоянства регистрации и неопределенности трактовки она не нашла применения в клинической офтальмологии. Регистрируемая в момент выключения длительного и интенсивного стимула положительная волна «с» представляет собой так называемый ответ клеточных элементов сетчатки. Использование ее в клинике представляется очень перспективным, но требует на данный момент дополнительного обоснования.
Наиболее распространенной в современной клинической практике остается классификация ЭРГ, предложенная еще в 1945 г. О. Кагре и дополненная Непке Б в 1953 г. По этой классификации за основу берутся амплитудные значения основных волн ЭРГ «а» и «b». При этом различают нормальную, супернормальную, плюс- и минус-негативную, угасшую или отсутствующую ЭРГ. Супернормальная ЭРГ характеризуется увеличением амплитудных параметров волн «а» и «b», что является, видимо, следствием раздражения фоторецепторов сетчатки при различных патологических состояниях.
Субнормальная ЭРГ характеризуется снижением амплитуд «а» - и «b»-волн. Это наиболее частый вид патологической ЭРГ. Негативную ЭРГ характеризует увеличение или сохранность амплитуды волны «а» и небольшое (до изолинии плюс-негативная) или значительное снижение (ниже изолинии минус-негативная) амплитуды волны «b». Угасшая или отсутствующая ЭРГ (нерегистрируемая) является электрофизиологическим симптомом тяжелых, часто необратимых изменений в сетчатке.
↑ МАКУЛЯРНАЯ РЕТИНОГРАММА
Макулярная ретинограмма представляет собой биоэлектрический потенциал, регистрируемый при стимуляции макулярной зоны сетчатки.
Единой общепринятой методики для регистрации макулярной ЭРГ в настоящее время еще нет. В то же время необходимость объективной оценки состояния сетчатки этой зоны очевидна в связи с возможностью изолированного поражения макулы, что сопровождается значительными функциональными потерями. Между тем, подобные процессы не влияют на величину общей ЭРГ вследствие того, что колбочки макулярной зоны составляют лишь 7 % от общего числа всех фоторецепторов сетчатки и потеря их вклада в генерацию общей ЭРГ не приведет к достоверному уменьшению последней.
В нашей стране большую известность получил метод регистрации макулярной ЭРГ, разработанный в Лаборатории клинической физиологии зрения им. С. В. Кравкова НИИ глазных болезней им. Гельмгольца.
Выделение локального макулярного биопотенциала связано с рядом трудностей, основными из которых являются:
- выделение малого по величине потенциала из шума;
- нивелирование эффекта светорассеяния, всегда возникающего пристимуляции любой области сетчатки;
- контроль за фиксацией взора.
Авторы метода детально обосновали пути оптимального преодоления указанных трудностей. Для регистрации локального макулярного ими был разработан электрод-присоска (рис. 63) с вмонтированными источником света (двухцветный светодиод) и оптической системой. которая вместе с оптической системой глаза создает неподвижное изображение источника света на центральной области сетчатки.
Фиксация линзы обеспечивается компрессорной системой путем создания слабого воздушного разрежения в пространстве между электродом и роговицей.
Так как при всех движениях глаза присоска перемещается вместе с ним, изображение источника света всегда попадает на одно то же место сетчатки. Этим обесчивается многократная воспроводимость стимуляции заданной части без необходимости контря фиксации взора Указанные конструктивные особенности электрода обеспечивают стимуляцию области сетчатки в уделах 15' от центра. именно такой площади позволяет получить достоверный, к интерпретации рена с максимумом 520 нм.
Тем самым сравнительный анализ результатов макулярной ЭРГ на красный и зеленый стимулы дает возможность раздельно оценить функцию колбочковой и палочковой систем в стимулируемой области. Таким образом, методика регистрации макулярной ретинограммы принципиально отличается от общей ЭРГ не только площадью стимулируемой зоны, но и прежде всего иным качественным составом клеточных элементов-генераторов ЭРГ.
Вместе с тем природа волн макулярной ЭРГ и интерпретация результатов аналогичны описанному при анализе общей ЭРГ. Отличие состоит только в величине регистрируемого потенциала.
↑ РИТМИЧЕСКАЯ РЕТИНОГРАММА
Ритмическая (мелькающая) ЭРГ (РЭРГ) представляет собой графическое отображение биоэлектрических процессов в сетчатке, протекающих при ее стимуляции светом, мелькающим с разной частотой.
Ранние исследования реакций сетчатки на ее стимуляцию мелькающим светом сводились к анализу воспроизведения световых мельканий в ЭРГ и оценке критической частоты их слияния. Появление метода усреднения биопотенциалов и системы ганц-фельд-стимуляции позволит перейти к количественному анализу ритмической ЭРГ.
Различия в лабильности разных типов фоторецепторов стало физиологической основой для выделения с помощью ритмической ЭРГ функций фотопической и скотопической систем сетчатки человека. Предельная частота мельканий, воспроизводимая палочковыми и колбочковыми элементами сетчатки человека, колеблется, по данным разных авторов, в пределах 10-25 и 50-100 Гц соответственно.
Этим обусловлено принципиальное деление ритмической ЭРГ на два диапазона: низкочастотную (частота стимуляции 4-14 Гц) и высокочастотную (частота стимуляции 30 Гц и более). При соблюдении определенных условий регистрации (темновая или световая адаптация, интенсивность и цвет стимула) возможно получение чисто колбочкового или чисто палочкового ответа сетчатки.
Кроме того, известно, что мюллеровские клетки сетчатки не способны воспроизводить световой ритм свыше 2-4 Гц. Следовательно, ритмическая ЭРГ представляет собой чисто нейрональный ответ сетчатки, не опосредованный вкладом в электрогенез клеток Мюллера.
Таким образом, стимуляция ритмическим светом низкочастотного диапазона позволяет получить объективную характеристику функциональней активности только нейрональных элементов наружных слоев сетчатки. Различие амплитудных параметров «b»-волны общей ЭРГ и жзкочастотной РЭРГ (5-15 Гц), по данным различных авторов, является новым диагностическим тестом в клинической электроретинографии, позволяющим на основании сопоставления степени изменений этих биопотенциалов опосредованно судить о преимущественном вовлечении в патологический процесс нейронов или глиальных клеток Мюллера.
Частоту стимуляции больше 30 Гц способны воспроизводить только колбочковые элементы сетчатки, так же, как и в случае низкочастотной РЭРГ, без опосредования буферными свойствами мюллеровских глиоцитов. Для высоких яркостей вспышек при частоте стимуляции 30 Гц и выше было показано, что регистрируемая РЭРГ имеет главным образом фоторецепторную природу с минимальным вкладом активности проксимальной сетчатки.
Для регистрации РЭРГ в нашей клинике используется ганц-фельд электрод-линза (см. рис. 61). Остальные компоненты аппаратной части, за исключением параметров стимуляции, аналогичны описанным в методике регистрации общей ЭРГ.
Ритмическая ретинограмма регистрируется в двух вариантах. В соответствии с международным стандартом, для регистрации ритмического ответа сетчатки используется частота 30 Гц. Кроме этого большой информативностью обладает и низкочастотная ритмическая ЭРГ, регистрируемая при частоте 10 Гц .
При регистрации ритмической ЭРГ также необходимо использовать метод усреднения, при этом, в соответствии со стандартом КСЕУ, первые три отведения не учитываются.
Форма высокочастотной РЭРГ 30 Гц монофазна (рис. 65).

Ее амплитуда рассчитывается по наиболее типичной (или средней) волне от ее отрицательного до положительного пика. Кроме амплитудного параметра, в РЭРГ 30 Гц оценивается временной показатель: межпиковый временной интервал (время от момента кульминации предшествующей волны до момента кульминации последующей волны), характеризующий способность воспроизведения ритма колбочковыми элементами сетчатки.
Низкочастотная РЭРГ 10 Гц полифазна и состоит из целого комплекса чередующихся волн (рис. 66).
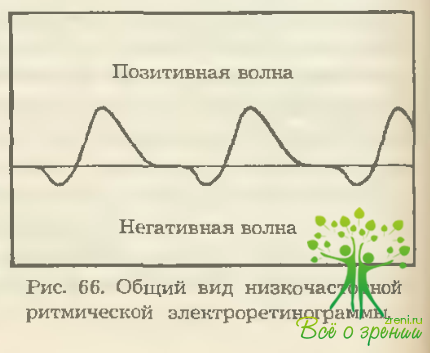
Приоритетные исследования отечественных ученых последних лет показали возможность дифференциальной оценки колбочковой и алочковой, оп- и off-активности клеточных элементов сетчатки по результатам оценки субкомпонентов низкочастотной РЭРГ.
Однако, поскольку низкочастотная ЭРГ и ее субкомпонентный анализ пока еще не приняты стандартами, при обработке результатов РЭРГ 10 Гц мы рекомендуем оценивать параметры, описанные в литературе ранее:
- амплитуду главного компонента ритмической ЭРГ, которая расчитывалась от пика отрицательного отклонения до пика соответствующей позитивной волны (в микровольтах);
- межпиковый временной интервал Р-Р, отражающий способность авспроизведения ритма нейрональными элементами сетчатки— время от момента кульминации предшествующей позитивной волны до момента кульминации последующей позитивной волны (в миллисекундах)
↑ ДРУГИЕ ЭЛЕКТРОФИЗИОЛОГИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ СЕТЧАТКИ
↑ Паттерн ЭРГ
Еще одной формой электроретинограммы является паттерн-ЭРГ, е. графическое выражение ретинального биопотенциала, вызываемого паттерн-стимулом в виде шахматного поля, имеющего различной величины квадраты разного контраста.
Предложенная А. Riggs паттерн-ЭРГ пила применение в диагностике заболеваний, включающих третий нейрон сетчатки.
Паттерн-стимул по своему строению отличается от вспышки света, исследуемой для регистрации общей ЭРГ, структурированностью, т. е. наличие внутренней закономерности распределения энергии и контраста, что является наиболее адекватным раздражителем для ганглиозных клеток сетчатки.
Паттерн-ЭРГ чаще всего регистрируется при реверсивных изменениях шахматных паттернов, т. е. когда черные и белые клетки меняются местами определенной частотой.
Паттерн ЭРГ имеет очень маленький сигнал, зависящий от характера стмула.
Паттерн-ЭРГ состоит из первоначальной корнео-позитивной (отклоняющейся выше изолинии) волны Р1 или Р-50 (цифра 50 отражает фею в миллисекундах от начала реверсии паттерна до времени пика ответа) и следующей корнео-негативной волны N1 или N-95. Максимальная амплитуда паттерн-ЭРГ регистрируется при хорошем фокусе изображения на сетчатке, а также при паттерне размером около 30 '.
Мы не располагаем данными (ни собственных наблюдений, ни в доступной литературе) о диагностической информативности паттерн-ЭРГ при повреждениях органа зрения.
↑ Электроокулография
Глазное яблоко в норме представляет собой диполь, характеризующийся положительным зарядом (+) переднего отрезка по отношению к заднему, имеющему отрицательный заряд (—). Существующая между ними разность потенциалов получила название постоянного потенциала (ПП) глаза. Абсолютная величина этого потенциала у разных людей в норме чрезвычайно вариабельна, что не позволяет использовать ПП в качестве диагностического критерия.
Однако эта величина существенно меняется при различных условиях адаптации: ПП возрастает на свету и уменьшается в темноте. На характер этих изменений влияет ряд факторов: состояние фоторецепторов и пигментного эпителия, нормальный контакт между ними, адекватное хориоидальное кровоснабжение.
Под электроокулографией (ЭОГ) понимают метод регистрации изменений постоянного потенциала глаза в различных условиях адаптации. G. В. Arden и соавт. для оценки функционального состояния сетчатки предложили использовать соотношение максимальной амплитуды ПП на свету к минимальной его амплитуде в темноте (так называемый коэффициент Ардена). Величина его в норме составляет 1,85 (185 %).
Многочисленными исследованиями была показана достаточно высокая диагностическая ценность электроокулографии при различной патологии органа зрения. В отношении повреждений органа зрения электроокулография может иметь определенную информативность, однако наш опыт показывает, что, с учетом большой трудоемкости и продолжительности исследования, она как диагностический метод уступает электроретинографии.
↑ Определение электрической чувствительности и лабильности зрительного анализатора.
Впервые появление в глазу светового ощущения, возникающего в ответ на раздражение глаза электрическим током, было обнаружено А. Вольтой в 1795 г.
Электрический фосфен, вызываемый пороговым током, не имеет цветности, локализуется под электродом на периферии поля зрения, хотя, при определенных условиях, может быть получен и в центральных отделах, а также занимать большую часть поля зрения.
Одним из важных вопросов, на которые пытались дать ответ ученые, был вопрос о месте возникновения первого импульса возбуждения, дающего пороговый фосфен: на какие структурные элементы зрительного анализатора действует пороговый ток.
В настоящее время общепризнано, что местом возникновения электрофосфе а являются нервные элементы сетчатки.
Зависимость электрической чувствительности (ЭЧ) от сохранности поля зрения и значительно меньшая ее зависимость от функции макулярной зоны были показаны в работах С. В. Кравкова, А. В. Лебединского и соавт. Исходя из этого, следует полагать, что электрическая чувствительность, определяемая по пороговому электрическому току, вызывающему электрофосфен, характеризует состояние нервных элементов биполярных и ганглиозных клеток), связанных по преимуществу с палочковым аппаратом сетчатки.
Иными словами, первый импульс возбуждения при электростимуляции глаза пороговым током возникает во внутренних слоях сетчатки, не вовлекая фоторецепторы.
Получить электрофосфен можно не только в ответ на раздражение одиночными стимулами, но и серией раздражений (ритмическая стимуляция). При этом при увеличении частоты стимуляции соответственно (Увеличивается частота мельканий фосфена.
Достигнув определенного (кригаческого) уровня, фосфен исчезает. Е. М. Семеновская и А. И. Верхутика предложили использовать метод определения критической частоты исчезновения мелькающего фосфена при раздражении глаза током для оценки лабильности, функциональной подвижности зрительного анализатора. Было установлено, что при увеличении стимуляции до 20—30 Гц бесцветный электрофосфен перестает мелькать на периферии поля зрения и перемещается в его центральный отдел Дальнейшее увеличение частоты раздражения (40—60 Гц) приводит не к появлению мельканий, как это наблюдается при световой стимуляции, а к исчезновению фосфена.
В настоящее время в клинической электрофизиологии электрическую чувствительность рассматривают как показатель функционального состояния внутренних слоев сетчатки связанных с палочковым аппаратом, т. е. периферии; ответ при ритмической стимуляции (лабильность) характеризуют функциональное состояние тех же структур, но связанных с центральными отделами сетчатки.
Для вызывания электрофосфена могут применяться различные электростимуляторы. В одних моделях (ЭСУ-2) регистрируемым параметром электрического тока является величина напряжения, при котором фиксируется фосфен; в других (наиболее часто применяемых) — сила тока Активный электрод фиксируется или приставляется к наружному углу исследуемого глаза, индифферентный электрод может либо фиксироваться на мочке уха, либо контактировать с кистью исследуемого, будучи вмонтированным в ручку прибора.
При различных патологических состояниях, затрагивающих третий нейрон зрительного анализатора, наблюдаются повышение порогов возникновения электрофосфена (т. е. снижение электрической чувствительности) и снижение частоты исчезновения фосфена (т. е. угнетение лабильности). Определение электрической чувствительности и критической частоты исчезновения фосфена (КЧИФ) позволяет в значительной части случаев проводить диагностику поражения зрительно-нервного аппарата по глубине и в некоторой степени по его площади.
↑ Регистрация зрительных вызванных потенциалов коры
Описанные выше методы электроретинографии характеризуют состояние только наружных слоев сетчатки. Между тем, необходимость объективной оценки функциональной сохранности вышележащих отделов проводящих путей зрительного анализатора очевидна.
Зрительные вызванные потенциалы (ЗВП) представляют собой сложную электрическую реакцию клеток коры головного мозга в ответ не предъявление зрительного стимула. При сохранности функция активности сетчатки, определяемой ретинографически, и отсутствии органической патологии головного мозга параметры ЗВП позволяй объективно охарактеризовать состояние зрительно-нервных путей.
Современный уровень теоретических и практических знаний о природе вызванных потенциалов позволяет при соответствующей технических оснащенности реализовать регистрацию ЗВП в разных модификацией В зависимости от временной частоты стимула различают транзиторны физические вызванные потенциалы.
Первые регистрируются при частоте стимуляции (до 4 Гц), когда в период между стимулами успевают сформироваться основные компоненты биоэлектрического. Вторые, регистрируемые при высокочастотной стимуляции, определяют собой кривую псевдосинусоидальной формы вследствие наложен» компонентов ответа на разные стимулы. Физические ЗВП отличаюся стабильностью, меньшей вариабельностью, простотой и точностью определения амплитуды. Транзиторные ЗВП позволяют выявлять нарушена формы и более адекватны для оценки временных параметров вызванным потенциалов.
При использовании неструктурированных стимуле (вспышка света) регистрируются так называемые вспышечные ЗВ (вЗВП), недостатком которых является большая вариабельность формы амплитудно-временных параметров, но которые являются методом выбрации для оценки состояния проводящих путей при нарушениях прозрачности оптических сред, резком снижении зрительных функций.
Методика исследования ЗВП не стандартизирована, вследствие чег отсутствую единые норм тивы и возможность сравнения результата полученных з разных клиниках. Поэтому клинический протокол исследования должен включать нормативные показатели данной электрофизис логической лаборатории.
Отведение потенциала от области проекции зрительной коры осуществляется как правило, с помощью злектроэнцефалографического электрода, помещаемого на затылочной области по средней линии на 2 выше затылочного бугра. Вследствие малой амплитуды ЗВП необходимо использование усилителей биопотенциалов и метода усреднении (около 40-100 отведений). В качестве регистрирующего и анализирующего устройства наиболее целесообразным является применение ЭВМ.
Транзиторные ЗВП представляют собой последовательность волн раз яичной полярности. Условно их принято обозначать РЗ, N1, Р2, N2, РЗ (Р — положительный пик, N — отрицательный пик). Наиболее часто определяемыми параметрами ЗВП являются временные характеристики— латентность пиков, т. е. время от момента стимуляции до развития максимум отклонения кривой.
Менее значимыми в силу большой вариабельности являются амплитудные параметры вызванных потенциалов. Интерпретации амплитуд основных компонентов рекомендуется проводить только при межокулярном сравнении показателей от правого и левого глаз пациента.
Основными проявлениями патологических процессов проводящих путей в ЗВП считаются замедление времени кульминации волн (увеличени пиковой латентности), нарушения их формы, межокулярная асимметрия амплитудных показателей, отсутствие отдельных волн или ЗВП в целом Увеличение пиковой латентности говорит об уменьшении скорости проведения по аксонам ганглиозных клеток, что характерно для воспалительных и демиелинизируклцих состояний.
Снижение амплитудных параметров более свойственно законченным процессам, когда имеется деструкция или атрофия нейрональных волокон. Отсутствие ЗВП, как правило, свидетельствует о тяжелом, необратимом поражении всей толщи зрительного нерва
↑ ПРИМЕНЕНИЕ ЭЛЕКТРОФИЗИОЛОГИЧЕСКИХ МЕТОДОВ ИССЛЕДОВАНИЯ ПРИ ПОВРЕЖДЕНИИ ОРГАНА ЗРЕНИЯ
Повреждения органа зрения отличаются полиморфизмом изменений всех структур глаза, значительной тяжестью, часто комбинированностью и сочетанностью поражений. Исходя из этого, оценка состояния нейрорецепторного аппарата особенно важна.
По Р. А. Гундоровой и соавт., можно выделить ряд патологических п сттравматических состояний органа зрения при которых данные электрофизиологических методов исследования имеют большую диагностическую ценность:
- нарушение прозрачности оптических сред глазного яблока: изменения роговицы в результате формирования грубых бельм, ифема, травматическая катаракта, гемофтальм, деструкция и фиброз стекловидного тела;
- посттравматические отслойки сетчатки;
- контузии глазного яблока;
- металлоз;
- симпатическая офтальмия;
- повреждения зрительного нерва.
Нарушения прозрачности преломляющих сред глаза ограничивают, а нередко и делают невозможным офтальмоскопическое исследование. В то же время эти изменения практически не сказываются на параметрах электрофизиологических исследований при отсутствии сопутствующего поражения нейрональных элементов сетчатки и зрительного нерва.
В этой ситуации результаты таких электрофизиологических исследований (в сочетании с данными энтоптики) становятся методами выбора для оценки прогноза и выработки тактики лечения. В частности, сохранность основных параметров общей и ритмических ЭРГ и ЗВП в сочетании с нормальными величинами электрической чувствительности и КЧИФ с большой степенью вероятности позволяет предполагать достаточно высокую активность зрительных функций в случае устранения нарушений преломляющих сред глаза.
На современном уровне записи биопотенциалов РЭРГ используется для оценки состояния сетчатки не только при катарактах, при любых иных помутнениях оптических сред глаза уже на основе количественного анализа сигнала. Снижение амплитудных параметр общей и низко частотной ритмической ЭРГ делает менее благоприятным прогноз в отношении сохранности функций периферических отделов санчатки. Угнетение биоэлектрического ответа сетчатки на высокочастотную стимуляцию не позволяет ожидать высоких показателей центрального зрения.
При субтотальном и тотальном гемофтальмах оценка сохранности сетчатки-затрудняется искажением спектрального состава стимулирующих вспышек. В связи с этим для повышения информативности электроретинографии предложены оригинальные методы регистрации хроматической ЭРГ.
Повышение порогов ЭЧ и тем более снижение лабильности свидетельствуют о тяжелом поражении зрительно-нервного аппарата и делают функциональный прогноз малоблагоприятным.
Посттравматическая отслойка сетчатки является одним из наиболее тяжелых осложнений повреждения органа зрения. При этой патологии наиболее информативен комплекс электрофизиологических исследований, включающий регистрацию общей, ритмической ЭРГ и определение ЭЧ.
Характер изменения ЭРГ зависит прежде всего от площади отслоения Отслойка сетчатки сопровождается большим снижением амплитуды волны «b» по сравнению с волной «а». При тотальных отслойках сетчатки обща: ЭРГ, как правило, не регистрируется, в то время как во многих случаях удается получить ее ответ на ритмическую стимуляцию.
Отсутствие общей ЭРГ не относится к абсолютным отрицательным прогностическим признакам, так как в случае положительного анатомического результата от оперативного вмешательства нередко имеет место и функциональный эффект. Степень снижения ЭЧ при отслойках сетчатки зависит от площади отслоения и давности процесса. Лабильность же, как правило, страдает мало. При значительном повышении порогов ЭЧ функциональный прогноз противоотслоечной операции пессимистичен.
Характер изменения параметров ЭФИ при контузиях органа зрения отличается большой вариабельностью. Степень этих изменений зависит от тяжести повреждения. Динамическое злектрофизиологическое наблюдение позволяет контролировать правильность проводимого лечения. При этом находят применение все виды ретинографии (общая, макулярная, ритмические, паттерн), регистрация ЗВП, определение ЭЧ и КЧИФ.
Современная травма органа зрения (особенно боевая) характеризуется увеличением количества ранений с наличием внутриглазных инородных тел, в том числе металлической природы. Хорошо известно, что даже при отсутствии серьезных анатомических и функциональных нарушений само по себе наличие металла в глазе чревато развитием грозного осложнения — металлоза.
Классические методы обследования органа зрения позволяют диагностировать это состояние, как правило, в поздних стадиях патологического процесса. В то же время, еще в ранних работах по электрофизиологии сетчатки была отмечена информативность ЭФИ при халькозе и сидерозе. Более детально диагностическая ценность электрофизиологических методов при металлозах была изучена в работах
Э. К. Лосевой, а также Э. К. Лосевой и соавт. Наиболее информативной при данной патологии является методика общей ретинографии. Динамика электроретинографических показателей характеризуется определенной последовательностью изменений. На ранних стадиях метал- лоза вследствие раздражения сетчатки солями металла регистрируется супернормальная общая ЭРГ. Параллельно повышается частота воспроизведения светового ритма в ретинограмме.
Дальнейшее прогрессирование металлоза приводит к угнетению электрической активности сетчатки, что проявляется постепенным переходом к субнормальной, а затем негативной ЭРГ. Характерно снижение меньше единицы индекса b/а (отношение амплитуды волны «b» к амплитуде волны «а») по данным общей ЭРГ при более умеренных изменениях амплитуды РЭРГ. В далеко зашедших стадиях металлоза регистрируется угасшая ЭРГ, показатели ЭЧ и КЧИФ отклоняются от нормы.
Важность ранней диагностики симпатической офтальмии определяется необходимостью энуклеации травмированного глаза из-за угрозы поражения контрлатерального (здорового) глаза при ее возникновении. Возможность развития симпатической офтальмии в любые (в том числе отдаленные) сроки после ранения обусловливает потребность в постоянном динамическом наблюдении.
Электрофизиологические исследования наиболее информативны в диагностике этого состояния, так как их показатели изменяются намного раньше проявления клинических симптомов заболевания. При этом методикой выбора, по мнению большинства авторов, служит общая ЭРГ, так как в первую очередь в патологический процесс вовлекаются периферические отделы сетчатки. На ранних стадиях симпатической офтальмии имеет место суперреакция сетчатки, проявляющаяся в увеличении амплитудных параметров ЭРГ.
По мере развития процесса происходит постепенное угнетение электрогенеза, что отражается в изменении общей ретинограммы через субнормальную и негативные формы до ее полного угасания. При этом до терминальных стадий воспалительного процесса показатели фотопической ЭРГ, макулярной ЭРГ, ЭЧ и КЧИФ остаются нормальными.
Изолированное повреждение зрительного нерва при травмах органа зрения встречается редко. При этом в диагностическом плане на первое место выходят изменения в параметрах ЭЧ, КЧИФ и ЗВП.
Электрическая чувствительность при данной патологии всегда понижается, находясь в прямой зависимости от тяжести процесса и его локализации. При этом поражение периферических волокон ведет к снижению ЭЧ при относительно нормальных показателях лабильности. Угнетение последней свидетельствует о распространении процесса на аксиальные волокна зрительного нерва.
При регистрации ЗВП в зависимое- та от степени повреждения может наблюдаться снижение амплитудных показателей вплоть до полного отсутствия потенциалов коры. Изменение скорости проведения импульса по зрительно-нервным путям, определяемое в виде замедления латентностей основных пиков, может определяться в результатах ЗВП при наличии в ткани травмированного зрительного нерва очагов реактивного воспаления.
Косвенным признаком поражения зрительного нерва является выявляемая при регистрации общей ЭРГ супернормальная биоэлектрическая реакция, обусловленная перерывом центробежных тормозящих волокон.
Описанные выше методы оценки функционального состояния органа зрения позволяют объективизировать и уточнить диагноз, прогнозировать вероятный исход, на основании данных динамического наблюдения ценивать адекватность и корригировать проводимое лечение. Мы не претендуем на полноту изложения проблемы в целом и конкретной методологии в частности. Каждое лечебное учреждение в зависимости от профиля решаемых задач и имеющегося оснащения, может применять в комплексе электрофизиологических исследований доступные методы.




Комментариев 0