Функции ретинального пигментного эпителия

Описание
Поглощение света. Меланин, содержащийся в меланосомах апикальной части клеток РПЭ, является биологическим поглотителем света, причем коротковолновая часть спектра поглощается в большей степени, чем длинноволновая. Это имеет большое значение для предотвращения повреждения светом наружных сегментов (НС) фоторецепторов и клеток РПЭ.Метаболизм. Тесный контакт между клетками РПЭ и НС фоторецепторов обеспечивает быстрый процесс регенерации зрительных пигментов после их распада под воздействием света. Именно в клетках РПЭ ретинол вследствие биохимических реакций превращается в 11-цисретинальдегид, который затем в НС фоторецепторов соединяется с опсином, заканчивая цикл восстановления зрительного пигмента.
Барьерная функция. Наружный гематоретинальный барьер образован тремя структурами: хориокапиллярами, мембраной Бруха и zonula oceludens клеток РПЭ. Через хориокапилляры могут проникать достаточно крупные молекулы (альбумин, IgG), тогда как zonula oceludens клеток РПЭ является надежным барьером для низкомолекулярных белков, например флюоресцеина. При ряде заболеваний: болезни Херада, интраваскулярной коагулопатии, метастазирующей карциноме и др. — наружный гематоретинальный барьер нарушается.
Регуляция и поддержание водного и ионного баланса в субретинальном пространстве. Клетки РПЭ имеют активные механизмы, обеспечивающие транспорт ВОДЫ, ионов и более крупных молекул между сетчаткой и хороидом, регулируют уровень рН в субретинальном пространстве. К таким механизмам относятся Na+/ K+, Na+/ K+/ Cl+котранспорт и Сl-бикарбонатная помпа. Более того, РПЭ обеспечивает процессы интеграции НС фоторецепторов. В промежутках (щелях) между интегрируемыми элементами содержится межклеточный матрикс, который состоит из различных молекул, в числе которых протеогликаны и другие высокомолекулярные соединения, окружающие наружные сегменты колбочек и палочек. Высокая вязкость межклеточного матрикса обеспечивает плотное прилегание НС-фоторецепторов к клеткам РПЭ. При воздействии энзимов, снижающих вязкость, и при скоплении жидкости в субретинальном пространстве может произойти отслойка сетчатки.
Фагоцитоз НС фоторецепторов. Клетки РПЭ обладают высокой фагоцитарной и аутофагальной активностью. Отторгнутые диски НС-фоторецепторов поглощаются инвагинированной мембраной клеток РПЭ, в результате чего образуются фагосомы. Под воздействием лизосомальпых энзимов происходит растепление протеинов. С возрастом фагоцитированный в клетках РПЭ материал расщепляется не полностью, что приводит к образованию липофусцина. Липофусцин (или «пигмент старости») представляет собой желтоватые, флюоресцирующие включения внутри клеток пигментного эпителия. Ранее считали, что липофусциновые гранулы являются безвредным балластом, однако в настоящее время установлено, что при действии света они способны генерировать активные формы кислорода — суперокисные анионрадикалы и синглетный кислород. Липофусцин частично может задерживаться и аккумулироваться в мембране Бруха.
[banner_centerrs] {banner_centerrs} [/banner_centerrs]
Антиоксидантная функция. В работах Последних лет указывается на важную роль меланина в антиоксидантной функции ПЭ. Исследователи считают, что нарушение данной функции РПЭ является одним из факторов, приводящих к возникновению макулярной дегенерации, связанной с возрастом.
РПЭ и заболевания глаз. В ответ на травму, инфекцию и другие воздействия клетки РПЭ приобретают способность пролиферировать, мигрировать, соединяться с коллагеновыми волокнами, а также продуцировать коллаген, фибронектин, адгезирующие молекулы, микро клеточные протеины. Именно поэтому проводят профилактическую лазерную Коагуляцию, которая сгныулнрует образование РПЭ более надежного хориоретинального вала, препятствующего распространению субретинальной жидкости. В случае отслойки сетчатки РПЭ участвует в образовании демаркационной линии, предотвращая распространение отслойки.
Нормальный экстраклеточный матрикс препятствует пролиферации клеток РПЭ. При травме и воспалительных заболеваниях глаза клетки РПЭ продуцируют фибронектин и факторы роста, что приводит к миграции РПЭ в стекловидное тело и участию его в пролиферативных процессах. При этом клетки РПЭ теряют гексагональную структуру и приобретают морфологические свойства, характерные для фибробластов. Компоненты простаглацдина Е2, протеины MTI- ММР и ?5-интегрин могут играть определенную роль в перемещении клеток РПЭ в сторону стекловидного тела. A. Heckellin и соавт. (2002) установили, что витамин С подавляет процесс пролиферации. В то же время клетки РПЭ играют важную роль в создании иммунитета.
При интраокулярной инфекции (например, при заднем увеите) клетки РПЭ инициируют пенетрацию и повреждение сетчатки лимфоцитами, однако было отмечено, что клетки РПЭ могут также тормозить пролиферацию и активность лимфоцитов. Это происходит в результате секреции ингибирующих факторов типа простагландинов и цитокинов. Дополнительное значение имеет фагоцитоз лимфоцитов клетками РПЭ.
Участие РПЭ в электрогенезв. Тесная морфологическая и функциональная связь РПЭ с сетчаткой имеет большое значение в развитии биоэлектрических реакций, регистрируемых при исследовании глаза.
Р. Гранит (1947) установил, что с-волна ЭРГ возникает преимущественно в пигментном эпителии. Однако еще в XIX в. был зарегистрирован постоянный потенциал глаза, основным источником которого является РПЭ. Данный потенциал возникает вследствие того, что базальная мембрана клеток РПЭ, обращенная к сосудистой оболочке, гиперполяризована сильнее, чем апикальная мембрана, прилегающая к сетчатке. Эта биоэлектрическая асимметрия является следствием различий в ионной проницаемости: базальная мембрана проницаема только для ионов К+, а апикальная, кроме того, и для ионов НСО2
Максимальная разность потенциалов регистрируется между полюсами глаза — вершиной роговицы и задним полюсом. При этом роговица заряжена положительно, а задний полюс — отрицательно. Данный факт, а также активное участие РПЭ в формировании постоянного потенциала глаза лежит в основе электроокулографии, которую с успехом применяют для исследования функционального состояния РПЭ.
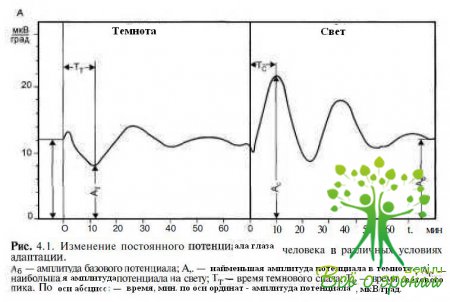
Большой вклад в развитие и внедрение электроокулографии в клиническую практику внес В.Я. Эскин (1984). В основе метода лежит непрямая регистрация постоянного потенциала (ПП) глаза при перемещении взора на стандартный угол по горизонтали. Величина потенциала при заданных условиях достаточно постоянна. Изменения условий адаптации приводят к снижению потенциала в темноте и повышению его на свету. Таким образом, при регистрации ПП от электродов, расположенных накожно, на наружном и
внутреннем углах глаза получают 3 параметра ПП: базовый, темновой и световой потенциалы (рис. 4.1).
В норме отношение светового подъема к тем- новому спаду, обозначаемое как коэффициент Ардена (Ка), составляет не менее 185 %. Н. Gliem (1971) предложил использовать 2 показателя (коэффициенты Глима): отношение тем нового (Кп)и светового (Кп) потенциалов к величине базового потенциала. Это позволяет дифференцированно оценить функции палочковой и колбочковой систем сетчатки, которые также принимают участие в генерации окулографических потенциалов при смене условий адаптации.
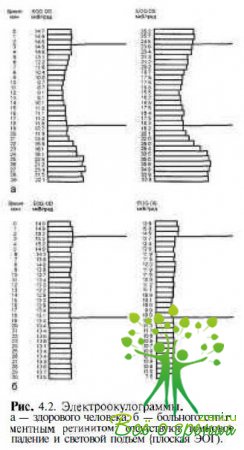
При патологическом состоянии пигментного эпителия, например при пигментном ретините, световой подъем и темновой спад на электроокулограмме (ЭОГ) отсутствуют (рис. 4.2).
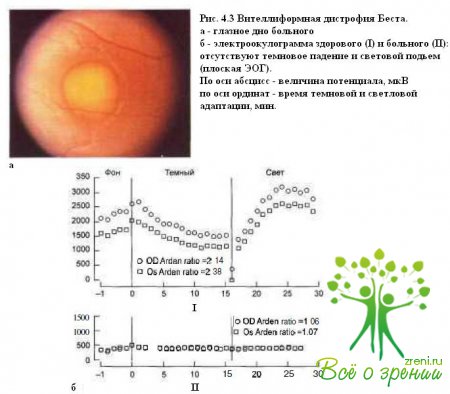
Этот же симптом является патогномоничным. для вителлиформной дистрофии Беста(рис. 4.3, а, б).
Возможности использования классической электроокулографии ограничены: достаточная острота зрения для фиксации взора при определенном угле поворота глаза, желание точно выполнять методические инструкции, способность совершать дозированные движения глаз. Однако при обследовании маленьких детей, в случаях агравации и симуляции, при очень низкой остроте зрения или значительном сужении поля зрения указанные выше условия проведения исследования не могут быть соблюдены. В.Я.
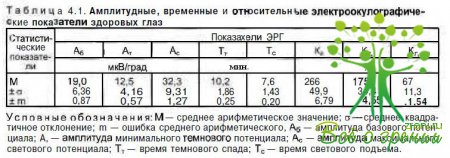
Эскиным была разработана импульсная электроокулография, при которой достаточно даже произвольного движения глаз на любой угол. При этом оценивают дифференцированное изменение ПП. Данные, полученные при проведении классической и импульсной электроокулографии, идентичны при синхронной записи у одного пациента. Импульсная электроокулография позволяет без потери диагностической информации зарегистрировать светотемновые колебания ПП глаза, не требуя от обследуемого строго дозированного поворота глаз. В табл. 4.1 приведены значения электроокулографических показателей в норме.
Результаты электроокулографии стабильны и разброс показателей невелик, чего не наблюдается при регистрации с-волны ЭРГ. Между тем отмечена прямая корреляция между величиной Ка ЭОГ, амплитудой с-волны ЭРГ и результатами компьютерной периметрии у больных с тапеторетинальной абиотрофией. При этом подчеркивается высокая информативность элекгроокулографии.
РПЭ подвергается изменениям в процессе старения организма и при различных патологических состояниях. D.A. Newsome (1988) выделил несколько видов поражения РПЭ:
- врожденная или приобретенная гипертрофия и гиперплазия РПЭ;
- макулярные дистрофии РПЭ;
- изменения РПЭ вследствие прямого или косвенного воздействия инфекционных агентов;
- заболевания РПЭ, связанные с неустановленными аномалиями хороида.
Среди врожденных изменений РПЭ W.R. Green (1996) выделяет гипертрофию, гиперплазию, гиперпигментацию, появление альбинотических пятен. Вторичная (приобретенная) реакция РПЭ проявляется в виде гипертрофии, гиперплазии, гиперпигментации, атрофии, скопления липофусцина.
В норме на глазном дне выглядит по-разному у разных индивидуумов, но одинаково на обоих глазах. На разных участках глазного дна интенсивность пигментации различна: в макулярной области более интенсивная, в фовеоле более коричневая вследствие правильного гексагонального расположения клеток РПЭ. Вокруг диска зрительного нерва слой РПЭ более разряжен. Почти во всех здоровых глазах в области зубчатого края отмечаются большая вариабельность размеров клеток РПЭ и его выраженная пигментация.
Статья из книги: Зрительные функции и их коррекция у детей | С.Э. Аветисов, Т.П. Кащенко, А.М. Шамшинова.


Комментариев 0