Роговая оболочка │ Часть 2

Описание
Нервы роговицы. Эпителий роговицы относится к наиболее интенсивно иннервируемым структурам организма человека. Чувствительная иннервация роговицы в 300—600 раз выше, чем иннервация кожи. Площадь эпителиального пласта, равная 0,01 мм2, содержит до 100 нервных окончаний. На 2,1 млн базальных клеток эпителия роговицы приходится до 1,4 млн нервных окончаний.Сенсорная иннервация обеспечивается, в первую очередь, ветвями глазного нерва (ветвь тройничного нерва). Главный источник иннервации роговицы — длинные ресничные нервы, являющиеся ветвями тройничного нерва.
Задний длинный ресничный нерв входит в склеру у заднего полюса и распространяется кпереди в супрахориоидальном пространстве. Различаются три уровня проникновения нервных окончаний в роговицу: склеральный, эписклеральный и конъюнктивальный.
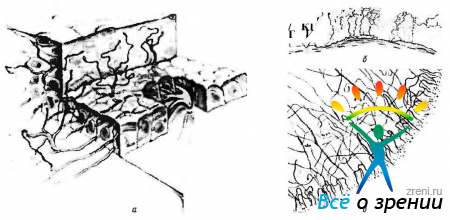
Около 80 нервных стволов проникают в ткань склеры вблизи лимба и, распространившись на 1—2 мм, теряют свои миелиновые оболочки. Эти волокна, покинув склеру, распределяются в средней трети стромы, делясь при этом ди- и трихотомически. Формируется в результате этого прекорнеальное сплетение. По мере продвижения к центральным участкам роговицы количество аксонов увеличивается за счет их последующего деления (рис. 3.2.12).
Рис. 3.2.12. Схематические изображения особенностей иннервации роговой оболочки: а — трехмерное изображение прохождения и распределения нервных волокон в роговой оболочке; б—поперечный срез роговицы. Распределение нервных волокон и нервных окончаний в переднем эпителии роговой оболочки: в — плоскостной препарат. Поверхностное краевое нервное сплетение
При прохождении в строме роговой оболочки немиелинизованные нервные волокна располагаются параллельно коллагеновым пластинам. Отдельные нервные веточки подходят к кератоцитам и вдавливаются в их цитоплазматическую оболочку. Окружают нервные стволы шванновские клетки и аморфный материал. Содержат аксоны многочисленные митохондрии, частицы гликогена и микропузырьки. Диаметр аксонов нервных волокон роговицы колеблется от 1 до 5 мкм.
В эпителиальный пласт из стромы нервы проникают через отверстия в боуменовой оболочке и образуют подэпителиальное сплетение. Иннервируются все эпителиальные клетки вплоть до поверхностных двух слоев, в которых нервные окончания имеют вид бусинок, колб Краузе, пластинок, лопаточек и др.. Концевые колбы Краузе, обеспечивающие температурную чувствительность, обнаруживаются лишь в области лимба. Некоторые сплетения нервных волокон контактируют с клетками Ларгенганса. Иннервации десцеметовой оболочки и эндотелия не выявляются.
Ультраструктурные особенности нервов роговой оболочки позволяют некоторым авторам предполагать наличие пептидэргической иннервации как кератоцитов, так и эпителиальных клеток.
Время регенерации нервных волокон роговицы длится около трех месяцев. Начинается регенерация нервов с периферии роговицы по направлению к центру. Помимо чувствительной иннервации, роговица обеспечена и вегетативной. Вегетативные волокна исходят из трех ганглиев. Это тройничный, ресничный и верхний шейный ганглии. Основным доказательством наличия вегетативной иннервации роговой оболочки является обнаружение отхождения нервных веточек от нервов лимбальных сосудов, а также эспериментальные исследования по перерезке нервных стволов, отходящих от вегетативных узлов, или после «раздражения» последних. Вегетативная иннервация обеспечивает трофику роговицы. Денервация роговой оболочки в эксперименте путем перерезки нервных стволов, входящих в глазное яблоко вблизи зрительного нерва, приводит к развитию дистрофических процессов, напоминающих нейропаралитический кератит у человека. Аналогичного характера дистрофические процессы роговой оболочки и структур переднего отдела глаза наблюдаются и после проведения циркляжа силиконовой лентой, которая передавливает ресничные нервы.
О значении иннервации говорит и то, что одним из необходимых основных условий дифференциации эпителиальных и стромальных компонентов роговицы после травмы или кератопластики является реиннервация роговой оболочки.
Старение роговой оболочки. Старение является естественным процессом у многоклеточных животных, приводящим к нарушению структуры и функции тканей и органов. У человека признаки старения проявляются как функция времени. Выражаются они в нарушении дифференциации клеток, а их причиной являются биологические изменения, заложенные генетически или возникающие под влиянием на организм внешней среды.
Процесс старения ткани можно разделить на старение длительно существующих белков, старение делящихся клеток и старение неделящихся клеток.
Делящиеся клетки характеризуются тем, что их популяция поддерживается равновесием двух разнонаправленных процессов — скоростью размножения клеток и скоростью их гибели. Наиболее типичным примером такой популяции являются клетки переднего эпителия роговой оболочки. В роговичном эпителии полная смена дифференцированных эпителиальных клеток происходит за 5—7 дней. Некоторые типы клеток способны к интенсивной пролиферации только после воздействия на них каких-либо внешних факторов. К подобным клеткам можно отнести кератоциты стромы роговицы. Клетки эндотелия роговицы также способны к делению, но деление эндотелиальных клеток у человека происходит исключительно редко. К неделящимся клеткам относятся нейроны головного мозга, а в глазном яблоке нейроны сетчатой оболочки.
Старение роговицы приводит к возникновению различных структурных и функциональных изменений. Эти изменения приводят к
- нарушению прозрачности роговицы,
- снижению регенераторной способности,
- нарушению кривизны поверхности, с
- нижению адаптационной способности ткани роговицы и др..
[banner_centerrs] {banner_centerrs} [/banner_centerrs]
Поскольку трудно отличить возрастные изменения от изменений, возникающих при различных патологических состояниях роговицы, имеет смысл кратко остановиться на основных положениях процесса старения.
Первоначально мы охарактеризуем особенности старения клетки.
Деление в популяции клеток происходит постоянно и находится под генетическим контролем. Одним из основных признаков старения клетки являются нарушение цикла репликации и нарушение жизненного цикла клетки. При этом клетки выходят из митотического цикла все в большем количестве. В клетках, вышедших из клеточного цикла, отмечается постоянное накопление нарушений как структуры, так и функции. Этим объясняется увеличение вероятности развития дегенерации ткани при старении по мере накопления подобных клеток.
Необходимо указать на отличия между стареющими клетками и клетками, находящимися в состоянии покоя (Оо-фаза). В состоянии покоя дифференцированные клетки не пролиферируют благодаря наличию контактного торможения. Стареющие клетки выходят из цикла не в состоянии конечной дифференциации. Именно по этой причине фенотип дифференцированной и стареющей клетки, выходящей из митотического цикла, существенно отличается. В первую очередь необходимо указать на то, что стареющая клетка покидает цикл с содержанием ДНК, характерным фазе G!. При этом в ее ДНК происходит ряд изменений, приводящих к нарушению функции клетки. К основному нарушению относят подавление транскрипции части генов. Подобные изменения могут быть «критическими», т. е. изменениями, приводящими к нарушению целостности и функции всей ткани.
В литературе рассматривается два основных пути, по которым происходит старение клетки. Первый путь — «конститутивное старение». Теория «конститутивного старения» предполагает, что при старении в результате пролиферации клеток увеличивается вероятность накопления в геноме ошибок, выводящих клетку из пролиферативного пула. Этот процесс является вероятностным, и трудно определить закономерности его развития. Кинетику «конститутивного старения» можно объяснить возможным прогрессивно нарастающим нарушением репликативной способности ДНК.
Второй путь старения клетки — это так называемое «реактивное старение». При этом типе старения предполагают, что, подобно апоптозу, старение может быть вызвано мутацией или влиянием на геном различных мутагенных факторов (противоопухолевые препараты и др.). Основным отличием от «конститутивного старения» является то, что подвергаются старению клетки с небольшой пролиферативной активностью. Офтальмолог должен помнить о подобном типе старения, поскольку в арсенале лечебных средств, используемых им, есть многочисленные мутагенные препараты, такие как 5-фтороурацил (применяется для предотвращения рубцевания после удаления птеригиума или после операции по поводу глаукомы), митоцин С. Экспериментально показано ускорение процесса старения клеток под воздействием этих препаратов в культуре ткани. Подобные лекарственные средства легко проникают через роговую оболочку и склеру при введении их в конъюнктивальную полость и могут явиться причиной преждевременного старения клеток различных структур глаза, что проявляется разным образом и спустя неодинаковый период времени после проведенного лечения.
Представляют особый интерес и данные, указывающие на стимуляцию процессов старения кератоцитов стромы роговицы после удаления переднего эпителия. Выражается это резким увеличением явлений апоптоза кератоцитов стромы, особенно ее передних слоев. В последующем, после эпителизации роговицы, происходит замещение погибших клеток новыми кератоцитами, мигрирующими из задних слоев стромы. Гибель кератоцитов в такой ситуации является примером конститутивного старения. Подобный тип старения, сопровождающийся уменьшением плотности кератоцитов, может стать причиной развития хронических заболеваний роговой оболочки различной этиологии.
К сожалению, явления старения структур роговой оболочки у человека изучены далеко не полностью. Тем не менее увеличение количества стареющих клеток с возрастом показано на культуре ткани клеток переднего эпителия, а также при исследовании роговой оболочки пожилых людей. С возрастом увеличивается также и количество старых клеток в эндотелии роговой оболочки.
Возникает вопрос: каким образом накопление с возрастом стареющих клеток влияет на частоту патологических состояний роговицы?
Основным изменением стареющей роговицы является снижение ее адаптационных возможностей. При этом роговица более подвержена инфекционному поражению. Увеличивается проницаемость как переднего, так и заднего эпителия.
Нарушение распределения в эпителии роговицы интегринов приводит к нарушению межклеточных контактов, что является причиной более свободного проникновения в нее бактерий, вирусов и клеток крови. Выявлено также, что при старении нарушение целостности переднего эпителия роговицы сопровождается нарушением целостности и эндотелия. Это, в свою очередь, приводит к отеку стромы роговицы и ее помутнению.
Исследований, посвященных изучению особенностей старения кератоцитов, немного. Тем не менее большинство исследователей переносят на эти клетки закономерности, выявленные при исследовании фибробластов in vitro. Показано, что при старении происходит экспрессия в фибробластах таких ферментов, как колагеназа, стромолизин и эластаза. Наблюдается экспрессия металлопротеиназ, уменьшение количества коллагена — mRNA. Нарушен также синтез фибронектина; снижается синтез протеогликанов, а также способность фибробластов контролировать трехмерную организацию коллагеновых волокон в культуре ткани. Отмечено накопление липофусцина в стареющих роговицах (cornea farlnata).
Особое место занимают выявленные нарушения синтеза коллагена. Подобные изменения, как правило, сопровождаются дезорганизацией коллагеновых фибрилл. Полученными данными во многом можно объяснить изменения стромы роговицы.
Необходимо отметить, что вышеприведенные изменения могут влиять и на характер регенерации роговой оболочки. Сводится это к уменьшению способности кератоцитов к пролиферации и миграции в область повреждения, синтезу коллагена и влиянию клеток на организацию коллагеновых фибирилл. Снижение репаративной способности структур роговицы описано у пожилых людей после экстракции катаракты. В подобных случаях старение неблагоприятно влияет на эффективность хирургических вмешательств. При проведении фильтрирующих операций по поводу глаукомы более длительная регенерация структур роговицы может иметь, наоборот, положительное значение. Необходимо отметить и то, что возрастные изменения роговицы оказывают определенное влияние на эффективность и рефракционных операций.
Теперь мы кратко остановимся на возрастных изменениях эндотелия роговицы. В результате многочисленных исследований установлено, что в возрасте между 20 и 80 годами жизни плотность эндотелиальных клеток уменьшается в среднем на 0,6%. При этом усиливаются клеточный полиморфизм и гиперплоидизация. Тем не менее показатель плотности клеток у отдельных индивидуумов колеблется в широких пределах, в связи с чем этот показатель не является надежным при определении связи между возрастом и структурой эндотелия. Снижение количества эндотелиальных клеток связывают с изменением гормонального фона, влиянием ультрафиолетового излучения, действием токсических веществ. Например, отмечающееся при старении нарушение перекисного окисления со скоплением свободных радикалов приводит к повреждению эндотелия.
Снижение плотности клеток приводит к нарушению и основной функции эндотелия, а именно поддержанию осмотического давления стромы. С возрастом ткань роговой оболочки также значительно хуже реагирует на гипоксию. Значительно дольше происходит приживление транспалантанта.
Таким образом, старение приводит к достаточно существенным изменениям как структуры, так и функции роговой оболочки, изменяя ее реактивность в норме и патологии. Это необходимо учитывать офтальмологу при оценке возможной эффективности проводимой терапии и, особенно, при разработке новых методов лечения.
Регенерация роговой оболочки. Различают следующие виды регенерации —
- физиологическая,
- репаративная
- заместительная.
Физиологическая регенерация характеризует постоянное обновление клеточного состава ткани в обычных (физиологических) условиях, обеспечивая тем самым нормальное функционирование ткани. Качественные характеристики физиологической регенерации существенно отличаются в зависимости от происхождения и гистологического строения ткани. Например, если передний эпителий роговой оболочки в норме регенерирует посредством постоянно протекающих митотических делений базальных клеток, то задний эпителий обновляется за счет так называемой внутриклеточной регенерации. характеризующейся постоянным обновлением, в первую очередь, внутриклеточных органоидов.
Полное обновление переднего эпителия роговицы происходит примерно за неделю. Раньше предполагали, что постоянное замещение слущивающихся поверхностных клеток происходит благодаря митотическим делениям клеток базального слоя. Дочерняя клетка при этом перемещается к поверхности. Теперь доказано, что в лимбальной области располагаются стволовые клетки, мигрирующие к центральным участкам роговичного эпителия. Стволовые клетки базального эпителия отличаются от остальных клеток как морфологически, так и наличием цитокератинов. Таким образом, пополнение состава клеток эпителия происходит путем первоначальной миграции стволовых клеток из лимбальной области, а затем их пролиферацией в базальном слое эпителия. Косвенным подтверждением этой миграции служат сообщения о перемещении пигментных клеток в виде клиньев из лимбальной области. Lauwerins et al. выявили мигрирующие клетки и назвали их транзиторными. Эти клетки в наибольшем количестве располагаются с темпоральной и назальной сторон недалеко от лимба. Они меньше в размерах, чем окружающие их эпителиальные клетки. Ядра этих клеток значительно крупнее.
Описано состояние, которое получило название «недостаточность стволовых лимбальных клеток». Развивается оно при большинстве заболеваний поверхности роговой оболочки и ее механической и химической травмах. Гистологически это состояние характеризуется васкуляризацией конъюнктивы лимбальной области, нарушением структуры базального эпителия, васкуляризацией и хроническим воспалением роговицы. Состояние недостаточности стволовых клеток является серьезным препятствием на пути приживления трансплантанта, существенно повышая вероятность его отторжения. Разработан ряд оперативных вмешательств, направленных на помещение в поврежденную область участка эпителиальной ткани, полученной из лимбальной области не поврежденного (второго) глаза. Этим методом проведено успешное лечение рецидивирующего птеригиума, кератита, химического ожога глаза и ряда других заболеваний. Естественно, что в тех случаях, когда повреждены оба глаза, подобное лечение проводить не представляется возможным. В таких ситуациях предлагается применять культуру стволовых клеток лимбальной области, клетки, выращенные на различных биологических подложках, в частности на амниотической базальной мембране и др. Первые результаты клинического применения этих методов дали обнадеживающие результаты.
Возвращаясь к описанию особенностей регенерации роговицы, необходимо напомнить, что понятие репаративной регенерации связывается с регенерацией, наступающей после повреждения ткани, т. е. с процессами, направленными на полное восстановление образовавшегося дефекта. Из структур роговой оболочки способен к «полноценной» репаративной регенерации только передний эпителий. При повреждении остальных образований происходит заместительная регенерация, при которой выполняется дефект ткани соединительной или глиальной тканью. Естественно, что при этом говорить о полном морфо-функциональном восстановлении ткани не приходится.
При рассмотрении вопросов регенерации роговой оболочки необходимо отметить и то, что тип и качество регенерации роговицы во многом зависят от глубины и обширности повреждения. Именно с этих позиций мы и охарактеризуем вопросы регенерации. Начнем с наименее выраженных травматических повреждений, сводящихся к разрушению только переднего эпителия роговицы (абразия).
Абразия развивается в результате ранения, при котором повреждаются несколько или все слои эпителия, но боуменова оболочка остается интактной. Заживление раны в таких случаях происходит путем наползания эпителиальных клеток на раневую поверхность с последующим их митотическим делением (пролиферация) и дифференциацией. Если заживление происходит без влияния осложняющих факторов (воспаление, токсическое влияние и т.д.), то эпителий полностью восстанавливается в довольно короткие сроки и рубца не образуется.
Клетки, расположенные на границе с дефектом, уплощаются, появляются псевдоподии, в которых выявляются актиновые фибриллы, необходимые для перемещения клеток. Эти клетки отделяются от базальной мембраны и начинают амебоидно перемещаться на раневую поверхность, покрывая ее. Перемещение прекращается только при полном покрытии дефекта благодаря включению механизмов «контактного торможения». Следующим этапом регенерации является митотическое клеточное размножение, продолжающееся до момента восстановления толщины эпителиального слоя. При этом образуются и межклеточные контакты. На конечном этапе формируется контакт эпителия с базальной мембраной.
Полное восстановление эпителия при отсутствии повреждения базальной мембраны происходит за 6 дней, а при ее разрушении — за 6 недель. Столь длительный период восстановления связан с длительностью формирования полудесмосом между эпителиальными клетками и базальной мембраной .
При тотальном повреждении переднего эпителия раневая поверхность роговицы покрывается эпителием конъюнктивы, и довольно быстро (за 48—72 часа). Первоначально этот эпителий тоньше, чем в норме, но митотическое деление клеток быстро приводит к его нормальной толщине. На протяжении недели или более конъюнктивальный эпителий принимает морфологические характеристики эпителия роговицы.
При «поверхностном» дефекте определяется дефект как переднего эпителия, так и боуменовой оболочки. При этом нарушение структуры передних слоев стромы может быть, а может и не быть. Заживление в таких случаях происходит так же как при абразии, за исключением того, что митотическое размножение клеток приводит к образованию утолщенных участков эпителия, видимых в щелевой лампе в виде нежных помутнений.
Необходимо отметить, что признаков восстановления боуменовой оболочки или поверхностных слоев стромы нет, а дефект выполняется рубцовой тканью. Рядом исследователей выявлено, что при более нежном заживлении стромы роговицы, что наблюдается только при повреждении ее поверхностных слоев, происходит экспрессия фибронектина эмбрионального типа.
«Глубокий дефект» характеризуется поражением эпителия, боуменовой оболочки, передней четверти толщины стромы роговицы.
На начальных этапах регенерации сохранившийся по краям ранения эпителий уплощается и наползает на раневую поверхность, пытаясь покрыть раневой дефект. Митотическое размножение эпителиальных клеток, покрывших раневой дефект, приводит к формированию эпителиального пласта, более толстого, чем в норме.
Дефект стромы выполняется фиброзной тканью, которая в месте повреждения истончается. При этом нормальная кривизна роговицы не восстанавливается. На месте боуменовой оболочки формируется соединительнотканный рубец.
Разрыв роговой оболочки (перфорирующее ранение). Заживление разрывов можно подразделить на 6 стадий:
- Первая стадия наступает непосредственно после разрыва и характеризуется зиянием раны в результате сокращения коллагеновых стромальных фибрилл и десцеметовой мембраны.
Образовавшийся дефект ткани пломбируется сгустком фибрина, образующегося при контакте фибриногена с «вторичной» влагой передней камеры. Фибриновый сгусток в последующем является опорой для дальнейшего размножения фибробластов. - Вторую стадию можно назвать лейкоцитарной. Начинается она, по крайней мере, через 30 минут. В этой стадии на протяжении не скольких часов (5—6 часов) по направлению к дефекту ткани мигрируют полиморфноядерные, в основном, нейтрофильные лейкоциты. Большинство нейтрофилов достигают области ранения посредством слезы; часть — мигрируют из перилимбальных сосудов, а часть — из камерной влаги. Основной функцией коротко-живущих нейтрофилов является фагоцитоз.
Мононуклеары в небольшом количестве появляются в месте травмы через 12—24 часа и функционируют как макрофаги. Затем они трансформируются в фибробласты. - Третья стадия обозначается как эпителиальная. Начинается она спустя 1 час. Основной чертой этой стадии является наползание на раневую поверхность и митотическое деление эпителиальных клеток.
Если нет большого зияния раны, то эпителий покрывает рану снаружи. При значительном расхождении краев эпителий прорастает в раневой канал. Эндотелий является ингибитором роста переднего эпителия по направлению внутрь глаза. По этой причине при повреждении эндотелия передний эпителии может разрастаться в передней камере. Атипическая регенерация переднего эпителия роговицы, сопровождающаяся избыточной пролиферацией клеток и их погружным ростом в направлении стромы, возможна также после химического ожога или после повторного удаления эпителия. - В результате фибробластической стадии формируется новая соединительная ткань. Необходимо отметить, что эпителий является сильным стимулятором формирования соединительной ткани. Он играет ключевую роль в трансформации кератоцитов и мононуклеаров в фибробласты.
Если эпителий не покрывает рану, то заживление раны заметно задерживается. По данным ряда авторов, он также обладает способностью синтезировать коллаген.
Фибробластическая стадия начинается спустя 12 часов. В «чистой» ране роговицы фибробласты формируются, главным образом, из кератоцитов, расположенных в углу раны. Как указано выше, фибробласты возникают из мононуклеаров, мигрирующих из влаги передней камеры или из области перилимбальных сосудов. Выдвинута также концепция о блуждающих фибробластах, поступающих к месту повреждения из передней камеры (Багров С. Н., 1980).
Образующиеся фибробласты больших размеров интенсивно синтезируют коллаген и основное вещество (кислые гликозаминогликаны). Вновь сформированная ткань схожа с так называемой грануляционной тканью. Отсутствует лишь важный структурный компонент грануляционной ткани — кровеносные сосуды.
Нередко определяется нарушение репаративной регенерации стромы роговой оболочки, возникающее по ряду причин. Существенное замедление процессов репарации происходит при обширных ранениях, длительной денервации роговой оболочки, воспалительных изменениях тканей роговицы и токсическом на них воздействии.
Процессы фибротизации раневого канала стромы роговой оболочки находятся под контролем множества различных биологически активных низкомолекулярных веществ, особенно так называемых факторов роста. К ним можно отнести- трансформирующий фактор роста бета (ТФР-Р),
- фосфолипидный фактор роста (PLGFs),
- топический фактор роста нервов (NGF),
- эндогенные опиоиды и др..
Трансформирующий фактор роста бета (ТФР-P) является мощным стимулятором фибротизации во всем организме, и в частности, в глазном яблоке. Способность этого фактора роста стимулировать фибробласты реализуется через рецепторы, закрепленные на поверхности клетки. Это ТФР-(3 рецепторы типа I. II и III. В процессах регенерации участвует и эндотелиальный фактор роста сосудов (VEGF). В нарушении регенерации тканей определенную роль играет и функциональная активность ряда генов, одним из которых является ген р53. Показано, что при келоидном рубцевании функция этого гена нарушена.
Участие в контроле регенерации тканей генов и различных факторов роста открывает возможность регуляции регенерации путем использования методов генной инженерии, ингибирования активности факторов роста моноклональными антителами и др. В последнее время ведутся интенсивные исследования в этих направлениях.
Так, показано, что эффективность антител, направленных против ТФР-р, приводит к уменьшению интенсивности рубцевания конъюнктивы. Авторами показано также, что использование моноклинальных антител способствует в эксперименте большей эффективности фильтрующих антиглаукоматозных операций, сохраняя длительное время фильтрационный канал. Моноклональные антитела в подобных случаях имеют преимущество перед препаратами типа митомицин, не обладая токсичностью для тканей глаза. - Эндотелиальная стадия начинается спустя 24 часа. Регенерация эндотелия имеет большое значение в восстановлении структурной и функциональной целостности роговицы. Регенерация эндотелия отличается от регенерации других эпителиальных образований определенными особенностями. Это связано с высокой специализацией клеток и практически полным отсутствием способности клеток к митотическому делению. Основной тип регенерации эндотелиальных клеток — внутриклеточный. Именнно гипертрофия клеток, увеличение их полиморфизма и нарастание содержания ДНК ядер (полиплоидия) являются морфологическим и функциональным проявлением этого типа регенерации. Лишь в условиях культуры ткани и при некоторых патологических условиях (например, после травмы) появляются морфологические признаки, указывающие на потенциальную способность эндотелиоцитов к митотическому делению.
Исходя из особенностей регенерации, сохранившиеся эндотелиальные клетки первоначально наползают на раневую поверхность, а затем дифференцируются. Поскольку деление клеток отсутствует, клетки значительно увеличиваются в размерах появляется клеточный и ядерный полиморфизм. Становятся они гиперплоидными. Спустя длительное время большинство эндотелиоцитов возвращается к своему изначальному размеру, но полного восстановления межклеточных контактов не происходит. Уменьшается плотность клеток. В связи с этим не полностью восстанавливается и барьерная функция эндотелиального слоя.
Спустя несколько недель восстанавливается базальная мембрана (десцеметова мембрана), синтезируемая эндотелиоцитами.
Эндотелий нередко в процессе регенерации подвергается избыточному разрастанию по задней поверхности роговицы. Иногда он становится многослойным и между клетками образуется волокнистая ткань, напоминающая десцеметову оболочку (метаплазия). - Поздняя стадия начинается спустя неделю.
Фибробластическая ткань первоначально содержит много клеток и беспорядочно ориентированных волокон. Постепенно число клеток уменьшается. Фибробласты превращаются в фиброциты. На последних этапах наступает ретракция рубца, в результате чего рубец истончается. В случаях формирования васкуляризованной ткани в ней обнаруживаются лимфатические сосуды.
Рубец легко определяется клинически в виде участка помутнения. Гистологически рубец обнаружить трудно.
Необходимо подчеркнуть, что ход и качество регенерации структурных элементов роговой оболочки отличаются в зависимости от особенностей фактора, повреждающего роговицу. По-иному протекает процесс регенерации после химических и термических ожогов. Своими особенностями обладает регенерация после применения различных хирургических (кератопластика) и лазерных манипуляций (рефракционная фотокератэктомия, лазерная термокератопластика). Эти различия касаются как скорости регенерации отдельных структур, так и качества регенерации.
В заключение необходимо кратко остановиться на обсуждаемой до сих пор роли конъюнктивального эпителия в регенерации эпителия роговой оболочки. Давно известно, что повреждения роговой оболочки могут репарировать за счет конъюнктивы. Повреждения роговицы стимулируют пролиферацию конъюнктивального эпителия и его наползание на рану. В норме эпителий роговицы является барьером на пути распространения конъюнктивального эпителия на роговицу. В случае повреждения эпителия роговицы эпителий конъюнктивы наползает на роговицу с подлежащей стромой, несущей кровеносные сосуды. Распространяются с эпителием и бокаловидные клетки. Ряд авторов считают, что конъюнктивальный эпителий, распространившийся на роговицу, подвергается трансдифференциации и приобретает свойства эпителия роговицы. При этом исчезают бокаловидные клетки в результате десквамации погибающих конъюнктивальных клеток.
На основании экспериментальных исследований ряд исследователей считают, что структурная трансдифференциация возможна, но при этом не наступает биохимической и функциональной. По этой причине наблюдаемый процесс они рассматривают как плоскоклеточную метаплазию конъюнктивального эпителия, сопровождающуюся потерей бокаловидных клеток.
Иной точки зрения придерживаются другие исследователи, которые отрицают наличие трансдифферециации конъюнктивального эпителия, считая, что как конъюнктивальный, так и роговичный эпителий сосуществуют без серьезных структрных изменений в процессе регенерации ранений роговицы. Более того, эпителий роговицы пытается сместить конъюнктивальный эпителий. По этой причине они считают, что так называемая трансдифференциация конъюнктивального эпителия является не чем иным, как смещением его эпителием роговицы. Наиболее важным при травме роговицы, по мнению этих авторов, является как можно более быстрое восстановление «лимбального барьера», т. е. образования, характеризующего место встречи двух типов эпителия. Причем восстановить барьер необходимо как можно быстрее по той причине, что конъюнктивальный эпителий очень быстро растет на роговицу. Именно наличие этого барьера не позволяет эпителию конъюнктивы наползать на роговицу, а также способствует дифференциации эпителиальных клеток роговицы. Восстановить «лимбальный барьер» возможно различными способами, включая хирургические.
----
Статья из книги: Строение зрительной системы человека | Вит В. В.


Комментариев 0