Аутоиммунные реакции на тканевые антигены глаза в патогенезе прогрессирующей и осложненной близорукости

Описание
Многофакторность развития аномалий рефракции, в частности близорукости, не вызывает сомнений. Многочисленные исследования патогенеза и взаимодействия основных этиологических факторов миопии заставляют искать новые пути подхода к лечению этого сложного, неоднозначно протекающего заболевания.Данные литературы, освещающие такое малоизученное звено патогенеза, как изменения состояния иммунитета или аутоиммунные реакции на тканевые антигены глаза, весьма немногочисленны и часто противоречивы. Тем не менее, очевиден устойчивый интерес к этой проблеме. Накопленные за последние 20 лет сведения позволяют с уверенностью говорить о необходимости продолжения исследований в этом направлении.
В 1983 г. впервые было выдвинуто предположение об определенной роли изменений иммунного статуса в патогенезе миопии. Внимание офтальмологов не могли не привлекать данные, подтверждающие связь между слабостью системы соединительной ткани у лиц с близорукостью и ослаблением иммунной системы. Отмечено, что лишь у 10—12 % детей и подростков с миопией нет признаков вторичною иммунодефицита разной степени выраженности. Рад отечественных авторов обратили внимание на роль иммунной недостаточности в течении близорукости. При этом е основном отмечены нарушения общего иммунного статуса: уменьшение общего количества лимфоцитов при близорукости (больше при стационарной, чем при прогрессирующей), однако наиболее выражено подавление Т-клеточного звена иммунитета при прогрессирующей миопии. В более поздних исследованиях Л.Ф. Лазаренко и А.М. Гаджиева (1994) отметили развитие дисбаланса иммуно-регуляторных механизмов в сторону как иммуноде-фицитного состояния, так и активации иммунных реакций.
Показано, что у детей с миопией часто встречается дисиммуноглобулинемия; при этом описано 3 варианта: снижение содержания иммуноглобулинов (Ig) какого-либо одного класса, повышение содержания Ig одного или двух классов и снижение уровня Ig одного класса при повышении содержания Ig других классов. Два последние варианта встречаются чаще. Системное повышение уровня IgG, местное и системное повышение концентрации IgM, системное повышение содержания IgG при одновременном понижении уровня связаны с течением миопии и требуют уточнения состояния соматического статуса обследованных больных. Небезынтересны результаты, полученные разными авторами и касающиеся иммунного реагирования при осложненном и неосложненном течении миопии. По одним данным, при осложненной близорукости наряду со значительным повышением уровня циркулирующих иммунных комплексов (ЦИК) в сыворотке крови отмечается достоверное нарастание их во влаге передней камеры глаза. Другие исследователи, напротив, утверждают, что отклонений в содержании ЦИК в сыворотке крови не обнаружено. При этом наиболее выраженные изменения были описаны ими в состоянии местного иммунного ответа у пациентов с периферическими витреохориоретинальными дистрофиями (ПВХРД), сопровождающимися дефектами сетчатки, а корреляции между видом, локализацией, количеством, величиной разрывов и иммунологическими показателями не отмечалось.
При осложненной миопии высокой степени выявлены снижение содержания Т- и S-лимфоцитов на фоне дисиммуноглобули немии (повышение уровня IgG при одновременном понижении lgM), сенсибилизация лимфоцитов (индекс миграции лимфоцитов в реакции торможения миграции лейкоцитов) к антигенам увеального тракта (0,6 ± 0,2) и сетчатки (0,5 ± 0,1). Обращает на себя внимание и накопление ЦИК в периферической крови до 98 ± 5 %, что в совокупности свидетельствует о сенсибилизации организма пациентов с высокой осложненной миопией к тканям глаза. При этом авторы отмечают, что на территориях Воронежской области, подвергшихся радиационному загрязнению в результате аварии на Чернобыльской АЭС, у пациентов с осложненной миопией высокой степени геморрагии различных локализаций и размеров встречались в 1,5—2 раза чаше, чем на остальной территории.
[banner_centerrs] {banner_centerrs} [/banner_centerrs]
Возможно, выраженность иммунного ответа в слезной жидкости и сыворотке крови определяется видом и чувствительностью используемого метода, чем и объясняются различия результатов в разных публикациях.
Значительное внимание уделено системе HLA. Показано, что при наследственной миопии наиболее часто (по сравнению со здоровыми) встречаются антигены комплекса гистосовместимости человека (HLA) A3, В7, В8, В12, причем HLA В7 и В8 могут иметь прогностическое значение для выявления риска развития отслойки сетчатки. Установлено, что в группе лиц с миопией, часто и длительно болеющих воспалительными заболеваниями вирусной и бактериальной природы, в зависимости от фазы процесса имеются существенные нарушения в функциональном состоянии иммунной системы. Так, выявлено снижение содержания СD 3, 8,71 и HLA DR при достоверном повышении содержания СD 3, 8, 4, 25, 34 и крупномолекулярных ЦИК. Наличие инфекционно-восстановительных процессов вне обострения при миопии сопровождается снижением маркеров СD 71 и НLА DR, отражающих дальнейшее продвижение лимфоцитов по клеточному циклу: процесс реализации сигнала к пролиферации лимфоцитов и степень перехода активационных сигналов в пролиферативные через ИЛ-2 и DR -рецепцию.
Как правило, вопросы, касающиеся развития аутоиммунных реакций, рассматриваются офтальмологами в аспекте воспалительных, посттравматических и некоторых других форм патологии органа зрения, например диабетической ретинопатии, но не аномалий рефракции. Тем не менее, выявленные одесской школой офтальмологов нарушения в системе клеточного иммунитета, обнаруженные О.С. Слеповой и соавт. (1991) повышение содержания антител к тканеспецифическому S-антигену сетчатки у взрослых пациентов с миопией заставили нас обратиться к этому практически не изученному звену патогенеза близорукости.
Мы обследовали детей и подростков в возрасте от 7 до 17 лет с прогрессирующей близорукостью средней и высокой степени, в том числе осложненной различными формами ПВХРД. Иммунологические исследования включали тесты гуморального иммунитета (иммуноферментный анализ — ИФА, реакция пассивной гемагглютинации — РПГА). В качестве тест-объектов использовали слезную жидкость и сыворотку крови. Так как S-антиген сетчатки (48 кД) является тканеспецифическим, т.е. обнаруживается лишь в сетчатке, а из экстраокулярных тканей — в эпифизе, мы изучили иммунный ответ на него, а также на коллаген — основной структурный белок склеры, так как ведущая роль склерального фактора в патогенезе прогрессирования близорукости признана абсолютным большинством исследователей. Такой высокоспециализированный вид соединительной ткани, как склера, чутко реагирует на изменения гомеостаза, возникающие под воздействием разнообразных внутренних и внешних факторов. Так, высказано предположение, что гормональный дисбаланс, особенно в пубертатном периоде, характеризующийся относительным дефицитом секреции половых гормонов при избыточной секреции кортизола, может вызывать нарушения связи между волокнами и основным веществом. Метаболизм склеры в значительной мере определяется динамическим равновесием процессов биосинтеза и распада ее основного структурного белка — коллагена, преимущественно типа 1 . Помимо этого, определяли концентрацию фибронектина в сыворотке крови.
Анализ полученных данных показал, что при миопии в целом положительные реакции к исследованным тканевым антигенам обнаруживались у 14—78 % обследованных в зависимости от тканеспецифической направленности иммунного ответа, иммунологического теста и биологической пробы. В подавляющем большинстве наблюдений они выявлялись достоверно чаще, чем в контрольных группах, но значительно реже, чем, например, при увеитах. Установлено, что при всех формах миопии накопление S-антител (S-AT) в слезной жидкости и/или сыворотке крови ассоциировалось в основном с ее осложненным течением. Однако неоднозначность проявления иммунопатологии обусловила интерес к углубленному изучению иммунного ответа на S-антиген (S-АГ) при разных формах ПВХРД. Анализ показал, что в целом у обследованных с каким-либо одним видом ПВХРД превалировало усиление системного гуморального иммунного ответа при умеренном (ретиношизис) или более выраженном (решетчатая дистрофия) системном накоплении S-АТ. При этом обращало на себя внимание, что в сыворотке крови одновременное повышение частоты и уровня S-АТ прослеживалось в основном по двум классам: lgM и lgA при решетчатой дистрофии; тенденция к накоплению третьего класса S-АТ проявлялась повышением лишь одного показателя — частоты или уровня. В местном иммунном ответе наиболее существенные сдвиги отмечались по S-lgG как при ретиношизисе, гак и особенно при решетчатой дистрофии. При сочетании этих форм дистрофий показатели местного антителообразования отличались не только накоплением S-lgG, но и значительным повышением частоты обнаружения высоких уровней S-lgA. Вместе с тем S-lgM практически не обнаруживались. Системный иммунный ответ смешанных форм ПВХРД характеризовался поликлональным накоплением S-АТ всех трех классов, однако при наиболее тяжелых формах, включающих ретиношизис, решетчатую дистрофию и разрывы сетчатки, содержание S-АТ классов в и М в сыворотке крови значительно снижалось при практическом отсутствии S-АТ класса А, т.е. имел место поликлональный системный «дефицит» S-АТ.
Подтверждением предположения о том, что накопление S-АТ в слезной жидкости и/или сыворотке крови может быть расценено как иммунологический признак заинтересованности сетчатки и может предшествовать клиническим проявлениям патологии, явились данные, полученные Т.Е. Кругловой (1996).
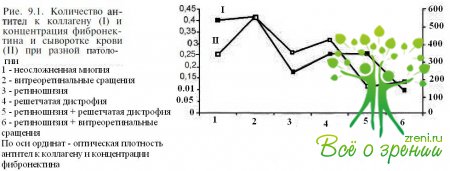
Результаты исследования антител к коллагену показали, что с помощью ИФА в сыворотке крови они выявлялись при всех формах миопии как при наличии, так и при отсутствии изменений на глазном дне. В слезной жидкости антитела не были обнаружены ни в одном случае. В контроле антитела к коллагену не выявлялись ни в слезной жидкости, ни в сыворотке крови. Существенное повышение содержания антител в сыворотке крови наблюдалось при неосложненной близорукости (сред: ДОП = 0,44 ± 0,08) по сравнению с осложненной (сред: ДОП = 0,14 + 0,02). Явный «дефицит» антител к коллагену отмечен при смешанных формах ПВХРД, включавших ретиношизис, решетчатую дистрофию и разрывы сетчатки (сред. ДОР < 0,1).
Полученные данные позволили предположить, что иммунный ответ на коллаген является определенным индикатором патологических изменений в склере. Выявленное нами накопление антител к коллагену в сыворотке крови, по-видимому, можно рассматривать как протективный фактор при растяжении и изменении склеральной ткани, что согласуется с данными о структурной неполноценности склеры при миопии, связанной с дефектным фибриллогенезом.
Содержание фибронектина, как и уровень антител к коллагену, при не- осложненной близорукости было умеренно высоким (342 ± 90,96 мкг/л). При осложненной миопии показатели были неодинаковыми: при наличии витреоретинальных сращений и решетчатой дистрофик концентрация фибронектина существенно повышалась: 562 ± 19,2 и 430 ± 31,3 мкг/л соответственно. Прогностически неблагоприятные формы дистрофий отличало существенное снижение показателей: 159 ± 23,7 мкг/л при сочетании ретиношизиса и решетчатой дистрофии и IК4 ± 48,96 мкг/л при сочетании витреоретинальных сращений и ретиношизиса (рис. 9.1).
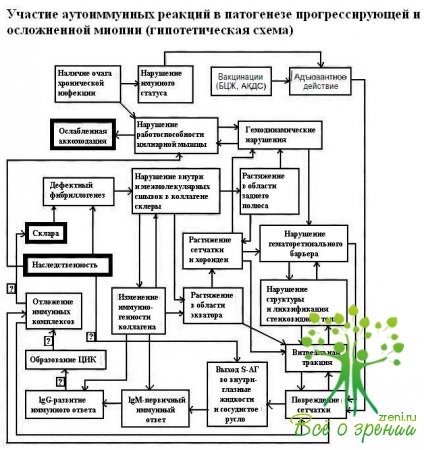
Полученные нами данные позволяют высказать некоторые предположения о взаимосвязи изменений, происходящих в тканях глаза при миопии, и сдвигов в состоянии аутоиммунитета (см. схему).
Известно, что первым на повреждение, возникающее при развитии близорукости при растяжении глазного яблока в переднезаднем направлении и особенно в области экватора, реагирует стекловидное тело. Происходит нарушение его структуры, возникает ликвификация, клинически проявляющаяся появлением конденсатов и затем, в зависимости от течения, последующим формированием либо витреоретинальных сращений, либо других форм ПВХРД. Исходя из этого, можно предположить, что на ранних стадиях включается механизм последовательного иммунологического и биохимического реагирования на растяжение и повреждение тканей глаза по мере прогрессирования миопии. Не исключено, что максимальное содержание фибронектина и минимальный уровень антител к коллагену при наличии витреоретинальных сращений являются отражением раннего реагирования стекловидного тела на постепенное увеличение объема глазного яблока. Происходящие при этом растяжение и истончение сетчатки, особенно в области экватора, приводят к патологическому выходу S-АГ И индукции аутоиммунных реакций к нему. Вместе с тем нельзя исключить и то, что усиление тканеспеиифическихреакций вследствие сдвигов в общем иммунном статусе организма, наблюдающихся при близорукости, может усугублять уже имеющиеся изменения сетчатки. В связи с широким распространением вакцинации БЦЖ и диагностических туберкулиновых проб необходимо помнить об адъютантом действии микобактерий при индукции S-экспериментальных аутоиммунных увеитов у животных.
Экспериментальные данные о значении гиперсенсибилизации к туберкулину в развитии инфекционно-аутоиммунных увеитов, полученные О С Слеповой (1991), подтверждают необходимость максимально внимательного отношения возможностям и срокам проведения вакцинаций у детей. Обнаружено, что подавляющее большинство больных с увеитами как эндогенными, так и посттравматическими, являются туберкулинположительными. У больных с увеитами нетуберкулезной природы характер реактивности in vitro на ППД-Л соответствует таковому у туберкулинконтактных лиц и значительно превосходит контрольные показатели.
Эти наблюдения позволили прийти к заключению, что туберкулинположи- тельные лица с 8-зависимыми формами невоспалительной офтальмопатологии (диабетическая ретинопатия, миопия), при бесконтрольной вакцинации туберкулином могут быть отнесены к группе риска развития увеита. Нельзя исключить, что к этой же Группе могут быть отнесены лица, которым была проведена вакцинация АКДС. Хотя клинических данных получено не было, показано, что значительное повышение иммунизирующей дозы S-антигена и применение в качестве адъюванта коклюшной вакцины вызывают развитие увеита у невосприимчивых в обычных условиях бестимусных крыс.
Определение причинно-следственных связей при одно- или двусторонней патологии тканей глаза и усилении клеточных и гуморальных системных аутоиммунных реакций ассоциируется с увеличением поступления антигенов в циркулирующую кровь. Вместе с тем возрастание содержания аутоантител может привести к развитию толерантности «высокой дозы», накопление аутоантител в сыворотке крови — к индукции антиидиотипических реакций и образованию специфических ЦИК. По мнению О.С. Слеповой, отрицательные результаты тестирования как местного, так и системного иммунного ответа не могут свидетельствовать о патогенетически благоприятном локальном ограничении тканеспецифических. реакций и должны рассматриваться как нарушения аутоиммунитета.
При неосложненном течении близорукости содержание S-АТ, антител к коллагену и фибронектину умеренно повышено. Это можно расценить как нормальное реагирование на происходящие при прогрессировании миопии изменения тканей глаза. Наблюдаемые при наиболее неблагоприятных, смешанных формах ПВХРД низкое содержание фибронектина и дефицит антител к Б-АГ и коллагену, возможно, отражают усугубление аутоиммунного процесса, одним из характерных признаков которого является образование иммунных комплексов антиген — антитело, циркулирующих в крови и откладывающихся в тканях, либо указывают на истощение иммунного ответа, что может являться показателем неблагоприятного течения миопии.
В заключение следует указать, что в целом данные литературы, а также результаты сравнительного анализа иммунного ответа на разные тканевые антигены глаза позволяют предположить, что выявленные иммунологические нарушения и аутоиммунные реакции, индуцированные S-АГ, коллагенами и другими компонентами склеры, могут явиться параллельными звеньями в многофакторной системе патогенеза прогрессирующей и осложненной миопии. Разработка этого направления в условиях увеличивающегося количества людей с признаками вторичного иммунодефицита при неуклонно растущем удельном весе миопии в структуре инвалидности среди лиц молодого, трудоспособного возраста открывает новые перспективы в плане разработки подходов к включению иммунокорригирующей терапии в комплекс мер лечения этого заболевания.
Статья из книги: Зрительные функции и их коррекция у детей | С.Э. Аветисов, Т.П. Кащенко, А.М. Шамшинова.


Комментариев 0