Клиническая картина осложненной близорукости

Описание
Дистрофические изменения на глазном дне при осложненной близорукости могут локализоваться как в его центральных отделах, так и на периферии. Центральные изменения касаются диска зрительного нерва (ДЗН) и макулярной области. Изменения ДЗН — это формирование миопического конуса, наклонное положение диска и супертракция оболочек (рис. 7.1).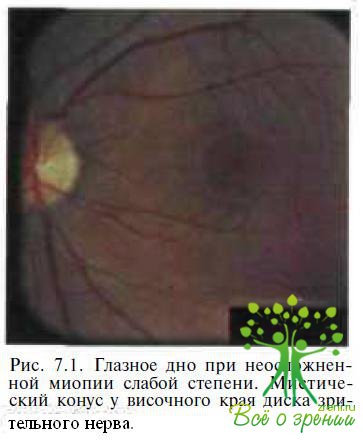
Конус — одно из наиболее часто встречающихся клинических проявлений миопии. Он формируется в результате ретракции комплекса стекловидной пластинки (пигментный эпителий — стекловидная пластинка — хориокапиллярис) от края диска зрительного нерва. В результате возникает концентрическая область, в которой белая склера хорошо просматривается через прозрачную нейросенсорную сетчатку. С противоположной стороны диска часто обнаруживается утолщенный край оболочек, покрывающий часть оптического отверстия и называемый супертракцией. Наиболее часто конус располагается с височной стороны ДЗН, но может иметь и любую другую локализацию. По мере прогрессирования миопии размеры конуса увеличиваются, нередко формируются круговые конусы.
С возрастом у больных с высокой прогрессирующей близорукостью развивается перипапиллярная атрофия хороидеи с вовлечением в нее края конуса, который при этом становится неровным. Возникает как бы двойной конус: внутренний склеральный и наружный хороидальный, что является признаком активного растяжения склеры, прогрессирования миопии и, возможно, начала формирования стафиломы. Об этом же свидетельствуют наклонное положение ДЗН (в сторону формирующейся стафиломы) и супертракция оболочек с противоположной стороны. У части взрослых пациентов с высокой прогрессирующей близорукостью развивается частичная атрофия ДЗН, предположительно сосудистого генеза, с соответствующим его побледнением. Изменяется также ход сосудов ДЗН (в виде лежачей буквы «Т» или «У») и уменьшается их калибр.
Центральные хориоретинальные дистрофии (ЦХРД) При миопии — это «сухая» (атрофическая) и «влажная» (транссудативная) дистрофии лаковые трещины, центральное пигментное пятно Фукса.
Сухая форма ЦХРД характеризуется вначале побледнением глазного дна вследствие частичной утраты пигментного эпителия и хориокапиллярного слоя (рис. 7.2).
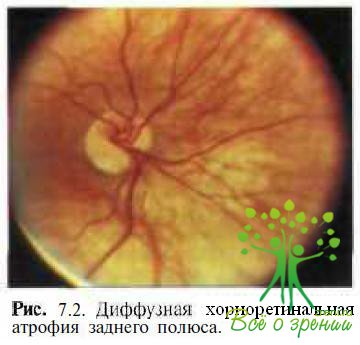
Атрофия этих слоев делает видимыми при офтальмоскопии крупные сосуды хороидеи. Это создает картину так называемого мозаичного глазного дна. По мере прогрессирования процесса запустевают мелкие, средние и крупные сосуды хороидеи. Истончение нейросенсорной сетчатки в макулярной зоне, ее атрофия, особенно при формировании стафиломы, приводят к выпрямлению ретинальных сосудов и уменьшению или исчезновению желтой окраски макулы. Не редко при дегенеративной миопии отмечают аномальное распределение хороидальных вен. Водоворотоподобные вены, хорошо видимые через истонченные ткани, могут пересекать макулярную зону или окружать ДЗН.
Описанная картина представляет собой диффузную хориоретинальную атрофию и может затрагивать весь задний полюс, а также периферию глазного дна. в макуле и парамакулярно, а также вокруг ДЗН вначале могут появляться мелкие окружности белого цвета очажки, иногда с пигментированными краями: развивается очаговая хориоретинальная атрофия (рис. 7.3).
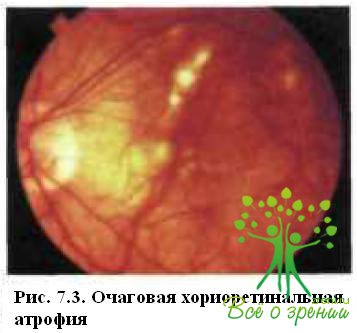
С возрастом и по мере прогрессирования миопии очаги увеличиваются и имеют тенденцию к слиянию.
Атрофическая, или «сухая», форма ЦХРД сопровождается постепенным медленным снижением зрения. Возможен переход «сухой» формы ЦХРД во «влажную»; это, по разным данным, происходит в 13—60 % случаев.
Транссудативная, или «влажная», форма ЦХРД при миопии встречается значительно реже, чем «сухая» однако характеризуется относительно ранним началом н тяжелым течением и сопровождается резкой внезапной потерей зрения. Патогенетическую основу этой формы макулодистрофии составляют хориоретинальные изменения с повреждением мембраны Бруха и в части случаев с развитием субретинальной неоваскуляризации. Наиболее частой формой транссудатов ной миопической макулодистрофии является геморрагическая (рис. 7.4).
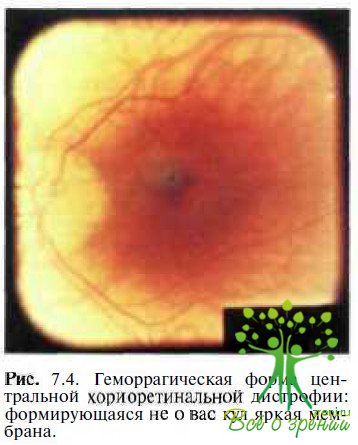
Различают два основных патогенетических типа кровоизлияний при миопии: связанные с разрывами стекловидной пластинки (формирование так называемых лаковых трещин — ЛТ) без неоваскуляризации и связанные с формированием субретинальной неоваскулярной мембраны.
Кровоизлияния первого типа могут встречаться у молодых пациентов, а также у детей и подростков с врожденной или, реже, рано приобретенной миопией и быть одним из ранних признаков ее осложненного течения. Они имеют вид единичных или множественных темно-красных округлых пятен с четкими контурами, как правило, небольшого размера: от точечных до ? диаметра диска (ДД). Их нередко называют монетовидными. Они располагаются в наружных (глубоких) слоях сетчатки, где аксоны располагаются перпендикулярно поверхности мембраны Бруха. В этих слоях экстравазация крови имеет дискретную локализацию, поскольку элементы крови разгорожены окружающими аксонами.
С помощью флюоресцентной ангиографии показана возможность локализации кровоизлияний первого типа и в хоровдее. Как правило, они быстро рассасываются без значительного снижения функции.
Как уже упоминалось, происхождение этих кровоизлияний связывают с формированием ЛТ (рис. 7.5).
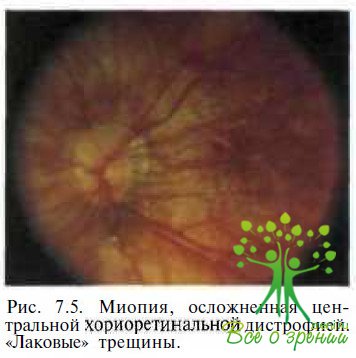
ЛТ имеют вид желто-белых ломаных линий неравномерною калибра, часто ветвящихся, звездчатых, пересекающих задний полюс в косом, радиальном или, чаще, горизонтальном направлении. Большинство ЛТ образуется в макулярной зоне, в основании стафиломы, некоторые достигают височного перипапиллярного конуса. Они локализуются в самых глубоких слоях сетчатки. Сосуды хороидеи могут пересекать ЛТ сзади, ход этих сосудов, по данным ФАГ, не прерывается.
Внутренние слои сетчатки над ЛТ не повреждены. Происхождение ЛТ связано с механическим повреждением комплекса пигментный эпителий — стекловидная пластинка — хориокапиллярис. Впоследствии разрывы замещаются рубцовой тканью и могут со временем растягиваться в большие атрофические очаги. Повреждение хориокапилляров при разрыве этого комплекса и является источником геморрагии. Появление ЛТ может сопровождаться субъективными ощущениями: вспышками света, метаморфопсиями, положительной скотомой в поле зрения, что может свидетельствовать о макулярном кровоизлиянии. Даже при центральной локализации геморрагий прогноз восстановления зрительных функций после их рассасывания в 80—90 % случаев благоприятный. Однако в целом при ЛТ прогноз следует делать осторожно ввиду их нередкого сочетания с субретинальной неоваскуляризацией и очаговыми атрофическими поражениями, постепенно вовлекающими область макулы. ЛТ и монетовидные кровоизлияния чаще встречаются в глазах с высокой миопией и ПЗО > 28,0 мм, однако отмечены и в 4,3 % глаз с ПЗО > 26,5 мм.
[banner_centerrs] {banner_centerrs} [/banner_centerrs]
Кровоизлияния второго типа связаны с формированием неоваскулярной мембраны — НВМ (см. рис. 7.4). Трещины в мембране Бруха могут сопровождаться врастанием новообразованных сосудов из хориокапиллярного слоя через дефект стекловидной пластинки в субретинальное пространство. Источником геморрагий в этом случае являются несостоятельные порожные новообразованные сосуды.
Кровоизлияния могут располагаться субинтра или преретинально, имеют неправильную форму в виде пятен, полос, полуколец с не всегда четкими границами и большие размеры (до 1,5 ДЦ), могут сопровождаться перифокальным отеком. По мере рассасывания геморрагии становится виден проминирующий очаг сероаспвдного или зеленоватого цвета, нередко с участками гиперпигментации и отека сетчатки. Клинически появление НВМ часто сопровождается метаморфопсиями, а затем резким снижением зрения и положительной скотомой в поле зрения. Ведущими офтальмоскопическими проявлениями являются серозная и/или геморрагическая отслойка нейроэпителия и/или пигментного эпителия.
Миопия является второй по частоте причиной хоровдальной неоваскуляризации (первая — это возрастная макулодистрофия).
Неоваскулярная мембрана может располагаться либо под сенсорной сетчаткой (субретинальная мембрана), либо под пигментным эпителием (так называемая субпигментная, или хороидальная НВМ). Последнюю ввиду ее скрытого расположения за пигментным эпителием, затрудняющею не только офтальмоскопическую, но и флюоресцентно-антиографическую диагностику , называют скрытой или оккультной. Только ангиография с индоцианиновым зеленым (ICG) на ранних фазах исследования позволяет визуализировать такие мембраны. Отмечено развитие комбинированных НВМ с субретинальны- ми и субпигментными компонентами. Типичным для хо- ровдальных НВМ является развитие субпигментных геморрагии1, которые выглядят очень темными и могут быть приняты за увеальную меланому.
Факторами, способствующими неоваскуляризации при миопии, являются гипоксия сетчатки, развивающаяся вследствие нарушения микроциркуляции, и трещины в мембране Бруха, возникающие из-за деформации оболочек глаза при растяжении склеры. Гистологическое исследование НВМ у детей показало их идентичность с мембранами при возрастной макулодистрофии, что позволило считать хороидальную неоваскуляризацию стереотипным неспецифическим ответом на специфический стимул.
Таким стимулом может быть окислительный стресс, затрагивающий макулярный пигментный эпителий.
Отличительными признаками НВМ при миопии являются ее локализация вблизи фовеолы, относительно небольшие размеры (около ? ДД), быстрое рубцевание с отложением пигмента в виде кольца и образованием перифокального атрофического хориоретинального очага.
Меньшую активность процесса и более высокий процент спонтанного рубцевания НВМ при миопии связывают с атрофическими изменениями хориокапиллярного слоя, являющегося источником роста новообразованных сосудов. Этим же объясняется и редкое появление неоваскуляризации в глазах с JIT и монетовидными кровоизлияниями при чрезмерном удлинении глазного яблока (ПЗО > 28,0 мм).
При завершении обратного развития НВМ на ее месте формируется пигментиронанный фиброваскулярный очаг: пятно Ферстера-Фукса (рис. 7.6).
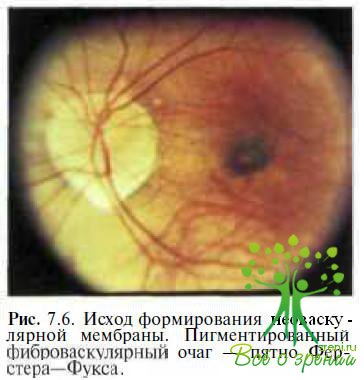
Однако НВМ склонны к рецидивирующему течению, увеличиваясь по площади, рудцуясь с одной стороны и продолжая создавать гемморагии с другой. Отмечено, что у больных с пятном Ферстера-Фукса наиболее часто выявляется врожденная или рано приобретенная миопия.
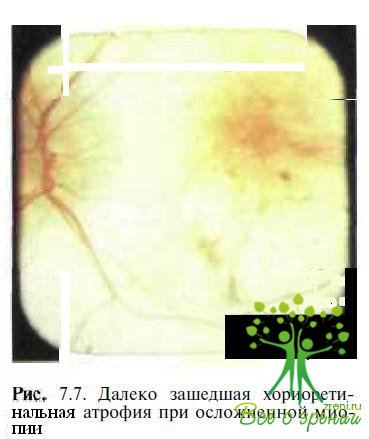
В наиболее тяжелых случаях осложненной миопии формируется задняя стафилома. Так называют истинное выпячивание (экстазия) склеры в заднем отделе глазного яблока, сопровождающееся типичными офтальмоскопическими признаками. В зависимости от локализации B.J. Curtin (1985) различал заднеполюсную, макулярную, перипапиллярную, назальную, нижнюю стафиломы), а также от стадии развития она может варьировать по площади и глубине, иметь более или менее четкие и острые края, через которые перегибаются сосуды сетчатки. В зоне эктазии наблюдаются грубые хориоретинальные изменения, представляющие собой различные комбинации перечисленных выше и в наиболее тяжелых случаях соответствующие описанию IV—V стадии изменений глазного дна по Аветисову— Флику обширные атрофические очаги, сливающиеся между собой, со скоплением пигмента в виде глыбок и сохранением ткани сетчатки в виде редких островков. Края стафиломы нередко также вовлекаются в атрофический процесс (рис. 7.7).
Не менее важными в клинической картине осложненной миопии являют- иферические витреохориоретиие дистрофии (ПВХРД). Важность ВХРД определяется их ролью в возникновении дистрофической от- сетчатки. Риск возникновения отслойки сетчатки в глазах с миопией, растянутых как в аксиальном, так и во фронтальном, вертикальном и косых направлениях, увеличивается из-за нескольких факторов: развития задней отслойки стекловидного тела, периферических хориоретинальных дистрофий и витреоретинальной тракции.
В образовании ПВХРД принимают участие 3 анатомических субстрата: стекловидное тело, хороидея и сетчатка, что и нашло отражение в их названии. Согласно наиболее принятой в нашей стране классификации Е.О. Саксоновой и соавт. (1979), выделяют следующие виды ПВХРД:
- Экваториальные:
а) решетчатая;
б) изолированные разрывы сетчатки;
в) патологическая гиперпигментация. - Параоральные:
а) кистевидная;
б) ретиношизис;
в) хориоретинальная атрофия. - Смешанные формы.
Решетчатая дистрофия является наиболее важной из всех форм ПВХРД из-за ее склонности к формированию разрывов и повышенного риска возникновения отслойки сетчатки. Это резко очерченная, циркулярно ориентированная веретенообразная зона, расположенная на экваторе или несколько кпереди от него, как правило, более или менее пигментированная (рис. 7.8).

Классическую картину решетки или палисада создают белые переплетающиеся линии, пересекающие область поражения и представляющие собой облитерированные ретинальные сосуды. Однако этот признак не является обязательным для постановки диагноза и отсутствует на ранних стадиях процесса.
В пораженной зоне имеются истончение сетчатки (ранний признак дисрофии) и разжижение и отслойка прилежащих отделов стекловидного тела. По краям дистрофической зоны располагаются блестящие бело-желтые крапинки — формирующиеся витреоретинальные сращения. В дальнейшем внутри пораженной области развиваются атрофические разрывы сетчатки, по краям — тракционные. Отмечено, что последние чаще приводят к развитию отслойки сетчатки, однако первые чаще вызывают ее у молодых пациентов с миопией высокой степени.
В 34—76 % случаев решетчатая дистрофия встречается на обоих глазах. Чаше всего она локализуется в височных квадрантах (особенно верхнеенаружном), а также в меридианах 12 и 6 ч. Отмечено, что в 70—80 % случаев решетчатая дистрофия обнаруживается в меридианах от 11 до 1 ч и от 5 до 7 ч. Патологические изменения при решетчатой дистрофии могут прогрессировать, что проявляется увеличением площади поражения, формированием новых разрывов и возникновением новых дистрофических зон. Такое прогрессирующее течение, по разным данным, отмечается в 12,5—36 % случаев.
Разрывы сетчатки (как изолированные, так и связанные с решетчатой дистрофией) по механизму развития разделяют на тракционные и атрофические. Первые возникают в результате витреоретинальной тракции и по форме бывают клапанными, линейными (незавершенный клапан) или с крышечкой. Вторые образуются в результате трофических изменений в сетчатке и имеют округлую дырчатую форму. По клиническим признакам разрывы разделяют на бессимптомные и симптоматические. В последнем случае больные отмечают фотопсии, являющиеся признаками витреоретинальной тракции, и плавающие помутнения, которые могут появиться внезапно вследствие кровоизлияния в стекловидное тело из сосуда сетчатки, поврежденного при формировании тракциоиного разрыва. Наличие витреоретинальной тракции (нередко вследствие остро развившейся задней отслойки стекловидного тела) объясняет более высокую частоту возникновения отслойки сетчатки при симптоматических разрывах. У детей и подростков разрывы выявляются достаточно часто: В 6,4—25 % случаев в зависимости от контингента обследуемых.
Патологическая гяперпигметпацая может быть выражена по-разному: от легкого диффузного потемнения или пигментных глыбок разной величины и формы до наличия больших пигментированных наложений, которые могут сливаться в широкую полосу между экватором и зубчатой линией. Процесс может сочетаться с витреоретинальной тракдией, которая проявляется сероватым налетом на поверхности пигментированных очагов и может явиться причиной формирования тракционных разрывов (по некоторым данным, почти в 32 % случаев).
Возникновение указанной формы ПВХРД объясняют пролиферацией пигментного эпителия сетчатки. Одни авторы считают причиной этого биохимические изменения и витреоретинальную тракцию, другие — аномалии развития пигментного эпителия.
Кистевидная дистрофия встречается почти у всех пациентов с миопией старше 8 лет, а в глазах пожилых людей считается закономерным явлением. Однако она может приводить к формированию атрофических дырчатых разрывов.
Периферический дегенеративный ретиношизис— патологический процесс, в основе которого лежит расслоение сетчатки. В I стадии по крайней периферии глазного дна, чаще всего в нижненаружном квадранте, появляется резко отграниченный участок непрозрачной сетчатки сероватого цвета, иногда слегка приподнятый. Во II стадии ретиношизис распространяется как к центру, так и по окружности, нередко занимая в виде пояса всю периферическую часть сетчатки. На поверхности пораженной зоны нередко наблюдаются блестящие желтоватые крапинки. (В отличие от картины решетчатой дистрофии они более крупные и расположены хаотично на большой площади.) В III стадии выявляются большие пузыревидные возвышения сетчатки (буллезный ретиношизис), появляются разрывы в его стенках, как правило, сначала во внутренней, с последующим развитием в части случаев отслойки сетчатки.
Хориоретинальная атрофия типа «булыжной мостовой» чаще встречается в возрасте старше 40 лет и в типичном виде представляет собой округлые желто-белые очаги, расположенные на 1—2 ДД кзади от зубчатой линии, размером от 0,1 до 1,0ДД. Они могут рас - полагаться поодиночке или группами и имеют тенденцию к слиянию в сплошную полосу с фестончатыми краями, разделенную разным количеством пигмента.
Хороидальные сосуды часто пересекают область дистрофии сзади. Причиной развития этой дистрофии являются сосудистые изменения, приводящие к дегенерации хориоретинального комплекса. Изменений стекловидного тела, связанных с этой дистрофией, в отличие от всех прочих не отмечено.
Считается, что эта форма ПВХРД не предрасполагает к развитию отслойки сетчатки и даже может выполнять роль барьера при ее возникновении (за счет отложения пигмента, укрепляющего связь сетчатки с хоровдеей). Если отслойка все же захватывает область «булыжной мостовой», то бывшие атрофические очаги из-за резкого истончения сетчатки выглядят на фоне отслоенной сетчатки как ярко-красные фокусы (псевдоразрывы).
Э.С. Аветисов и Л II. Флик в 1974 г. предложили классификацию центральных хориоретинальных изменений при близорукости. В I стадии отмечается только небольшой конус у диска зрительного нерва. Во II стадии конус увеличивается и исчезают ареолярные рефлексы в макуле без признаков дистрофических изменений. Стадии III—V отражают нарастающую центральную хориоретинальную дистрофию от мелких дефектов пигментного эпителия до развития стафиломы и формирования обширных атрофических и пигментных очагов.
В начале развития близорукости у детей глазное дно обычно соответствует I стадии, реже — II. Однако дистрофические изменения глазного дна в части случаев встречаются уже в детском возрасте, особенно при врожденной и ранопри обретенной близорукости.
Врожденная близорукость — особая форма, которая формируется в период внутриутробного развития плода.
Частота миопии у новорожденных составляет 6—15 %, а по некоторым данным, до 25—50 %. В подавляющем большинстве случаев это преходящая рефракционная миопия новорожденных, обусловленная более сильной преломляющей способностью хрусталика, недостаточным действием циклоплегических средств на незрелую цилиарную мышцу, некоторой дискорреляцией анатом оптических элементов рефракции. В течение первых месяцев жизни эта миопия исчезает в результате созревания цилиарной мышцы, уменьшения преломляющей силы роговицы и хрусталика, углубления передней камеры, и к концу 1 года частота миопии у детей составляет 1,4—4,5 %. Как правило, это высокая близорукость, которая сохранилась в период эмметропизации. Об этом свидетельствует и совпадение ее частоты с частотой миопии высокой степени, выявляемой у новорожденных: 1,0—3,2%. Транзиторная миопия новорожденных, называемая физиологической, очевидно, может служить неблагоприятным признаком, предрасполагающим к развитию приобретенной миопии в дальнейшем. Так, например, отмечено, что 42 % детей, имевших при рождении миопию, исчезнувшую к 3 годам, вновь стали близорукими к 8—9 годам, в то время как среди новорожденных с гиперметропической рефракцией миопия к 9 годам появилась только у 10 %.
Врожденную близорукость разделяют на преходящую, как правило, слабую, миопию новорожденных и истинную, или первично врожденную, миопию, выявляемую в возрасте от 1 года до 3 лет. Последняя обычно характеризуется высокой степенью, увеличением длины переднезадней оси глаза, изменениями на глазном дне, что дает основание считать ее патологической по своей Природе. Врожденная (и появившаяся на первом году жизни) миопия нередко бывает связана с системными мезо- и эктодермальными пороками. У таких детей значительно чаще наблюдаются голубые склеры, деформации грудной клетки, плоскостопие, пупочные грыжи, арахнодактилия, синдром Марфана и другие типы дисплазии соединительной ткани. A.B. Хватова и СОЗВТ. (1993) при обследовании 40 детей с дисплазиями соединительной ткани (синдромы Марфана, Стиклера—Маршалла, Маркезани) выявили в большинстве случаев миопию (от —8,0 до -20,0 дптр) в возрасте от 1 года до 3 лет. Миопия имела прогрессирующий характер, сочеталась с иридодонезом (с первых дней жизни) ектопией, подвывихом, вывихом, колобомой хрусталика, деструкцией стекловидного тела, голубыми склерами, в ряде случаев — с факоматозами.
М. Tost (1990), указывая на нередкое сочетание осевой миопии с аномалиями зрительного нерва (ложный неврит, псевдозастойный сосок, колобома, атипичные конусы ДЗН), расценил это как проявление эктодермальных пороков развития. По его мнению, атипичные, особенно нижние, конусы ДЗН являются результатом неправильной индукции зачатка эктодермы глаза, нарушения закрытия щели глазного бокала.
В то же время нередко встречается и врожденная миопия средней степени. В целом пациенты с врожденной близорукостью представляют гетерогенную труппу, различающуюся по наследственному фону, картине глазного дна, степени функциональных расстройств. На ее возникновение и характер дальнейшего развития может оказывать влияние ряд пре- и перинатальных факторов, таких как болезни, матери (токсикоз беременных, краснуха, алкоголизм), недоношенность, малая масса тела при рождении.
Э.С. Аветисов (1999), Э.С. Аветисов и К.А. Мац (1989) выделяют по происхождению 3 формы врожденной миопии;
- Врожденная миопия вследствие дискорреляции между анатомическим и оптическим компонентами рефракции как результат сочетания относительно длинной оси глаза с относительно сильной преломляющей способностью его оптических сред (главным образом хрусталика). Если это не сочетается со слабостью склеры, то такая близорукость обычно не прогрессирует: удлинение глаза в процессе роста сопровождается компенсаторным уменьшением преломляющей силы хрусталика.
- Врожденная миопия, связанная со слабостью склеры и ее повышенной растяжимостью. Такая близорукость интенсивно прогрессирует и Представляет собой одну из наиболее неблагоприятных в прогностическом отношении форм.
- Врожденная миопия при пороках развития глазного яблока. Мистическая рефракция, обусловленная анатомо-оптической дискорреляцией, сочетается в этом случае с разными видами патологии и аномалиями развития глаза (косоглазие, нистагм, колобомы оболочек глаза, подвывих хрусталика, частичное сю помутнение, частичная атрофия зрительного нерва и др.).
При условии ослабления склеры такая близорукость может прогрессировать по картине глазного дна различают 3 типа первичной врожденной высокой близорукости:
- Врожденная стационарная миопия без изменений глазного дна: как крайний вариант нормального распределения рефракции; по природе рефракционная.
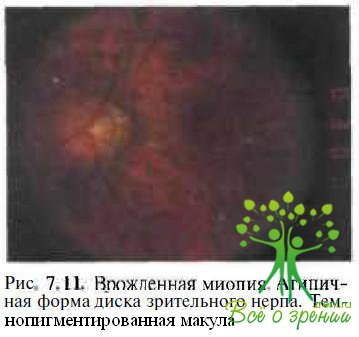
- Врожденная миопия пигментного типа: гиперпигментация макулы в сочетании с маленькими дисками, сужение ретинальных сосудов; часто сочетается с нистагмом.
- Альбинотический тип (вторичный по отношению к тотальной или локальной гипоплазии и истончению пигментного эпителия. М. Маиа5с( 1934), который считал наиболее характерным для врожденной миопии альбинотический тип глазного дна вследствие дефектного пигментного эпителия: побледнение глазного дна, хорошо просматривающиеся сосуды хороидеи, в ряде случаев сочетание с частичной атрофией ДЗН.
Характерным признаком врожденной миопии является сочетание с врожденными изменениями глазного дна, связанными с аномалиями развития глаза. К ним относят изменения формы ДЗН, чаше в виде горизонтального или вертикального овала, уменьшение размеров диска, частичную его атрофию, гиперпигментацию макулярной зоны (так называемая темнопигментированная макула), альбинизм. Наряду с выделяют приобретенные изменением ПЗО в процессе прогрессирования близорукости и свойственные как врожденной, так и приобретенной миопии: конусы, супертракцию оболочек у края диска, мозаичность и побледнение глазного дна, а также те или иные формы центральных и периферических хориоретинальных дистрофий. Не исключают, что конусы, мозаичность и побледнение могут быть врожденными или появиться на первом году жизни как следствие внутриутробного растяжения оболочек.
Из 230 глаз с врожденной миопией, исследованных в Московском НИИ глазных болезней им. Гельмгольца, врожденные изменения глазного дна выявлены в 153 (66,5 %). Изменения диска зрительного нерва (рис. 7.9 и 7.10) обнаружены в 98 (42,6 %) глазах: в виде вертикального овала в 30 (в ряде случаев в сочетании с косым вхождением в склеру), в виде горизонтального овала в 15, неправильной формы (в виде треугольника ИЛИ четырехугольника со сглаженными углами) в 35 глазах. Диск нормальной округлой, слегка вытянутой в вертикальном направлении формы, но уменьшенный в размерах отмечен в 18 глазах.
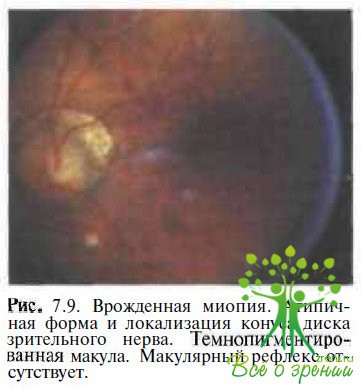
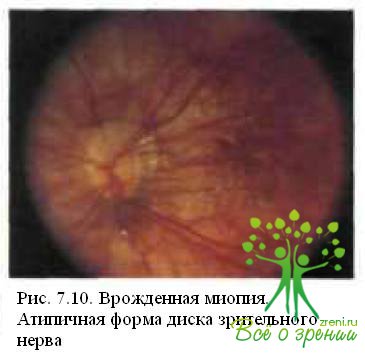
При этом монотонная окраска диска зрительного нерва наблюдалась в 67 (29,1 %) глазах, умеренная его деколорация — в 21 (9,1 %). Изменения макулярной области (см. рис. 7.9 и 7.11) выявлены в 55 (23,9 %) глазах: равномерная усиленная пигментация макулы в 24 (10,4 %), гипоплазия макулярной области в 17 (7,4 %), «паркетное» («гигроидное») дно в 14 (6,1 %).
В то же время при приобретенной миопии только в 6 глазах из 981 (0,6 %) отмечены изменения ДЗН: в виде косо ориентированного овала в 2, в виде вертикального овала в 3, миелиновые волокна в 1. Ни в одном случае эти изменения не сопровождались снижением корригированной остроты зрения.
Наличие конусов у ДЗН также весьма характерно для врожденной миопии: в указанной группе они наблюдались в 96,9 % случаев, отсутствуя только в 7 глазах у 4 детей в возрасте от 7 до 12 лет с миопией средней и высокой степени. Диагноз врожденной миопии во всех случаях основывался на раннем (до 3 лет) ее выявлении и длительном наблюдении в Московском НИИ глазных болезней им. Гельмгольца. Характерно, что максимальная корритированная острота зрения у всех 4 больных была снижена до 0,5—0,6, что подтверждает дифференциально-диагностическое значение этого показателя для врожденной миопии.
Локализация и размеры конусов при врожденной миопии также часто имеют специфические особенности. Обычное для приобретенной близорукости расположение конуса с височной стороны ДЗН при врожденной миопии не является преобладающим. Отмечены круговые (35,2 %), нижние, нижневис очные (16,1 %), назальные (4,3 %) конусы. При этом горизонтально-овальная форма ДЗН сочетается, как правило, с круговыми конусами, а вертикально-овальная — с височными. Округлые и атипичные диски сочетаются со всеми видами конусов.
Характерными для врожденной миопии являются и большие размеры конусов. Так, конусы величиной более У2 ДД отмечены в 46,9 % случаев уз® в детском возрасте, а в 27,4 % глаз всей группы они превышали 1 ДД.
На фоне описанных врожденных изменений у больных с врожденной близорукостью с возрастом и по мере ее прогрессирования часто развиваются приобретенные дистрофические изменения. Их клиническая картина не отличается от картины известных форм ЦХРД и ПВХРД при приобретенной миопии. Для конкретизации диагноза рекомендуется указывать «врожденная миопия с изменениями на глазном дне» для обозначения врожденных изменений и «осложненная центральной и/или периферической хориоретинальной дистрофией» для обозначения дистрофического процесса.
Присущим врожденной миопии признаком является снижение оптимальной корригированной остроты зрения. Э.С. Аветисов (1999) указывал, что причинами этого снижения являются органические изменения в зрительной системе и относительная амблиопия, связанная как с этими изменениями, так и с длительным проецированием на сетчатку неясных изображений.
Другой характерной чертой врожденной миопии является частое (более чем в половине случаев) сочетание с астигматизмом. Чаще наблюдается астигматизм прямого типа, но встречается и обратный, и с косыми осями (оба главных меридиана лежат в секторах от 30 ДО 604 и от 120 до 150° по шкале ТАБО). Величина астигматизма, как правило, превышает 2,0 дптр и может достигать 5,0—6,0 дптр. В последнем случае нередко несовпадение величины общего и роговичного астигматизма, очевидно за счет хрусталикового компонента.
В глазах с врожденной миопией чаще, чем обычно, встречаются изменения формы хрусталика (сферофакия, лентиконус), а также врожденные, частичные или полные катаракты.
Одной из важных особенностей врожденной миопии является отсутствие параллелизма между остротой зрения, с одной стороны, и степенью миопии и картиной глазного дна — с другой. Может наблюдаться низкая острота зрения с коррекцией при относительно невысокой степени миопии и нормальном глазном дне и, наоборот, довольно высокая острота зрения с коррекцией при высоких степенях миопии с типичными врожденными изменениями глазного дна.
При позднем (в 5—6 лет) обнаружении врожденной миопии нередко можно наблюдать одинаковую остроту зрения без коррекции и с оптимальной коррекцией по данным объективной рефрактометрии. При этом некорригированная острота зрения оказывается неожиданно высокой (например, 0,1 при миопии 10,0 дптр с астигматизмом), что свидетельствует об адаптационных механизмах, позволяющих различать изображение в кругах светорассеяния, и в то же время оптимальная корригированная острота зрения при первом обследовании также равна 0,1. Как уже указывалось, это снижение вызвано комплексом органических и функциональных причин. Определить долю влияния каждой из них по офтальмоскопической картине, как правило, не удается. Исключение составляют случаи выраженной тяжелой патологии, например выраженная атрофия, гипоплазия ДЗН, синдром «вьюнка», колобома зрительного нерва или оболочек, аплазия макулы, когда острота зрения с коррекцией не превышает нескольких сотых. Существующие способы дифференциальной диагностики функциональной сохранности зрительного анализатора при врожденной миопии нередко оказываются малоинформативными.
Электрофизиологические показатели у большей части детей с врожденной миопией находятся в пределах нормы. Макулярная электроретинограммы (ЭРГ) у 75 % обследованных бывает нормальной. В ряде случаев наряду с нормальной ЭРГ встречается снижение классических а- и b-волн ЭРГ, ранних рецепторных и осцилляторных потенциалов, что свидетельствует об изменениях в наружных слоях сетчатки.
Ретинальная острота зрения, определенная с помощью гелий-неонового лазера, при врожденной близорукости значительно выше обычной и нередко достигает нормальных значений. Более информативным оказался разработанный В.Э. Аветисовым и соавт. (1992) способ сочетай ной ретинометрии с помощью гелий-неонового (X = 638 нм) и гелийкадмиевого (? — 441,6 нм) лазеров. Этот способ позволяет оценить долю участия органического фактора и определять порог, до которого может повыситься острота зрения в результате лечения.
В последние годы важную роль выявлении амблиопии играет регистрация зрительных вызванных потенциалов (ЗВП), отражающих суммарную биоэлектрическую активность нейронов зрительной проекционной области коры головного мозга и позволяющих оценить пределы разрешения зрительной системы. При врожденной миопии выявлены изменения паттерн-ЗВП, отражающие нарушения пространственной контрастной чувствительности в низкочастотном диапазоне. Эти нарушения при рефракционной амблиопии у больных с высокой врожденной близорукостью носят в основном тот же характер, что и при обскурационной амблиопии.
В то же время даже при перечисленных выше органических изменениях — аномалиях развития зрительного нерва — острота зрения может варьировать в очень широком диапазоне: от нескольких сотых до 1,0. Столь же широко варьируют и ЗВП. Отмечено, что такие колебания остроты зрения, в частности у детей с синдромом косого вхождения ДЗН, во многом зависят от продолжительности зрительной депривации и тяжести рефракционной амблиопии, развивающейся у детей при отсутствии адекватной оптической коррекции.
Статья из книги: Зрительные функции и их коррекция у детей | С.Э. Аветисов, Т.П. Кащенко, А.М. Шамшинова.


Комментариев 0