Врожденная глаукома: современный взгляд на патогенез и лечение

Описание
Врожденная глаукома встречается относительно редко: 1 случай на 10— 20 тыс. новорожденных. В странах Ближнего Востока на 2500 новорожденных приходится 1 случай врожденной глаукомы, что в 4 раза больше, чем в странах Западной Европы. В некоторых странах частота этой патологии выше, возможно, вследствие большого количества близкородственных браков. Отмечено, что консультант-офтальмолог в Великобритании выявляет новый случай врожденной глаукомы каждые 5 лет. Поданным некоторых авторов, среди причин слепоты удельный вес врожденной глаукомы в странах Европы и Северной Америки составляет по 2 %, в Западной Африке и Латинской Америке — 10 %, в Азии — 5 %, в Восточной Африке — 1 %. В нашей стране, по результатам обследования учащихся специализированных школ-интернатов для слепых и слабовидящих детей, врожденная глаукома среди причин слепоты составляет 4,2 %, слабовидения — 2,2 %. Среди всей глазной патологии у детей в школах для слепых и слабовидящих Европы на долю врожденной глаукомы приходится 18 %. В мире всего около 300 тыс. больных врожденной глаукомой, из них 75 % слепые.Таким образом, несмотря на редкость этой патологии, в структуре слепоты врожденная глаукома занимает значительное место.
Разработка методов диагностики и лечения врожденной глаукомы является актуальной проблемой офтальмологии. В литературе имеется значительное число работ, посвященных этиологии, патогенезу, клиническим проявлениям, диагностике и лечению этой патологии.
Врожденную глаукому рассматривают как группу заболеваний, каждое из которых характеризуется своеобразием клинического и патогистологического 320 проявления. На протяжении многих лет разрабатывались различные классификации врожденной глаукомы.
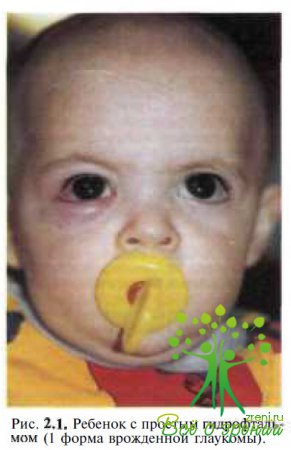
Классификации, основывающиеся на одном признаке, не давала и полного представления ни о характере, ни о динамике патологического процесса. Позже были сделаны попытки разграничить течение врожденной глаукомы по стадиям. Разрабатывались критерии, которые в ходе клинических наблюдений уточнялись и тем самым способствовали улучшению ранней диагностики, выбора тактики и метода лечения и прогноза заболевания. Наибольшее распространение в нашей стране получила классификация, предложенная в 1987 г. Э.С. Аветисовым, Е.И. Ковалевским и А.В Хватовой, обобщающая все предыдущие классификации и наиболее полно отражающая характеристику процесса, более объективно определяющая тяжесть заболевания глаза, прогноз и, следовательно, способствующая совершенствованию хирургической тактики и улучшению результатов лечения. Различают 3 формы врожденной глаукомы: простая врожденная глаукома — собственно гидрофтальм (рис. 2.1), глаукома в сочетании с аномалиями развития глаза и глаукома в сочетании с системной врожденной патологией.
В классификации учитываются происхождение (наследственная и внутриутробная форма), характер изменения угла передней камеры (УПК) (наличие мезодермальной ткани, переднее прикрепление радужки, отсутствие дифференцировки УПК), динамика процесса (стабильная, прогрессирующая). В основу классификации по стадиям положены структурно-анатомические изменения глаза при врожденной глаукоме.
Начальная стадия — глазное яблоко имеет нормальный размер или слегка увеличено, длина сагиттальной оси глаза, и диаметр роговицы превышает возрастную норму не более чем на 2 мм. Имеется легкий отек роговицы; лимб нормальной ширины или расширен до 1 мм. Передняя камера нормальной глубины или слегка глубже, чем в норме. Зрачковые реакции сохранены.
Развитая стадия — длина сагиттальной оси глаза превышает возрастную норму на 3—4 мм, диаметр роговицы — на 3 мм. На роговице складки и разрывы задней пограничной пластинки, расширение лимба до 2 мм, передняя камера углублена, радужка атрофична, зрачок несколько расширен, реакция на свет ослаблена.
Далеко зашедшая стадия — длина сагиттальной оси глаза превышает возрастную норму на 5 мм и более, диаметр роговицы — на 4 мм и более. Разрывы и складки задней пограничной пластинки, расширение лимба более 3 мм, истончение и растяжение склеры. Передняя камера глубокая, радужка атрофичная, зрачок чаще расширен, реакция его на свет вялая.
Почти абсолютная стадия — глазное яблоко резко увеличено (буфтальм), склера растянута, истончена, роговица растянута, с дистрофическими изменениями; имеются стафиломы склеры в области лимба. Передняя камера глубокая, радужка атрофичная, зрачок широкий.
Абсолютная стадия — те же анатомические изменения, что и при почти абсолютной стадии, но зрение отсутствует.
Каждая стадия в свою очередь поделена на группы в соответствии с внутриглазным давлением (ВГД): глаукома с компенсированным и некомпенсированным ВГД. Компенсированной считается глаукома, при которой ВГД не превышает 23 мм рт.ст. в начальной стадии заболевания и 21 мм рт.ст. в более поздних стадиях, некомпенсированной — при ВГД соответственно более 23 мм рт.ст. и более 21 мм рт.ст.
Общепринятым считается, что симптомы врожденной глаукомы второй и третьей форм появляются чаще на втором десятилетии жизни ребенка.
Однако, по нашим данным, у довольно большого числа детей (55,6 %) первые признаки глаукомы возникают в более раннем возрасте (до 6 лет).
Этиология. Известно, что врожденная глаукома может быть наследственной или возникает в результате воздействия на плод различных неблагоприятных факторов. Определенное значение в этиологии врожденных изменений глаза имеют инфекционные заболевания матери во время беременности (грипп, паротит, полиомиелит, токсоплазмоз). Подтверждена роль вируса краснухи и цитомегаловируса в развитии врожденной глаукомы. Воздействие вирусов вызывает мальформации переднего отрезка глаза, что в дальнейшем приводит к развитию глаукоматозного процесса. Помимо инфекционных агентов, большое значение придают алиментарным факторам (гипо- и авитаминозы), эндокринным нарушениям, интоксикациям, внешним физическим и химическим факторам. Высказано предположение о взаимосвязи метаболических нарушений и глаукомы. Имеются сообщения о случае сочетания гидрофтальма с аргининемией — редком врожденном заболевании, вызываемом дефицитом аргиназы, и о наличии врожденной глаукомы у больного с гомоцистинурией.
Идентификация и характеристика соответствующих генов обусловливают новый взгляд на патогенез глаукомы в целом. Ряд работ посвящен генетическим исследованиям при врожденной глаукоме в частности при ювенильной глаукоме. Выявлена зависимость между наследуемой по аутосомно-рецессивному типу врожденной глаукомой у цыган и тяжелым злокачественным типом ее течения.
Описана врожденная глаукома с высоким прикреплением радужки с аутосомно-доминантным типом наследования, проявляющаяся в возрасте от 11 до 20 лет. Подтверждено, что ген, ответственный за развитие ювенильной глаукомы с аутосомно-дйминантным типом наследования, локализуется на определенном участке длинного плеча хромосомы 1.
Одним из направлений научных исследований явилось изучение клинических и генетических особенностей разных форм врожденной глаукомы.
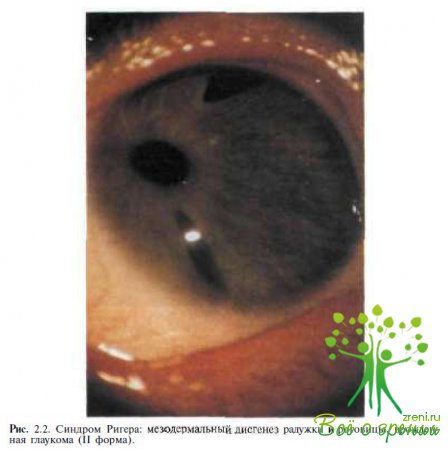
Известно, что при наследственных формах заболевания часто наблюдаются различные аномалии глаза в сочетании с изменениями других органов и систем. В литературе последних лет имеются описания случаев сочетания врожденной глаукомы с другими аномалиями глаза — при синдромах Ригера (рис. 2.2),
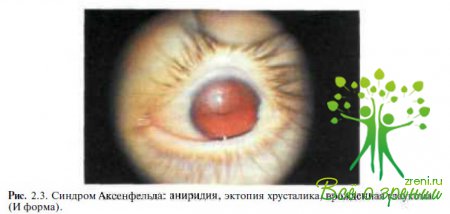
Аксенфельда (рис. 2.3),
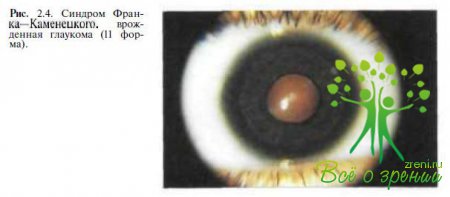
Франка—Каменецкого (рис. 2.4),
аномалии Петерса (рис. 2.5),
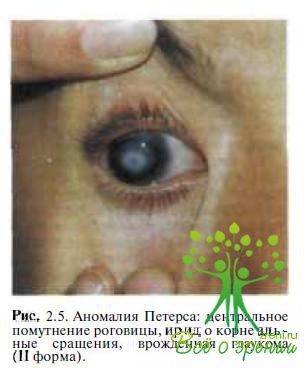
Склерокорнеа. Среди представленных теорий патогенеза этих состояний особое внимание уделено аномалии клеток нервного гребешка в процессе эмбриогенеза. Высказано предположение о том, что аномалия Петерса, синдромы Ригера, Аксенфельда могут быть фенотипическими проявлениями одного гена. Врожденный эктропион радужки является редкой непрогрессирующей аномалией, характеризующейся наличием листка пигментного эпителия радужки на передней ее поверхности, передним прикреплением радужки, дисгенезом дренажной зоны угла передней камеры.
Это одностороннее патологическое изменение редко передается по наследству. Представлены случаи сочетания этой аномалии с врожденной глаукомой. Описано сочетание эктропиона радужки с глаукомой и витреоретинальной дегенерацией. Аномальная миграция клеток нервного гребешка предположительно приводит к недоразвитию структур переднего отрезка глаза, в том числе структур угла передней камеры, а также, возможно, и заднего сегмента глаза. Реже встречается сочетание врожденной микрокории с миопией и глаукомой. На основе выявления статистически достоверной зависимости между микрокорией, миопией и глаукомой высказано предположение об отсутствии случайности в этом сочетании.
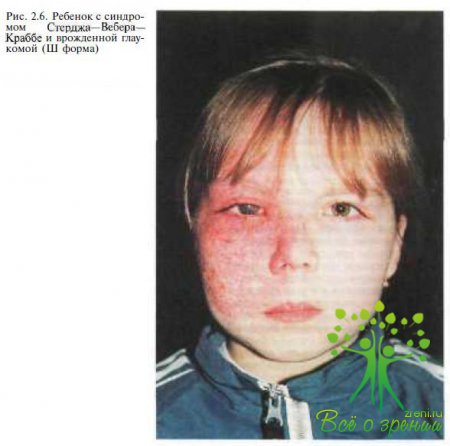
Глаукома может сочетаться с некоторыми факоматозами; чаще это наблюдается при синдроме Стерджа—Вебера—Краббе (рис. 2.6) и болезни Реклингхаузена.
Проведено тщательное исследование таких проявлений синдрома Стерджа—Вебера—Краббе, как гемангиома, глаукома и неврологические нарушения. Частота случаев глаукомы при этом синдроме составила 60 %. Первые признаки глаукомы проявлялись в возрастном диапазоне от рождения до 41 года. В работе A. Foster и С. Gilbert (1992) описаны случаи двустороннего глаукоматозного процесса у больных с синдромом Стерджа—Вебера—Краббе с односторонней капиллярной гемангиомой лица. В связи с этим рекомендовали динамические наблюдение и тщательное обследование обоих глаз. Учитывая редкость этих форм глаукомы, описание их представляет значительный интерес с точки зрения диагностики и выбора тактики лечения.
Врожденная глаукома как проявление синдромных заболеваний других органов и систем выявлена при синдроме Ротмунда—Томсона, характеризующемся инфантильной пойкилодермией, гипогонадизмом, поражен нем скелета, а также при синдроме Ларсена в сочетании с множественным поражением суставов и низким ростом. При синдроме «ЗС» (краниоце-беллокардиальная дисплазия) с аутосомно-рецессивным типом наследования глаукома описана впервые. Впервые врожденная глаукома была диагностирована при синдроме Стиклера, проявляющемся прогрессирующей артропатией, дефектами развития лицевого черепа и неба, нейросенсорной тугоухостью, прогрессирующей миопией, витреоретинальной дегенерацией, отслойкой сетчатки. Описаны редко встречающиеся случаи сочетания врожденной глаукомы и синдрома Рубинштейна—Таейби, проявлениями которого являются эпикантус, патология слезных путей, птоз, страбизм, макрокорнса, микрофтальм, колобомы радужки и диска зрительного нерва, катаракта. При этом гониоскопически выявлено частично высокое прикрепление радужки.
[banner_centerrs] {banner_centerrs} [/banner_centerrs]
Патогенез. В настоящее время большинство авторов считают, что патогенез врожденной глаукомы неоднозначен. В основе этого заболевания лежат врожденные аномалии УПК и дренажной системы глаза, возникающие в результате задержки в развитии и дифференциации этих структур и создающие препятствия оттоку внутриглазной жидкости или в значительной степени затрудняющие его, что приводит к повышению ВГД. При исследовании структур глаза выявлены различные аномалии и изменения, на основании которых предлагались теории механизма развития повышения ВГД при врожденной глаукоме. Наиболее известны следующие теории:
Теория мезодермальных остатков, или мембранная теория, основанная на гониоскопическом обнаружении у больных с гидрофтальмом полупрозрачной мембраны (аномально дифференцированной трабекулы), непроницаемой для водянистой влаги.
Теория расщепления, авторы которой видели причину нарушения оттока в неполном расщеплении УПК и персистирующим спаянии радужки и ресничного тела с трабекулярным переплетом, а также с неправильной дифференцировкой тканей последнего.
Компрессионная теория, объясняющая причину ретенции оттока сдавлением склеральной шпоры и трабекулярного переплета прикрепленной к последнему ресничной мышцей при ее сокращении.
Модифицированная теория мезодермальныхостатков, согласно которой причиной нарушения оттока водянистой влаги является закрытие УПК персистирующей гребенчатой связкой, покрытой со стороны передней камеры ультратонкой мембраной.
Обнаруженные аномалии, препятствующие оттоку влаги, разнообразны и встречаются в разных сочетаниях: сохранение остатков и эмбриональной ткани в бухте УПК, переднее прикрепление корня радужки, чрезмерное развитие гребенчатой связки, заднее положение венозного синуса склеры, его сужение и атрезия, патологическое включение волокон цилиарной мышцы в трабекулу, недоразвитие трабекулы, снижение трабекулярной проницаемости. Задержка в развитии и дифференцировке УПК получила название гониодисгенеза.
Э.Г. Сидоров и М,Г. Мирзаянц (1991) при морфологическом исследовании блоков тканей, удаленных при трабекулэктомии, выявили основные аномалии развития УПК и на основании этого разработали классификацию врожденной глаукомы с выделением 3 степеней гониодисгенеза. Существенными признаками гониодисгенеза I степени являлись широкое прикрепление пучков ресничной мышцы к гипопластичному трабекулярному переплету, относительная сохранность склерального синуса. Гониодисгенез II степени характеризовался выраженным трабекулодисгенезом, сочетающимся с передним прикреплением радужки, нарушением топографии синуса и частым его сужением. При гониодисгенезе III степени отмечена тяжелая врожденная патология всех элементов дренажной зоны: переднее прикрепление радужки к измененной трабекуле, резкое сужение склерального синуса.
В последние годы продолжаются гистологические исследования глаза с целью изучения механизмов развитая врожденной глаукомы. Для изучения патоморфологии дренажной зоны глаза при глаукоме применяли сканирующую электронную микроскопию (световую и трансмиссионную). С помощью этой методики изучали трабекулярные блоки, полученные во время трабекулэктомии, и описали выявленные аномалии, включающие недоразвитие трабекулярной сети, избыток коллагеновых фибрилл в трабекулярном матриксе, мезенхимальную ткань в УПК. Интересными представляются исследования М.Р. Clarke и соавт. (1991) с использованием зеркальной микроскопии роговицы, в результате которых выявили уменьшение количества клеток и их полиморфизм в глазах с врожденной глаукомой, чем объяснили развитие декомпенсации роговицы в ответ на подъемы ВГД.
Авторы выделяют глаукому молодого возраста как собирательное понятие, включающее ряд нозологических форм, манифестирующих обычно во втором и третьем десятилетиях жизни, и подразделяют ее на открыто- и закрытоугольную. При световой и электронной микроскопии биоптатов дренажной зоны у молодых пациентов с открытоугольной глаукомой в области наружной стенки венозного синуса склеры выявлен пласт компактной ткани, представленной клетками с тонкими отростками и внеклеточным веществом с аномальным накоплением в ней основных веществ. Возможно, эта компактная ткань свидетельствует о недоразвитии трабекулы у таких пациентов, что в дальнейшем и вызывает повышение ВГД при рано развившейся глаукоме.
Некоторые авторы отмечают, что выявленные наряду с врожденной незрелостью дистрофические изменения в дренажной зоне аналогичны таковым у пожилых людей и характеризуются дезорганизацией соединительной ткани, включающей все виды диспротеинозов. Сделан вывод о том, что при юношеской глаукоме имеют место аномальное развитие трабекулярной системы в виде незрелости коллагеновых структур и гониодисгенеза и явления дистрофии и дезорганизации коллагена. Возможность отклонений в системе соединительной ткани у таких больных находит подтверждение в частом сочетании глаукомы молодого возраста с миопией. Ряд исследователей отмечают, что биохимические сдвиги являются ранними проявлениями дезорганизации соединительной ткани и чаще всего предшествуют изменениям морфологических структур. Обнаружено резкое нарушение метаболизма соединительной ткани у молодых больных: содержание оксипролина в крови и моче, а также серомукоида и гексозаминов в сыворотке крови достоверно выше аналогичных показателей у здоровых людей. Авторы расценивают патологию соединительной ткани как одно из звеньев патогенеза глаукоматозного процесса. Биохимическим исследованиям при гидрофтальме посвящены единичные работы.
При исследовании антипротеолити- ческой активности водянистой влаги у больных с врожденной глаукомой установлена повышенная антитриптическая активность, что может свидетельствовать о роли протеолиза и ингибиторов в развитии патологического процесса в глазу.
Работ, посвященных иммунологическим исследованиям при врожденной глаукоме, в доступной нам отечественной и зарубежной литературе за последние 20 лет не встретилось. Учитывая, что во многих работах, касающихся первичной глаукомы, обсуждаются иммунологические аспекты этой проблемы, проведение иммунологических исследований при врожденной глаукоме явилось интересным и перспективным.
В рамках этой проблемы проведена работа по изучению иммунного статуса у детей, анализа взаимосвязей между клиническими параметрами глаукомы (форма, стадия, степень компенсации), исходом хирургических вмешательств, послеоперационными осложнениями и иммунологическими показателями.
Обследовано 97 детей в возрасте от 1 мес до 14 лет с разными формами, стадиями, степенью компенсации и результатами оперативного лечения врожденной глаукомы. Иммунологическое обследование детей включало определение уровня иммуноглобулинов (lg) классов О, А и М в сыворотке крови и слезной жидкости методов радиальной иммунодиффузии Манчини, выявление аутоантител к ДНК (нативной и денатурированной) и общему белку миелина (ОБМ) в сыворотке крови и слезной жидкости с помощью метода иммуноферментного анализа (ИФА). При изучении иммунного статуса у детей с врожденной глаукомой выявлены следующие особенности. Клинические признаки иммунной недостаточности выявлены у 62,9 % детей в основном в виде инфекционного синдрома, изолированного или в сочетании с аллергическим и аутоиммунным синдромами (у 60,6 %).
У 36 % обследованных выявлен гуморальный иммунодефицит, обусловленный преимущественно дефицитом lgA, из них у 30 % селективным или сочетанным. Для оценки клинической значимости гаммапатий в патогенезе, течении врожденной глаукомы и развитии послеоперационных осложнений проведен анализ соотношения клинических параметров и показателей гуморального иммунитета.
Установлено, что некомпенсированная глаукома чаще (49 %) встречалась у детей с дефицитом lgA; ранние и поздние послеоперационные осложнения (гифема, отслойка сосудистой оболочки, гемофтальм в ранние сроки и рецидив подъема ВГД в отдаленные сроки после операции) также значительно чаще (48 %) выявлялись у детей с селективным или сочетанным дефицитом lgA. При изучении локального иммунного ответа низкое содержание lgА выявлено в 73,7 % глаз, дефицит в обоих глазах — у 50,9 % детей. При опенке клинической значимости выявленной местной иммунной недостаточности определяли взаимосвязь между дефицитом lgА и некомпенсированностью глаукомы, исходом оперативного лечения. Отмечено, что полное отсутствие lgA достоверно чаще встречалось у детей с некомпенсированным ВГД (61 %), послеоперационными осложнениями (79 %) и неэффективностью хирургического вмешательства, обусловившей повторные операции (87 %). Динамические наблюдения показали, что благоприятное течение послеоперационного периода сопровождалось повышением концентраций в слезной жидкости у 100 % детей; снижение этого показателя отмечалось у детей с осложнениями (83,3 %).
Анализ полученных данных позволяет расценивать гуморальный иммунодефицит как фактор, отягощающий течение глаукомы. Иммунодефинитное состояние предрасполагает к более тяжелому течению патологических процессов: в частности, антиглаукоматозная операция, произведенная на фоне общего дефицита lgА, сопряжена с риском развития послеоперационных осложнений как в ранние сроки, так и в отдаленном периоде. У детей с врожденной глаукомой выявлены иммунопатологические реакции в виде наличия аутоантител (ААТ) к ДНК и ОБМ в сыворотке крови и слезной жидкости.
Наличие ААТ к ДНК в сыворотке крови и слезной жидкости обнаружено у 26 (29,9 %) детей, только в слезной жидкости — у 20 (23 %) детей в 25 (16,6 %) глаз.
Установлены статистически достоверные корреляционные связи между наличием ААТ к ДНК и тяжестью течения глаукомы, электрофизиологическими изменениями офтальмоскопической картиной диска зрительного нерва (серый/белый цвет диска, субтотальная, тотальная экскавация). Установлено также, что среди детей с наличием ААТ к ДНК достоверно чаше (44,4 %) встречались дети с повторными операциями в анамнезе (3 операции и более). Послеоперационные осложнения в виде отслойки сосудистой оболочки, гифемы, гемофтальма, иридокорнеальных спаек, рубцевания зоны фистулы и фильтрационной подушечки чаще (33,3 %) наблюдались у детей с наличием ААТ к ДНК.
В связи с тем, что при глаукоме в значительной степени страдает зрительный нерв, изучены аутоиммунные реакции с выработкой ААТ к ОБМ в сопоставлении с отдельными клинико-функциональными показателями. Состояние зрительного нерва оценивали по остроте зрения, офтальмоскопической картине, данным электрофизиологического исследования, включающего общую электроретинографию, ритмическую электроретинографию и регистрацию зрительных вызванных потенциалов (ЗВП) в ответ на вспышку (вЗВП) и на паттерны (пЗВП).
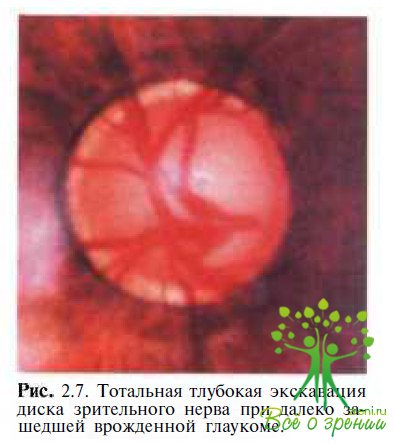
Результаты исследования показали наличие ААТ к ОБМ в сыворотке крови и слезной жидкости у 22 (31,8 % детей. Очень важно, что ААТ к ОБМ обнаруживались у детей без какой- либо обшей неврологической симптоматики. Сопоставление отдельных клинико-функциональных показателей с наличием ААТ к ОБМ выявило определенные зависимости. Анализ показал, что среди детей с обнаруженными ААТ к ОБМ слепота и слабовидение (острота зрения от 0 до 0,05) отмечались достоверно чаще, чем у детей с отсутствием ААТ к ОБМ (соответственно 81,8 и 23,7 %). У детей с наличием ААТ к ОБМ также чаще наблюдалась выраженная глаукоматозная экскавация: тотальная (рис. 2.7), субтотальная + серый/белый цвет диска зрительного нерва (соответственно "81,8 и 42,1 % глаз).
Выполнение электроретинографии по стандартной методике позволило установить патологические изменения у детей с выявленными ААТ к ОБМ достоверно чаще, чем у детей, не имевших ААТ к ОБМ (соответственно 78,9 и 27,6 % глаз).
Таким образом, полученные данные свидетельствуют о том, что у детей с врожденной глаукомой развиваются аутоиммунные реакции с выработкой ААТ к ОБМ даже при отсутствии клинических проявлений какой-либо неврологической Симптоматики, что позволяет считать наличие ААТ к ОБМ проявлением местного иммунного конфликта с элементами системности в отдельных случаях. При обследовании 87 матерей детей с врожденной глаукомой у 59,8 % обнаружены клинические признаки иммунной недостаточности в виде хронических и острых заболеваний верхних дыхательных путей (15 %), патологии почек (11,5 %), заболеваний сердца (7 %), бронхолегочной патологии (7 %).
При исследовании гуморального статуса матерей у 32,6 % обследованных выявлены изменения в виде дефицита изолированного или сочетанного (15,2%) и повышение уровня М (17,4 %). При этом иммунологическая картина у матерей совпадала с показателями 1 % удетей. Отмечено, что у матерей с пиелонефритом и анемиями дети достоверно чаше имели ААТ к ДНК.
Таким образом, патология у матерей в виде нарушения гуморального иммунитета, хронических и острых заболеваний является фактором риска развития иммунопатологических реакций у детей с врожденной глаукомой.
В результате проведенных исследований мы можем говорить о том, что дети с врожденной глаукомой иммуно-компрометированы. Главным образом врожденная глаукома определяется у детей с нарушениями в иммунной системе, которые выражаются общесоматической и клинической симптоматикой, гуморальным иммунодефицитом, развитием аутоиммунных реакций с выработкой ААТ к ДНК и ОБМ. Определены корреляционные взаимосвязи между клиническими и иммунологическими показателями.
Отмечено, что у детей с нарушениями иммунного статуса глаукома протекает тяжелее: достоверно чаще с осложнениями раннего и позднего послеоперационного периода, неэффективностью хирургических вмешательств (3 и более повторных операций за 3—5 лет).
Иммунопатологические реакции более выражены в глазу с худшим состоянием зрительного нерва и сетчатки. У таких детей глаукома чаще приводит к слепоте. Мы не можем судить с полной определенностью о причинно-следственной связи между ААТ, в частности к ОБМ, и изменениями зрительного нерва при глаукоме. Вместе с тем выявленные нами взаимосвязи между наличием ААТ и низкой остротой (фактически потерей) зрения, выраженной глаукоматозной экскавацией (признак потенциальной дистрофии волокон зрительного нерва), а также вовлечение в глаукоматозный процесс сетчатки позволяют рассматривать ААТ к ОБМ как фактор, отягощающий течение и прогноз врожденной глаукомы.
Наличие у матерей хронических заболеваний, осложняющих беременность, и иммунологической картины, идентичной иммунологическим показателям у ребенка, подтверждает существующий взгляд на врожденную глаукому как генетически обусловленную патологию. Выявленные нарушения иммунного статуса требуют внесения корректив в схемы лечения детей с врожденной глаукомой, в частности в тактику предоперационной подготовки и ведения послеоперационного периода.
Клиническое течение и диагностика. Врожденная глаукома характеризуется своеобразными клиническими проявлениями, обусловленными возрастными особенностями глаз у детей. При повышении ВГД у детей в связи с эластичностью тканей происходит растяжение оболочек глаза. Начальные симптомы заболевания связаны с изменениями в роговице. Увеличивается ее диаметр, на эндотелии и задней пограничной пластинке образуются разрывы и трещины, из-за нарушения барьерной функции в строму проникает внутриглазная жидкость, нарушаются метаболические процессы, что определяет возникновение отека, а затем и помутнение роговицы. Растягивается и истончается склера, приобретая голубоватый оттенок, увеличивается лимб.
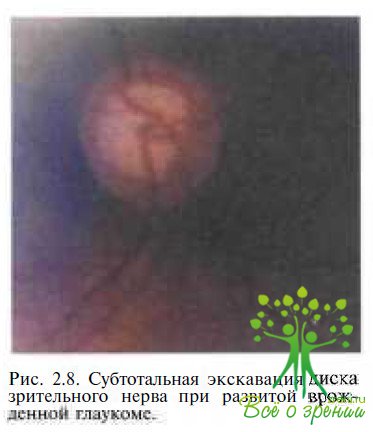
Одновременно с увеличением диаметра и кривизны роговицы углубляется передняя камера глаза. По мере развития заболевания нарастают дистрофические процессы в радужке, зрачок становится вялым, возникает мидриаз. Хрусталик уплощается из-за натяжения ресничного пояска и смещается. В дальнейшем могут возникать подвывихи и вывихи хрусталика, иридодонез. Стекловидное тело чаще всего прозрачно и только в самых поздних стадиях возникают выраженные деструктивные изменения. При растяжении оболочек первый гидравлический удар принимают на себя сетчатка и хороидея, нарушается гемодинамика, сетчатка истончается, возникают морфологические изменения во всех ее слоях. За счет компенсаторного растяжения глаза воздействие повышенного ВГД на зрительный нерв частично нивелируется, но, несмотря на это, экскавация зрительного нерва возникает уже в ранние сроки (рис. 2.8).
При стойкой компенсации ВГД экскавация диска зрительного нерва может уменьшиться или полностью исчезнуть.
Диагноз врожденной глаукомы ставят на основании данных анамнеза и результатов клинического обследования, которое включает наружный осмотр, биометрию глаза (кератометрия, лимбомстрия, эхография), биомикроскопию, офтальмоскопию, гониоскопию, тонометрию, тонографию, скиаскопию, визометрию, периметрию и электрофизиологические методы исследования.
В постановке диагноза врожденной глаукомы огромная роль принадлежит инструментальным методам исследования. Интересны работы, посвященные методике ультразвуковой компыотерной биомикроскопии, позволяющей получать четкое изображение структур переднего отрезка глаза (особенно важным это представляется при помутнении роговицы), УПК, а также определятъ размеры дренажной зоны, в частности трабекулы. Прибор, на котором проводили исследования, обладает высокой разрешающей способностью. Этот метод позволил выявить у больных с синдромом Стерджа—Вебера—Краббе расширение интрасклеральных сосудов и жидкость в супрацилиарном пространстве, которые явились признаками высокого давления в эписклеральных венах, вызванного повышенным ВГД.
Сравнивают несколько вариантов компьютерной периметрии с целью выявления наиболее эффективной и удобной для обследования детей. Большое значение придают гониоскопическим исследованиям. Методика позволяет выявить уровень ретенции, степень дисгенеза и определить патогенетически ориентированную тактику лечения. Известные работы Т.И. Брошевского, A.B. Хватовой, М.М. Краснова, ДА. Магарамова, В.И. Лакомкина, О. Barkan, J. Woist, посвященные этим исследованиям, относятся к более раннему периоду. Авторы выявили аномальное развитие или недоразвитие всех структур дренажной зоны, характеризующееся передним прикреплением радужки, отсутствием дифференцировки трабекулы, наличием эмбриональной мезодермальной ткани, которые препятствуют оттоку внутриглазной жидкости и затрудняют его. Исследуя с помощью гониоскопии глаза с врожденной глаукомой, Н.С. Agaival и соавт. (1994) подтвердили наличие при этой патологии высокого прикрепления радужки, трабекулодисгенеза и эмбриональной ткани в УПК.
Особое значение для диагностики имеет адекватная оценка функционального состояния органа зрения, которая затруднена у маленьких детей. Именно поэтому предложенные классификации врожденной глаукомы у детей основаны на показателях структурно-анатомических изменений глаза, характерных для этого заболевания (сдвиг возрастных биометрических норм, происходящих под влиянием повышенного ВГД на разных стадиях заболевания). В каждой из групп, сформированных по структурно-анатомическим признакам, отмечена значительная вариабельность функциональных показателей, которые меняются по мере развития и роста ребенка. Применение большинства методов исследования зрительных функций в детской практике, особенно у детей раннего и младшего возраста, затруднительно, а часто и невозможно, поскольку требует словесного ответа. В связи с этим при исследовании органа зрения у детей особое значение приобретают объективные электрофизиологические методы.
Электрофизиологические исследования позволяют на каждой стадии болезни более тонко охарактеризовать степень и, поражения сетчатки и зрительного нерва, а также могут служить критерием для оценки компенсации и прогнозирования глаукоматозного процесса. Выявлено поградиентное снижение биоэлектрической активности наружных и внутренних слоев сетчатки по мере прогрессирования глаукоматозного процесса у детей, что отражается на снижении частотных и амплитудных характеристик общей электроретинограммы — ЭРГ. Л.И. Фильчикова и соавт. (1988, 1992) изучили характер изменения амплитуды пЗВП при разных стадиях болезни и показали, что в ранние сроки вначале страдают толстые аксоны ганглиозных клеток, что выражается в снижении кортикального ответа на крупные стимулы, а затем при вовлечении в патологический процесс X- ганглиозных клеток уменьшается амплитуда пЗВП и в ответ на меньшие стимулы. Особое значение это имеет для оценки функционального состояния органа зрения у детей после антиглаукоматозной операции.
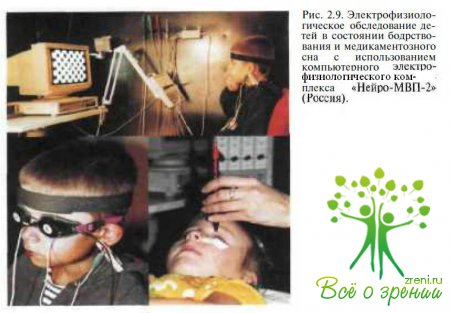
Для объективной оценки функционального состояния сетчатки и зрительного пути у детей с врожденной глаукомой используют электрофизиологические методики (рис. 2.9):
общую электроретинографию, ритмическую электроретинографию, вЗВП и пЗВП. При этом применяют компьютерную систему, позволяющую выделять из шума потенциалы малой величины, использовать усреднение и нивелировать различные артефакты.
В качестве активных электродов при регистрации ЭРГ используют серебряные элекгроды в виде крючков, которые фиксируют на нижнем веке пациента. Электроды накладывают на фоне местной анестезии (двукратная инсталляция проксилитакаина или 1 % раствора дикаина), поверхность роговицы защищают ионопроводяшим 0,5 % раствором метилиеллюлозы. Референтный электрод крепят на сосцевидном отростке или на мочке уха, заземляющий — на лбу или на противоположной мочке уха. При наложении электрода кожу предварительно очищают и наносят электропроводящую пасту; при этом электрическое сопротивление не должно превышать 10 кОм. Длина волны стимулирующего света должна быть в пределах видимого спектра.
Фотостимулятор располагают на расстоянии 30 см от глаза; энергия лампы должна составлять 0,3 Дж, длительность вспышки — 50 МКС с частотой от 0,2 до 2,0 Гц. Для регистрации палочкового ответа применяют темноватую адаптацию в течение не менее 20 мин. Для подавления функции палочковой системы и выделения колбочковой используется фоновое освещение 27—34 кд/м2. Электронная регистрирующая система должна состоять из усилителя и пред- усилителя с фильтрами 0,3—300 Гц; для усреднения используют не менее 20—50 реакций.
Для записи ритмической ЭРГ, как при обшей ЭРГ, используют метод наложения отводящих электродов. Ритмический ответ на вспышку (белого или красного света, частота 30 Гц) регистрируется при фоновом освещении, подавляющем палочковую активность (27—34 кд/м2); для усреднения используют не менее 64—100 реакций.
При анализе ЭРГ оценивают негативную а-волну и позитивную b-волну. Амплитуду а-волны измеряют от изолинии до ее пика, амплитуду b-волны — от пика а-волны до пика Ь-волны. Латентность а-волны вычисляют от начала светового стимула до пика а-волны, латентность Ь-волны — от начала светового импульса до пика Ь-волны.
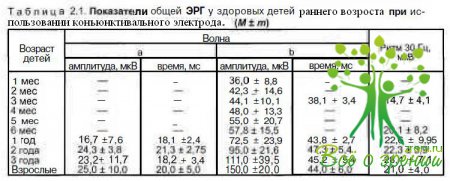
Оценивая результаты исследования, необходимо учитывать возрастные нормы ЭРГ. В табл. 2.1 приведены результаты обследования на компьютерном электрофизиологическом комплексе «Нейро-МВП-2» (Россия) на базе IBM PC с монитором VGA с использованием оригинальной программы, написанной в среде DOS и Windows на языке Паскаль (регистрационный номер 98/219-1998).
Исследование проводят как во время бодрствования ребенка, так и в состоянии медикаментозного сна. Ребенок должен быть спокоен и фиксировать взгляд на предъявляемых стимулах. Контроль за фиксацией взгляда осуществляет лаборант. При регистрации ЗВП активный электрод (карбоновые чашечки) помещают на 1,5— 2 см выше затылочного бугра по средней линии над областью проекции зрительной зоны. Для лучшего контакта используют электропроводный гель с предварительной обработкой кожи абразивной пастой. Индифферентный электрод помещают на мочке уха, заземляющий электрод — на противоположной мочке уха или на фронтальной части скальпа. В качестве стимулов для регистрации вЗВП используют одиночные вспышки белого света частотой 0,5 Гц с расстояния 30 см; энергия лампы должна составлять 0,3 Дж. Для записи пЗВП используют шахматные реверсивные паттерны, предъявляемые с экрана монитора, находящегося на расстоянии 1 м от глаз обследуемого. Размер ячеек 7', 12', 20', 40', 60' и 100', освещенность 90 л к, уровень контраста 80 %.
Стимулы предъявляют монокулярно, усреднение составляет 64—100 ответных реакций. Анализ ЗВП начинают с идентификации компонентов: наиболее вариабельного N75 при регистрации пЗВП или N1 при регистрации вЗВП и наиболее устойчивого компонента Р100 (пЗВП) или Р2 (вЗВП). При анализе ЗВП учитывают конфигурацию компонентов, их амплитуду в микровольтах, которую вычисляют от изолинии или от предыдущего пика противоположной полярности (от пика до пика) и пиковую латентность — время в миллисекундах от момента предъявления стимула до пика Р100.
При интерпретации данных, полученных при регистрации ЗВП, также необходимо учитывать возрастной фактор. Впервые месяцы жизни ребенка параметрические характеристики вЗВП быстро меняют свои характеристики, достигая к 6 мес показателей у взрослых.
При обследовании на компьютерном электрофизиологическом комплексе «Нейро-МВП-2» (Россия) латентность компонента Р1 при регистрации вЗВП у здоровых детей в возрасте 1 мес составляла 194,9 ±11,3 мс, 2 мес - 171,3 ±29,3 мс, 3 мес - 129,6 ± 35,8 мс, 4 мес - 103,7 ± + 12,0 мс, 5 мес - 93,2 ±4,1 мс, 6 мес - 90,4 + 8,3 мс.
Чувствительность к структурированным элементам при регистрации пЗВП меняется следующим образом: в первые 1—2 мес регистрируется ответ только на шахматные паттерны с большим размером ячеек (100—60'), К 6 мес постепенно появляется ответ на ячейки размером от 40 до При этом латентность компонента РЮО пЗВП (размер ячейки 100') у здоровых детей в возрасте 1 мес составляла 229,1 ± ± 22,6 мс, 2 мес — 203,8 ± 44,7 мс,3 мес — 145,2 + 31,8 мс, 4 мес — 138,7 ±21,4 мс, 5 мес- 109,4±5,8мс, 6 мес - 105,7 ±4,4 мс.
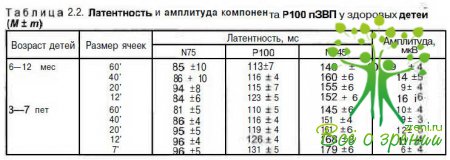
Показатели для более старших детей приведены в табл. 2.2.
Электроретинография. Во всех стадиях врожденной глаукомы, кроме абсолютной, у больных, обследованных в сроки не более 2 мес в ранних и не более 1 мес в поздних стадиях болезни, регистрируется увеличение амплитуды Ь-волны по сравнению с возрастной нормой. Значение Ь-волны в начальной стадии заболевания превышают норму на 30—40 %, в развитой — на 40—60 %, в далеко зашедшей — на 50—70 %, в почти абсолютной — на 60—80 %. Амплитуда ритмической ЭРГ в начальной стадии болезни превышает верхнюю границу возрастной нормы на 10—20 %, в почти абсолютной стадии - на 40-50 %. Если имеется длительный период повышения ВГД, то показатели ЭРГ и ритмической ЭРГ уменьшаются, поскольку период повышенного электрогенеза сетчатки заканчивается и наступает фаза процесса, при которой биоэлектрическая активность нейрональных структур сетчатки снижается.
После хирургической нормализации ВГД в 1-ю неделю после операции амплитуда Ь-волны резко уменьшается: на 10—30 % ниже возрастной нормы в начальной стадии и на 70—90 % в почти абсолютной. При стабильно компенсированном ВГД амплитудные характеристики ЭРГ и ритмической ЭРГ в начальной стадии болезни восстанавливаются в течение 1 года до растных норм; в развитой стадии амплитуда В-волны ЭРГ остается ниже возрастной нормы на 10—40 %, в далеко зашедшей — на 20— 50 %, Восстановление показателей в этих стадиях болезни протекает более длительно, особенно у детей, оперированных в поздние сроки.
Амплитуда ритмической ЭРГ имеет корреляцию с показателями ЭРГ и уменьшается от 10 % в развитой до 50 % в почти абсолютной стадии.
В почти абсолютной стадии величина позитивного компонента b-волны только частично восстанавливается, оставаясь на 30—50 % ниже возрастной нормы.
В абсолютной стадии врожденной глаукомы амплитуда Ь-волны ЭРГ не превышает мкВ ритм, а РЭРГ — 5 мкВ независимо от офтальмотонуса. В этой группе детей не выявлено увеличения амплитудных характеристик ЭРГ и ритмической ЭРГ, видимо, из-за скоротечности процесса и обследования в поздние сроки заболевания.
Анализ результатов, полученных после обследования детей с разными стадиями заболевания в динамике, показал, что под воздействием повышенного ВГД сетчатка проходит несколько стадий нейрональной активности.
Зрительные вызванные потенциалы. У детей с начальной стадией врожденной глаукомы имеются изменения как амплитуды, так и латентность позитивного компонента Р100 пЗВП и вЗВП.
В начальной стадии заболевания выявляются более выраженные изменении пЗВП в частности в ответ на паттерны больших размеров (60 и 100'); латентность компонента Р100 увеличивается на 10—30 мс. Максимальные отклонения от нормальных значений регистрируются при обследовании детей со значительным периодом некомпенсированного ВГД. При обследовании на вЗВП латентность чаще находится в пределах возрастной нормы или на ее верхней границе. Экскавация диска зрительного нерва у этих детей отсутствует. После оперативного лечения и стабильной компенсации ВГД показатели ЗВП в течение I гада восстанавливаются до нормальных значений.
При обследовании детей с развитой стадией болезни выявлены более выраженные изменения латентности компонента РЮО. Экскавация диска зрительного нерва в этой группе составляет Э/Д = 0,2—0,5. Увеличение латентности РЮО в этой стадии болезни на паттерны 100' составляет 15— 40 мс, 20' — 10—30 мс. При регистрации вЗВП отмечают менее выражен- Н1« отклонения от нормы, и увеличение латентности не превышает 10— 30 мс. После стабильной нормализации ВГД глаукоматозная экскавация уплощается и в ряде случаев исчезает. На этом фоне происходит восстановление показателей ЗВП, и латентность в ряде случаев достигает нижней границы нормы.
Далеко зашедшая стадия врожденной глаукомы характеризуется значительным разбросом показателей; определенное значение имеют сроки выявления заболевания и разный уровень ВГД. Экскавация диска зрительного нерва в этой стадии заболевания составляет Э/Д =0,5—0,9. Увеличение латентности компонента РЮО в этой группе больных в ответ на шахматные паттерны 100' и 60' составляет 30— 70 мс, на 20' — 20—70 мс.
Латентность вЗВП возрастает с 20 до 70 мс. Эти показатели коррелируют со сроками выявления заболевания, и при повышенном в течение длительного времени ВГД латентность имеет максимальное отклонение от нормы. Если в послеоперационном периоде ВГД стабильно компенсировано, то у 40—46 % детей показатели пЗВП и вЗВП достигают нижней границы возрастной нормы. Это характерно для больных, оперированных в ранние сроки и имеющих стабильное послеоперационное течение заболевания без подъемов ВГД. В 30—34 % случаев латентность пЗВП остается увеличенной на 20—50 мс, а вЗВП - на 13-42 мс. У 20-30 % детей, имеющих повышенное в течение длительного времени ВГД, в послеоперационном периоде латентность остается значительно увеличенной.
В почти абсолютной и абсолютной стадиях болезни экскавация диска зрительного нерва у детей с врожденной глаукомой тотальная или субтотальная. Биоэлектрического ответа на стимуляцию реверсивными шахматными паттернами у этой группы больных не регистрируется.
Стимуляция вспышками света в ряде случаев выявляет появление позитивного компонента сниженной амплитуды при латентности 170-180 мс, что значительно превышает норму и свидетельствует о нарушении проведения по зрительному пути. В послеоперационном периоде при нормализации ВГД амплитудно-временные показатели вЗВП у этих больных не восстанавливаются.
Таким образом, у детей с врожденной глаукомой в период повышения ВГД и растяжения оболочек глаза вначале происходит повышение биоэлектрической активности ретинальных нейронов, которое потом сменяется снижением их активности. Субнормальные значения показателей ЭРГ при врожденной глаукоме свидетельствуют о наступлении фазы угасания агсектрогенеза сетчатки, что является неблагоприятным прогностическим признаком. Отсутствие повышения биоэлектрической активности сетчатки в послеоперационном периоде, особенно на ранних стадиях заболевания, может свидетельствовать о неполной компенсации ВГД, требующей медикаментозной или повторной оперативной коррекции. С каждой последующей стадией болезни электрогенез сетчатки снижается, и в каждой стадии разброс значений прямо пропорционален срокам выявления и своевременности стабилизации глаукоматозного процесса. Уровень увеличения латентности пЗВП и вЗВП коррелирует со стадией заболевания и продолжительностью периода некомпенсированного ВГД. Наиболее чувствительным методом на ранних стадиях болезни является регистрация ЗВП в ответ на крупные структурированные стимулы, которые преимущественно отражают состояние толстых аксонов ганглиозных клеток сетчатки. В развитой и далеко зашедшей стадиях наравне со структурированными стимулами диагностически значимыми становятся показатели вЗВП. Стабилизация и восстановление показателей ЗВП в послеоперационном периоде свидетельствуют о стойкой компенсации глаукоматозного процесса.
Комплексная оценка органа зрения у ребенка с применением электрофизиологических методов исследования позволяет с большей точностью диагностировать врожденную глаукому в ранние сроки, прогнозировать функциональные результаты, использовать данные электрофизиологических исследований для контроля компенсации глаукоматозного процесса и мониторинга течения заболевания у детей в послеоперационном периоде.
Лечение. Известно, что лечение при врожденной глаукоме в основном оперативное. Только хирургическими методами возможно устранить препятствия оттоку внутриглазной жидкости, создаваемые различными структурными аномалиями дренажной зоны. В течение многих лет, начиная с 1938 г., широко применяли гониотомию — патогенетически ориентированную операцию, направленную на устранение эмбриональной мезенхимальной ткани в углу передней камеры. Однако в связи с тем, что в глазах с врожденной глаукомой, кроме эмбриональной ткани, выявляли недоразвитие всех структур дренажной зоны, показания к гониотомии сузились, круг операций значительно расширился.
В последние годы активно обсуждаются различные методики оперативного лечения при врожденных глаукомах, основными из которых являются трабекулотомия, трабекулэктомия, комбинированная методика (трабекулотомия + трабекулэктомия), гониотомия. В некоторых случаях гониотомия оказывается эффективной и дает хорошие результаты. По данным отдела патологии глаз у детей Московского НИИ глазных болезней им. Гельмгольца, в отдаленные сроки после гониотомии с гониопунктурой компенсация ВГД была достигнута у 89,9 % оперированных. В ряде клиник эта операция широко используется, однако выполнение гониотомии осложняет наличие помутнения роговицы при врожденной глаукоме. Трабекулотомия ab externo не требует прозрачности роговицы, поэтому некоторые авторы высказываются в поддержку этого вмешательства. По их данным, процент эффективности трабекулотомии за период наблюдения 15 мес составил от 73,9 до 86,4. Получены разные результаты, высказываются разные мнения относительно комбинированной операции. Отдельные авторы достигли положительных результатов в 86,2 % случаев при периоде наблюдения от 6 мес до 2 лет и считают эту методику операцией выбора.
Некоторые исследователи отмечают, что результаты комбинированной операции и обычной трабекулэктомии примерно одинаковы: 93,5 % при периоде наблюдения 2 года. Замечено, что результаты, полученные в специализированных центрах детской офтальмохирургии, лучше, чем в клиниках общего профиля. При анализе результатов оперативного лечения врожденных глауком в арабских регионах за 5 лет выявлены невысокие результаты в клиниках общего профиля: положительный эффект гониотомии составлял 20 %, трабекулотомии — 35 %, трабекулэктомии — 55 %. В настоящее время наиболее предпочитаемой операцией является трабекулэктомия, предложенная в 1968 г. Cairns и в дальнейшем модифицированная рядом авторов. М.Е. Turach и соавт. (1995) отметили положительный эффект трабекулэктомии в короткие сроки наблюдения у 84 % оперированных, в отдаленные сроки — у 76 %. Гипотензивный эффект операции, по данным A.B. Хватовой и СО. Буткевич (1994), в раннем послеоперационном периоде составил 97,5 %, в отдаленные сроки — 83,3 %.
Некоторые авторы, считающие трабекулэктомию операцией выбора, представляют иные данные: за 5-летний период наблюдения процент успеха у больных с гидрофтальмом составил 92,3, у больных с сочетанной с глаукомой патологией органа зрения и других органов и систем — 85,7. Разработаны различные модификации операций трабекулэктомии и трабекулотомии. Единичные работы посвящены использованию дренажей, способствующих повышению эффективности оперативного лечения при глаукоме.
Применение дренажа из гидрофильного гидрогеля позволило достигнуть стабильной нормализации давления у 70 % детей. Представлены работы по использованию клапанных дренажей Ahmed, Molteno у детей с разными формами глаукомы, в том числе с гидрофтальмом и врожденной глаукомой при аномалии Петерса в возрасте от 1 нед до 10 лет, с одновременным проведением кератопластики. В ближайшем послеоперационном периоде положительный эффект наблюдался у 75 % детей.
В настоящее время с целью повышения эффективности операций предложены операции с использованием ультразвука. Отмечены преимущества использования низкочастотного ультразвука: меньшая травматичность, торможение регенеративного процесса. Применению лазеров посвящены единичные работы. Обсуждается эффективность трансплантации помутневшей роговицы у детей с врожденной глаукомой.
Ретроспективный анализ результатов 9 сквозных кератопластик с одновременным проведением антиглаукоматозных операций показал, что из 9 трансплантатов 6 сохранялись прозрачными в течение 24 мес, повышение остроты зрения наблюдалось в 75 % случаев.
Практически все авторы отмечают снижение гипотензивного эффекта операции в отдаленные сроки наблюдения.
Неблагоприятными факторами, осложняющими послеоперационное течение при первичной глаукоме, считают избыточное рубцевание и активную регенерацию, обусловленные пролиферацией фибробластов теноновой капсулы и эписклеры в области операции. Некоторые авторы считают, что у детей процессы пролиферации в зоне вмешательства в раннем послеоперационном периоде более активны, чем объясняют более низкую, чем у взрослых, эффективность фистулизирующих операций. Причиной плохою прогноза у больных с врожденной глаукомой является выполнение фильтрующих операций у лиц, ранее уже оперированных по поводу глаукомы. Высказано предположение о том, что ранний возраст пациента — неблагоприятный фактор для сохранения функционирования фистулы и нормальной фильтрации. Неблагоприятное течение заболевания отмечено у тех больных, у которых диагноз поставлен в возрасте до 2 мес или после 2 лет.
Рубцеванию в зоне хирургического воздействия при первичной глаукоме способствуют недостаточный объем иссекаемой части трабекулы, закрытие зоны операции гониосинехиями, которые являются последствиями послеоперационных иритов и кровоизлияний в переднюю камеру.
Воспалительные осложнения в виде иритов и иридоциклитов в послеоперационном периоде при врожденной глаукоме отмечены в единичных случаях. Кроме избыточного рубцевания, уменьшение эффекта антиглаукоматозных операций обусловливают такие осложнения, как развитие синдрома мелкой передней камеры, цилиохороидальная отслойка, гифема, макулярный отек. В качестве редко встречающегося осложнения трабекулэктомии у детей описана геморрагическая ретинопатия, напоминающая картину окклюзии центральной вены сетчатки. Самым частым среди всех послеоперационных осложнений при синдроме Стерджа—Вебера—Краббе была цилиохороидальная отслойка. Перепад ВГД, возникающий во время операции, является пусковым механизмом возникновения клинических проявлений сосудистой патологии (операционные и послеоперационные геморрагии), высокой частоте отслойки сосудистой оболочки.
Современные средства, препятствующие процессам пролиферации, включают уменьшение операций, иссечение субконъюнктивы и эписклеры, применение кортикостероидов, протеолитических ферментов и цитостатиков из группы антиметаболитов. Предложения использовать анти- пролиферативные средства при избыточном рубцевании тканей глаза появились в начале 80-х годов XX в. Применяли препараты из группы антиметаболитов: 5-фторурацил, позже — митомицин, блеомицин, что значительно улучшало исход антиглаукоматозных фильтрующих операций.
Представляется перспективным использование этих препаратов при врожденной глаукоме. Применение 5-фторурацила способствовало снижению ВГД на 41,6 % у детей с плохо поддающимися лечению формами глаукомы, в том числе врожденной. Использование митомицина повышало эффективность трабекулэктомии у молодых пациентов на 10—15 %. К сожалению, митомицин в обычных дозах оказывает повреждающее цитотоксическое действие на фибробласты, что ассоциируется с такими осложнениями, как мелкая передняя камера, отслойка сосудистой оболочки, эндофтальмиты, поэтому многие авторы рекомендуют применение 5-фторурацила. Обсуждаются методики, дозы применения этих препаратов, их токсичность, возможность развития побочных эффектов и послеоперационных осложнений. Применяли также ?-из- лучение, воздействие которого тормозит процесс рубцевания после фильтрующих операций. Исследователи считают перспективным применение антиметаболитов в виде липосом и заключение препарата в полимеры или коллаген.
Медикаментозное лечение. Медика - терапия не является основной при врожденной глаукоме, однако играет важную роль в комплексном лечении заболевания.
Выделяют основные направления медикаментозного лечения, включающие:
- снижение ВГД с применением комплекса гипотензивных препаратов;
- профилактику послеоперационного рубцевания;
- использование нейротрофических препаратов для сохранения и повышения зрительных функций;
- десенсибилизирующую и общеукрепляющую терапию.
Возможности медикаментозного лечения значительно расширились в связи с появлением комплекса современных гипотензивнъх препаратов. Использование этих препаратов показано детям с различными формами врожденной глаукомы; их назначают сразу после выявления повышенного ВГД у ребенка, включают в схему предоперационной подготовки с целью максимального снижения ВГД перед операцией, применяют для коррекции ВГД в послеоперационном периоде, а также для попытки его нормализации у оперированных детей в случае невозможности повторного оперативного вмешательства.
Основными гипотензивными препаратами, применяемыми у детей с врожденной глаукомой, являются:
- М-холиномиметик (] % раствор пилокарпина);
- неселективные 0-1,2-адреноблока- торы, включающие 0,25—0,5 % раствор арутимола и 0,25—0,5 % раствор тимоптика;
- селективный р- ] ,2-адреноблокатор (0,5 % раствор бетоптика);
- а-1 ,(3-адреноблокатор (1 % раствор прокеодолола);
- ингибиторы карбоан гид разы для местного применения (2 % раствор трусопта, 1 % раствор азопта);
- синтетический аналог простагландина Ра2 (0,005 % раствор латанопроста — ксалатана). Препараты применяют изолированно или, при недостаточном эффекте, в различных комбинациях. Чаще всего 1 % раствор пилокарпина комбинируют с каким-либо адреноблокатором и/или ингибитором карбоангидразы.
Целесообразным является назначение комбинированных препаратов: фотила (0,5 % раствор тимолола малеата и 2 % раствор пилокарпина), косопта (2 % раствор трусопта и 0,5 % раствор тимолола малеата) и ксалакома (0,005 % раствор ксалатана и 0,5 % раствор тимолола малеата), которые позволяют уменьшить количество инсталляций в день и повысить «качество жизни» пациента.
Помимо использования местных гипотензивных препаратов, для снижения ВГД перед операцией применяют диакарб (в таблетках по 0,25 г). К подбору гипотензивного режима необходимо подходить индивидуально и дифференцированно.
Побочные эффекты при назначении данных препаратов возникают редко, в виде местных токсико-аллергических реакций. С осторожностью следует назначать неселективные ?-адреноблокаторы детям с бронхиальной астмой, брадикардией, пониженным артериальным давлением. Назначение ингибиторов карбоангидразы и 0,005 % раствора ксалатана также требует осторожности: эта препараты должны применяться под наблюдением врача.
С целью сохранения и стимуляции зрительных функций детям с врожденной глаукомой показана нейротрофическая терапия, которую следует проводить регулярно —2 раза в год), так как при этом заболевании происходят дистрофические и атрофические изменения волокон зрительного нерва и сетчатки. В комплекс нейротрофического лечения включают препараты, влияющие на периферическое кровообращение и улучшающие микроциркуляцию (сермион в таблетках по 0,01 г, кавинтон в таблетках по 0,005 г и в виде 0,05 % раствора для инъекций, ксантинола никотинат в таблетках, по 0.1S г, трентал по 0,1 г в таблетках и в виде 2 % раствора для инъекций), ангиопротекторы доксиум в таблетках по 0,25, аскорутин в таблетках), а также средства, регулирующие метаболические процессы (церебролизин для инъекций), нейротропные (0,05 % раствор прозерина для инъекций витамины группы В. При назначении препаратов следует исходить из возрастных дозировок.
При стойкой компенсации ВГД в комплекс лечения включают физиотерапевтические методы: электрофорез и магнитофорез с нейротрофическими и сосудорасширяющими препаратами (2 % раствор ношпы, 0,05 % раствор прозерина), чрескожную электростимуляцию зрительного нерва.
Функциональное лечение. Важным является функциональное лечение, направленное на борьбу с амблиопией путем коррекции аметропии и плеоптики. У детей с врожденной глаукомой чаще выявляется миопия (у многих миопия средней и высокой степени) обязательно требующая коррекции.
Диспансерное наблюдение является необходимым для детей и подростков врожденной глаукомой. Очень важно регулярно наблюдать за ВГД, размера ми глаза, остротой зрения. Детей с подозрением на врожденную глаукому или с установленным диагнозом ставят на диспансерный учет в поликлинике по месту жительства с обязательным обследованием 1 раз в месяц: измерение ВГД, диаметра роговицы, ширины лимба и определение зрительных функций (по возможности).
Таким образом, несмотря на значительное освещение в литературе вопросов клиники, этиопатогенеза, диагностики и лечения врожденной глаукомы, проблема остается актуальной и требует дальнейших исследований.
Статья из книги: Зрительные функции и их коррекция у детей | С.Э. Аветисов, Т.П. Кащенко, А.М. Шамшинова.


Комментариев 0