Болезнь Коатса

Описание
Болезнь Коатса (наружный геморрагический ретинит Коатса) — идиопатическое заболевание, характеризующееся полиморфными изменениями сосудов сетчатки, локализующимися преимущественно на периферии, и массивной интра- и субретинальной экссудацией.Первое описание заболевания, известного в настоящее время под эпонимом «болезнь Коатса», вероятно, принадлежит W.A. Brailey (1876). В 1908 г. G. Coats сообщил о трех формах поражений заднего отрезка глаза, характеризующихся изменениями сосудов сетчатки и выраженной экссудацией.
Автор выделил как отдельные нозологические формы следующие патологические состояния:
- экссудативные изменения без сосудистых нарушений;
- варианты с аномалиями сосудов;
- сочетания васкулярных нарушений с обширными артериовенозными мальформациями. Во второй работе, появившейся в печати в 1912 г., G. Coats представил описанные им ранее первые две формы патологических состояний как единое заболевание, назвав его наружным геморрагическим ретинитом. Третья же форма ангиоматоза сетчатки известна в настоящее время как болезнь Гиппеля.
Патогенез. Генетические дефекты, ответственные за развитие ретинита Коатса, не установлены. За два последних десятилетия описаны многочисленные случаи сочетания болезни Коатса с различными генетически детерминированными аномалиями, в частности пигментным ретинитом, туберозным склерозом, синдромом Халлермана—Штрейфа, болезнью Альпорта, синдромом Сениора—Локена, эпвдермальным невусом Ядассона, синдромом Парри—Ромберга, синдромом Корнелии де Ланге. Выявлено повышение уровня фактора роста фибробластов в сыворотке крови у пациентов с множественными гломусными опухолями и болезнью Коатса. Авторы не исключают возможной роли этого фактора в патогенезе заболевания.
Классификация. Общепринятой классификации болезни Коатса в настоящий момент нет. В клинической практике для более четкой опенки тяжести заболевания, прогнозирования его исхода и унификации тактики лечения пациентов с болезнью Коатса мы используем собственную классификацию, выделяя 4 стадии в течении заболевания.
Клиническая классификация
I. Начальная стадия.
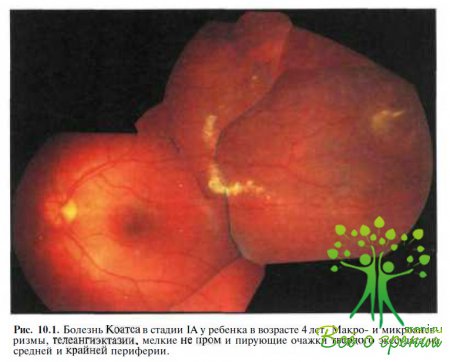
А. Сосудистые мальформации (микро- и макроаневризмы, те- леангиэктазии, артериовенозные шунты) и мелкие рассеянные очажки твердого экссудата на средней и крайней периферии или в заднем полюсе, но вне пределов макулы (рис. 10.1).
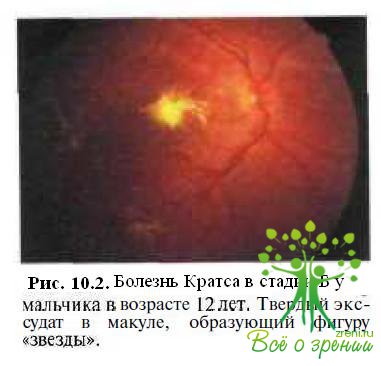
Б. Сосудистые мальформации и непроминирующие очаги твер¬дого экссудата в макуле, а также на периферии (рис. 10.2).
II. Развитая стадия.
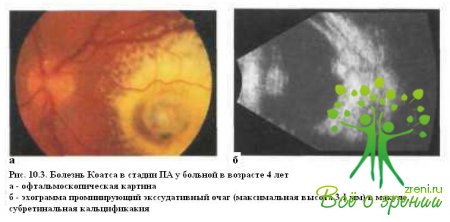
А. Локальные проминирующие отложения твердого экссудата в заднем полюсе (рис. 10.3).
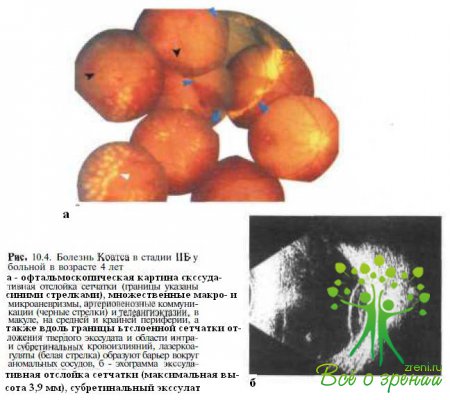
Ограниченная экссудативная отслойка сетчатки, протяженность которой не превышает 2 квадрантов (рис. 10.4).
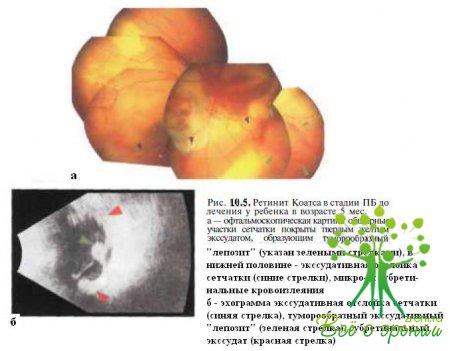
Б. Обширные отложения твердого экссудата, образующего туморообразные депозиты (рис. 10.5).
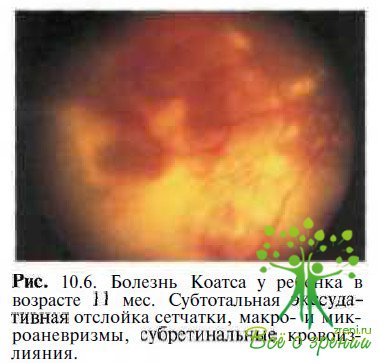
Субтотальная (протяженность 2—3 квадранта) экссудативная отслойка сетчатки (рис.10.6)
Задняя отслойка стекловидного тела.
III. Далеко зашедшая стадия.
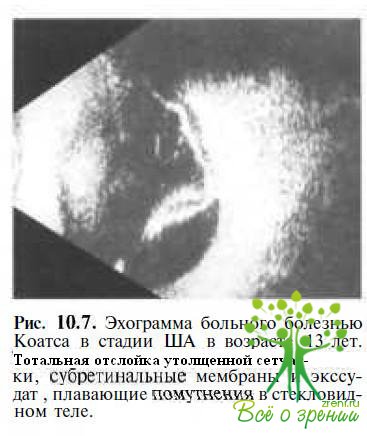
А. Тотальная отслойка сетчатки, субретинальные мембраны (рис.10.7)
Б. Увеит, катаракта, рубеоз радужки.
IV. Терминальная стадия.
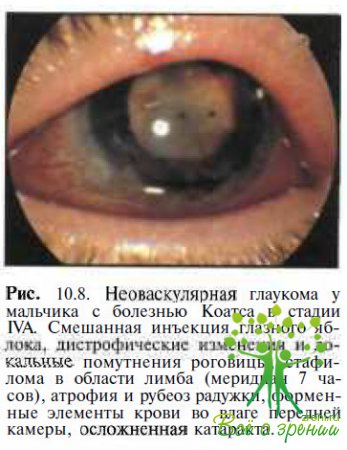
А. Неоваскулярная глаукома (рис.10.8)
.
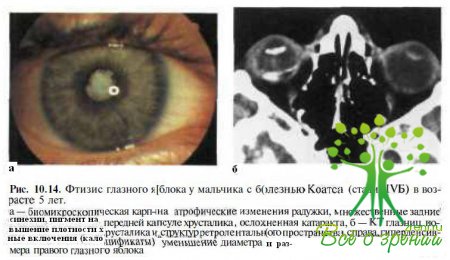
Б. Субатрофия глазного яблока (фтизис).
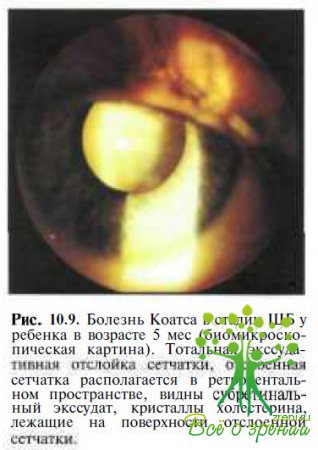
Клинические проявления. В начальной стадии болезнь Коатса протекает бессимптомно, и ее наиболее часто диагностируют у детей в возрасте 2—8 лет при случайных осмотрах офтальмолога перед поступлением в ясли-сад или школу. Заболевание может выявляться уже вскоре после рождения. Классические признаки далеко зашедшей стадии болезни Коатса нередко определяют уже у грудных младенцев в возрасте 2—6 мес. В этих случаях первыми симптомами заболевания являются косоглазие или лейкокория, а при биомикроскопии обнаруживают тотальную экссудативную отслойку сетчатки, причем отслоенная сетчатка в виде пузырей располагается в ретролентальном пространстве или прилегает к задней поверхности хрусталика (рис. 10.9).
Мы наблюдали 2-ме-сячного мальчика и 5-месячную девочку с развитой стадией болезни Коатса (см. рис. 10.5). D.S. Dow (1973) описал болезнь Коатса у ребенка 7 мес.
Дети старшего возраста могут предъявлять жалобы на постепенное снижение остроты зрения, появление «пятен» перед больным глазом или искажения формы и размеров рассматриваемых объектов.
Как правило, поражается один глаз.?
Двусторонние изменения наблюдаются лишь у 5—8 % больных. Мальчики болеют в 3 раза чаше, чем девочки.
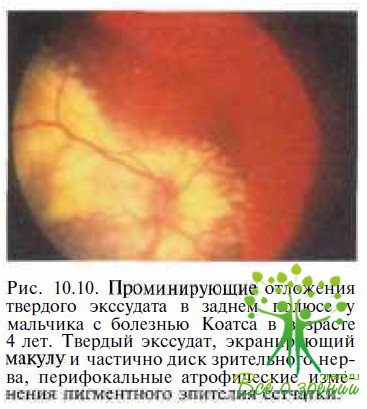
Доминирующим симптомом болезни Коатса являются проминирующие отложения твердого экссудата ярко- желтого цвета в слоях сетчатки и субретинальном пространстве, локализующиеся преимущественно в заднем полюсе или тех областях, где находятся измененные сосуды (рис. 10.10; см. рис. 10.5).
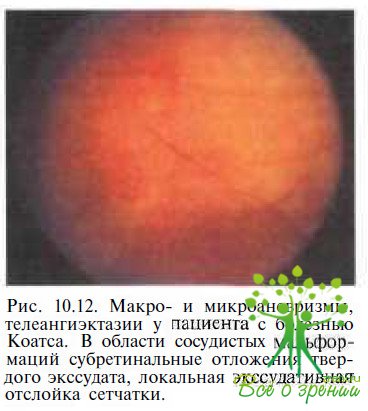
Сосудистые аномалии находятся преимущественно на периферии и включают телеангиэктазии, расширенные артериолы, капилляры и венулы, микро- и макроаневризмы, артериовенозные шунты (см. рис. 10.2). При офтальмоскопии измененные сосуды могут напоминать красные бусы (рис. 10.11) или гроздь рябины (рис. 10.12).
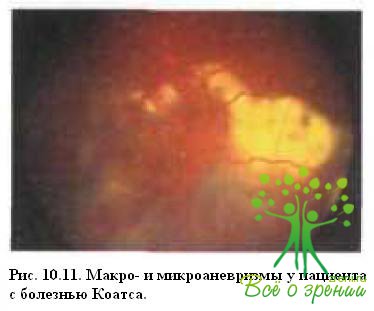
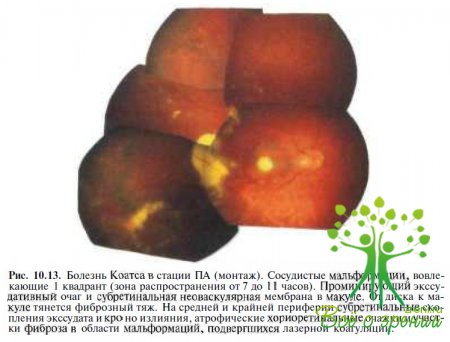
Аномальные сосуды чаще локализуются в височной половине сетчатки, особенно в нижненаружном квадранте (в 40 % случаев). Клинические проявления варьируют по тяжести от минимальных сосудистых капиллярных нарушений с незначительной экссудацией, захватывающих менее одного квадранта (рис. 10.13),
до обширных полей телеангиэктазии, перекрывающих 3—4 квадранта и сопровождающихся массивной экссудацией и развитием ограниченной (см. рис. 10.5,10.6 и 10.11) или тотальной (см. рис.10.7) отслойки сетчатки. При отсутствии лечения заболевание продолжает прогрессировать, что приводит к тотальной отслойке сетчатки.
Особенно неблагоприятно болезнь Коатса протекает у детей раннего возраста. Как показали наши наблюдения, у 96 % детей с болезнью Коатса, не получавших лечения, в течение6 лет формируются тотальная отслойкасетчатки, иридоциклит, осложненная катаракта. В итоге у 57—75 % пациентов с ретинитом Коатса развивается неоваскулярная глаукома (см. рис. 10.8), у 23 % — субатрофия глазного яблока (рис. 10.14).
[banner_centerrs] {banner_centerrs} [/banner_centerrs]
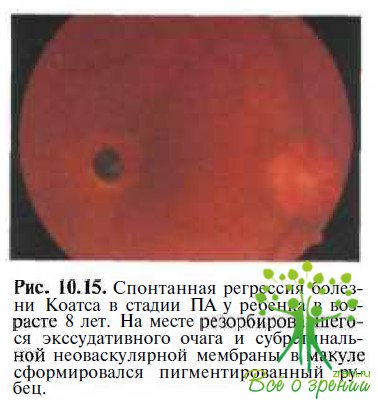
В литературе описаны казуистические случаи самопроизвольной регрессии заболевания (Campbell F.P., 1976). Мы наблюдали у мальчика 8 лет спонтанную регрессию болезни Коатса в развитой стадии (ПА) с полной резорбцией экссудата в заднем полюсе, но без восстановления зрительных функций, что было связано с формированием макулярной субретинальной неоваскулярной мембраны и ее последующим рубцеванием (рис. 10.15). В дальнейшем при наблюдении за этим больным в течение 5 лет рецидива заболевания не отмечено.
Диагностика. Для уточнения диагноза и определения тактики лечения, помимо рутинного офтальмологического обследования, пациентам с болезнью Коатса необходимо более тщательное исследование глазного дна методами непрямой офтальмоскопии с использованием бинокулярного налобного офтальмоскопа, биомикроскопии с трехзеркальной линзой Гольдманна и флюоресцентной ангиографии (ФАГ).
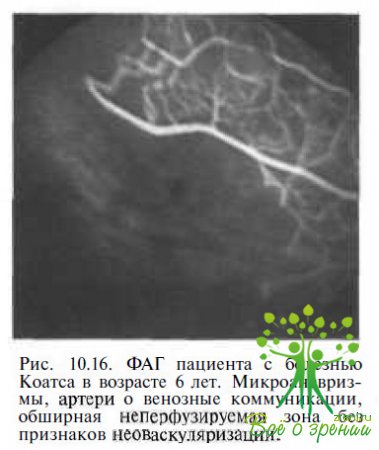
При ФАГ выявляют сосудистые мальформации, окклюзии капилляров, артериол и артерий, зоны нарушенной проницаемости стенок расширенных сосудов сетчатки, неперфузируемые области (рис. 10.16),
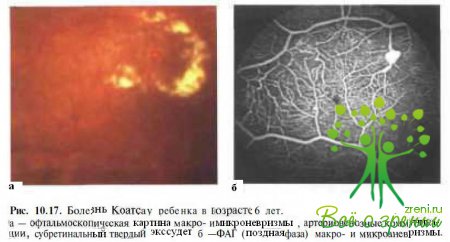
артериовенозные шунты (рис. 10.17).
ФАГ позволяет точно локализовать сосудистые аномалии и оценить оббьем предстоящей лазерной коагуляции.
В некоторых случаях, особенно у больных с макулярным отеком или отложениями твердого экссудата в макуле, целесообразно использовать оптическую когерентную томографию.
У пациентов с болезнью Коатса в развитой, далеко зашедшей и терминальной стадиях заболевания, характеризующихся наличием экссудативной отслойки сетчатки и/или обширных интра- и субретинальных отложений твердого экссудата, необходимо применять эхографию. Ультразвуковое сканирование позволяет исключить наличие новообразований, которые могут располагаться под отслоенной сетчаткой или маскироваться экссудатом, вследствие чего их не выявляют при офтальмоскопии, определить локализацию, протяженность и высоту отслойки сетчатки и зкссудативных тумороподобных депозитов, оценить состояние субретинального пространства. В трудных случаях у пациентов с тотальной отслойкой сетчатки для исключения ретинобластомы, злокачественной медуллоэпителиомы или меланомы целесообразно проводить KT, MPT и дуплексное сканирование в режиме цветового допплеровского картирования.
При длительном наблюдении за пациентами с болезнью Коатса для оценки изменений поля зрения в динамике полезна периметрия, позволяющая в некоторых случаях судить о характере течения заболевания; увеличение площади дефектов в поле зрения свидетельствует о прогрессировании наружного экссудативного ретинита.
Гистологические исследования. Результаты морфологических исследований в начальной стадии заболевания противоречивы. Некоторые авторы обнаружили значительное утолщение стенок мелких сосудов с неизмененным или слегка увеличенным просветом и относительно сохранным эндотелием.
Другие исследователи сообщают о выраженном истончении стенок мелких сосудов, увеличении их просвета и отсутствии эндотелия на отдельных участках. С помощью электронной микроскопии установлено, что утолщение стенок капилляров в развитой стадии заболевания обусловлено се пропитыванием липидами, плазмой и фибрином, а также инфильтрацией макрофагами и лейкоцитами. Плазмолемма эндотелиальных клеток не имеет четких контуров мембраны.
В их цитоплазме определяются юные формы пластичного комплекса — диктиосомы, связанные с его новообразованием. Происходит утолщение мембраны Бруха за счет скопления в ее наружном коллагеновом слое плазменного экссудата, выходящего из слоя хориокапилляров. Субретинальный материал в основном состоит из свободного холестерина и его эфиров. Наличие эозинофилов и лейкоцитов в стенках аномальных сосудов и вокруг них свидетельствует о воспалительной реакции, вызванной наличием экссудата.
Дифференциальная диагностика. Ретинит Коатса необходимо дифференцировать от следующих заболеваний:
- ретинобластома;
- злокачественная медуллоэпителиома;
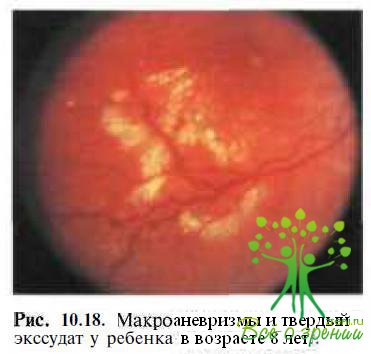
- макроаневризмы (рис. 10.18);
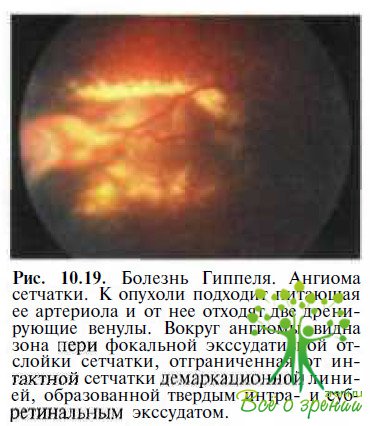
- болезнь Гиппеля (рис. 10.19) и Гиппеля — Линдау;
- задний увеит токсокарозной или токсонлазмозной этиологии;
- Х-сцепленный ювенильный ретиношизии;
- семейная экссудативная витреоретинопатия;
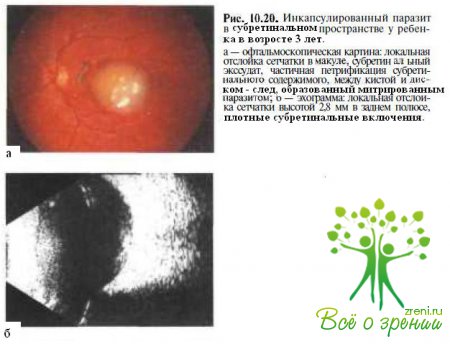
- паразитарные поражения заднего отрезка (рис. 10.20);
- болезнь Илза;
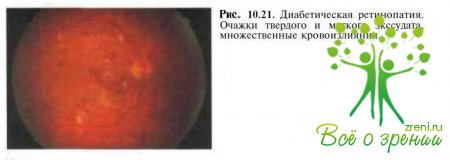
- диабетическая ретинопатия (рис. 10.21);
- ретинопатия недоношенных;
- первичное гиперпластическое персистирующее стекловидное тело.
Ретнобластома. Ретинобластома — наиболее распространенная злокачественная опухоль у детей раннего возраста (рис. 10.22).

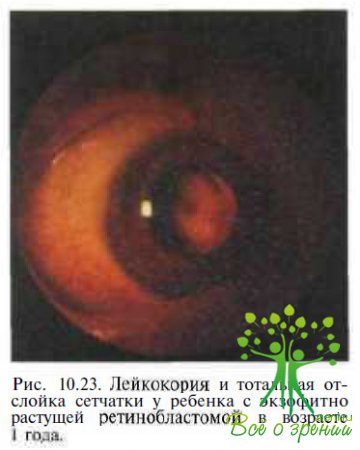
Приблизительно в 60 % случаев ретинобластома бывает односторонней . У больных с ретинобластомой в анамнезе нет сведений, указывающих на наследственный характер заболевания. Поданным С М . Howard и R.M. Ellsworth (1965), у 3,9 % от общего числа больных, которым была произведена энуклеация глаза в связи с ретинобластомой, при последующем гистологическом исследовании был диагностирован ретинит Коатса. Наиболее трудно дифференцировать болезнь Коатса от экзофитно растущей ретинобластомы (рис. 10.23).
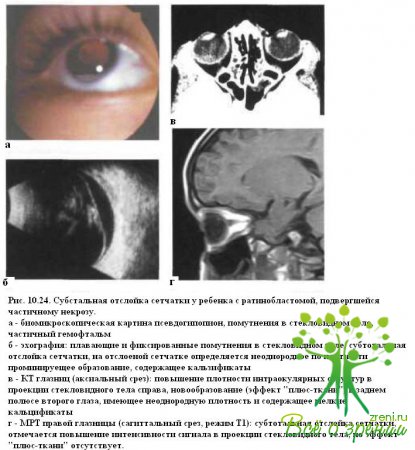
В этих случаях опухоль часто маскируется под отслоенной сетчаткой, могут быть вторичные васкулярные изменения в виде расширения сосудов сетчатки и телеангиэктазий. Обычно ретипобластома имеет вид плотного узла, хотя встречаются случаи диффузной инфильтрации сетчатки опухолевыми массами. Кроме того, в далеко зашедшей или терминальной стадиях ретинита Коатса ретролентальная глиальная пролиферация имитирует опухолевые узлы. Иногда чрезвычайно трудно установить правильный диагноз у пациентов с далеко зашедшей стадией заболевания, когда происходит распад ретинобластомы или она располагается на отслоенной сетчатке (рис. 10.24).
С целью дифференциальной диагностики ретинобластомы и болезни Коатса используют множество параклинических тестов: KT, MPT, ультразвуковые исследования в различных режимах (двух- и трехмерная эхография, цветовое картирование кровотока и энергетический допплер), определение содержания нейронспецифической энолазы в плазме и лактатдегидрогеназы во влаге передней камеры. К сожалению, ни один из упомянутых выше диагностических методов не является специфическим.
При проведении дифференциальной диагностики наиболее информативны эхография и КТ (см. рис. 10.24, б, в), в ходе которых можно обнаружить интраокулярные кальцификаты и оценить состояние зрительного нерва, склеры и орбитальных тканей. У пациентов с экзофитно растущей ретинобластом ой кальцификаты выявляют в 95 % случаев. Хотя наличие кальцификатов и не является патогномоничным симптомом ретинобластомы, тем не менее у пациентов с болезнью Коатса интраокулярные кальцификаты или оссификация встречаются крайне редко. MPT обладает некой чувствительностью по отношению к интраокулярным там, но в большинстве случаев позволяет надежно дифференцировать субретинальный экссудат от опухоли.
В некоторых случаях целесообразно применять транссклеральную тонкоигольную биопсию и молекулярные исследования ДНК.
Медуллоэпителиома. Медуллоэпителиома — первичная опухоль беспигментного цилиарного эпителия, чаще манифестирует у детей в возрасте 4— 5 лет, но есть сообщения и о младенцах первых месяцев жизни. Нередко правильный диагноз пациентам с медуллоэпителиомой устанавливают в поздней стадии заболевания спустя год и более после появления первых симптомов. В этих случаях клиническая симптоматика при хпокячественной медуллоэпителиоме у детей раннего возраста напоминает картину в далеко зашедшей стадии ретинита Коатса Часто заболевание выявляют, когда у пациентов развиваются лейкокория или, несколько позже, неоваскулярная глаукома, сопровождающаяся выраженным болевым синдромом.
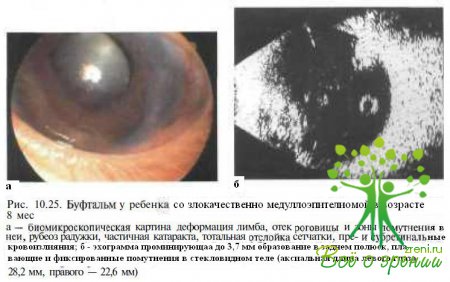
Под нашим наблюдением находились два мальчика 1,5 и 5 лет, у которых при амбулаторном обследовании была диагностирована болезнь Коатса В связи с отрицательной динамикой в течении заболевания и развитием неоваскулярной глаукомы дети были госпитализированы в стационар При биомикроскопии у обоих детей выявлены мелкая передняя камера, мидриаз, рубеоз радужки, частичная катаракта, высокая тотальная отслойка сетчатки и ретролентальные фиброваскулярные ткани с включениями твердого экссудата желтою цвета и кристаллами холестерина (рис. 10.25, 10.26).
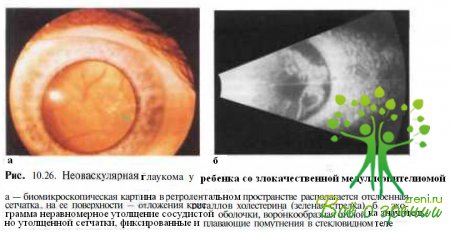
При В-сканировании у 18-месячного больного были обнаружены плавающие помутнения в стекловидном теле и про- минирующее до 4,6 мм уплотнение в заднем полюсе, напоминавшее типичный для болезни Коатса экссудативный очаг (см. рис. 10.25, б). У 5-летне¬го мальчика при эхографии отмечены неравномерное утолщение сосудистой оболочки, воронкообразная отслойка резко утолщенной сетчатки, фиксированные и плавающие помутнения в стекловидном теле (см. рис. 10.26, б). В обоих случаях при КТ «плюс ткань» не определялась. В связи с выраженным болевым синдромом была произведена энуклеация. При гистологическом исследовании удаленных глаз была верифицирована злокачественная медуллоэпителиома.
Таким образом, дифференциальная диагностика ретинита Коатса и злокачественной медуллоэпителиомы в далеко зашедшей стадии чрезвычайно трудна. КТ и эхография в этой стадии заболевания, как правило, неинформативны, особенно при передней локализации опухоли, так как нет четкого эффекта «плюс ткани». Помощь в диагностике может оказать МРТ, в частности, с использованием «жирсупрессивной» техники исследования. В сомнительных случаях, особенно при развитии неоваскулярной глаукомы с болевым синдромом, единственным выходом для клинициста является энуклеация.
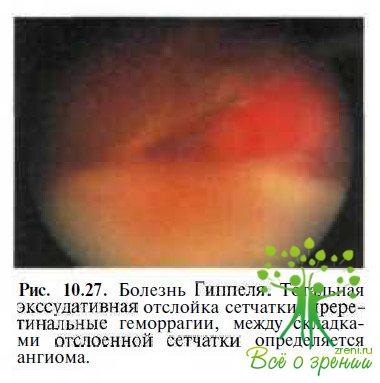
Болезнь Гиппеля и Гиппеля—Линдау. Необходимость в проведении дифференциальной диагностики возникает лишь в далеко зашедшей и терминальной стадиях заболевания у пациентов с тотальной экссудативной отслойкой сетчатки и/или неоваскулярной глаукомой (рис. 10.27).
В отличие от ретинита Коатса при болезни Гиппеля у 30—50 % пациентов поражаются оба глаза. Приблизительно у 25 % пациентов с болезнью Гиппеля—Линдау при КТ и МРТ головного мозга выявляют гемангиобластому или гемангиому мозжечка, имеется неврологическая симптоматика. У 1/3 пациентов диагностируют кистозные изменения почек и/или поджелудочной железы, у 7 % — феохромоцитому. Важными диагностическими критериями в пользу болезни Гиппеля или Гиппеля—Линдау являются также обнаружение гемангиомы сетчатки (см. рис. 10.19) в ходе офтальмоскопического обследования кровных родственников или анамнестические данные, свидетельствующие о наличии больных с данной формой факоматоза в семье.
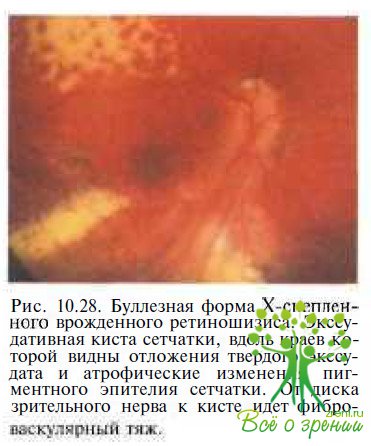
Х-сцепленный ювенильный ретиношизис. У детей раннего возраста с буллезной формой Х-сцепленного ювенильного ретиношизиса иногда выявляют скопления твердого экссудата желтого цвета в заднем полюсе и периферические полиморфные сосудистые изменения в виде периваскулярных «муфт», неоваскуляризации, микроаневризм, облитерированных древовидных сосудов. В ряде случаев течение заболевания осложняется формированием витреоретинальных фиброваскулярных тяжей, развитием гемофтальма и тракционной или экссудативной отслойки сетчатки (рис. 10.28).
При эхографии в таких случаях выявляют отслойку сетчатки с плотным субретинальным содержимым, что также может вводить в заблуждение офтальмологов. В литературе описаны казуистические случаи развития вторичной глаукомы у детей раннего возраста с Х-сцепленным ювенильным ретиношизисом и тотальной отслойкой сетчатки.
Решить возникающую в таких случаях диагностическую дилемму помогают данные анамнеза, указывающие на сцепленный с полом характер наследования заболевания у пациентов с врожденным ретиношизисом. При врожденном ретиношизисе в отличие от болезни Коатса поражаются оба глаза. Важную роль в дифференциальной диагностике играют электрофизиологические исследования, в ходе которых у пациентов с Х-сцепленным ювенильным ретиношизисом при регистрации максимального комбинированного ответа или скотопической ЭРГ выявляют двустороннее снижение амплитуды Ь-волны при сохранности параметров а-волны. У пациентов с болезнью Коатса в начальной и развитой стадиях ЭРГ не изменяется. В далеко зашедшей стадии заболевания при наличии распространенной экссудативной отслойки сетчатки ЭРГ пораженного глаза субнормальная или не регистрируется, тогда как ответ интактного глаза остается нормальным.
Рис. 10.28. Буллезная форма Х-снепленного врожденного ретиношнзиса. Экссудативная киста сетчатки, вдоль краев которой видны отложения твердого экссудата и атрофические изменения пигментного эпителия сетчатки. От диска зрительного нерва к кисте идет фиброозскулярныи тяж.
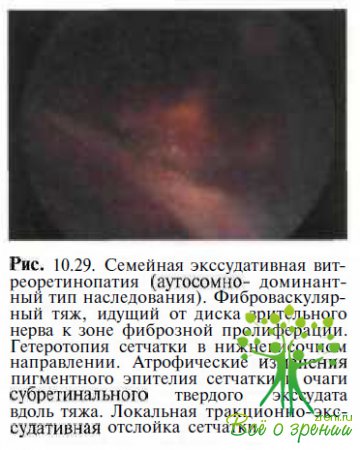
Семейная экссудативная витреоретипопатия. Необходимость в дифференциальной диагностике с названным заболеванием возникает главным образом у пациентов с болезнью Коатса в далеко зашедшей или терминальной стадии. Семейная экссудативная витреоретинопатия — двустороннее заболевание с различным типом наследования, характеризующееся витреоретинальнымк изменениями в виде мембран и фиброваскулярных тяжей (рис. 10.29), нарушениями ретинальной васкуляризации и частым развитием тракционной отслойки сетчатки. Заболевание билатеральное, но глаза могут поражаться со значительной разницей по времени. Важное значение для дифференциальной диагностики имеют данные симейного анамнеза и результаты офтальмологического обследования других членов семьи.
В отличие от ретинита Коатса при семейной экссудативной ретинопатии экссудативные изменения минимальные, чаще определяют периферические фиброваскулярные изменения, приводящие к тракционной деформации диска зрительного нерва и гетеротопии макулы в височную сторону. У больных с семейной экссудативной витреоретинопатией даже при отсутствии офтальмоскопических изменений на глазном дне может отмечаться снижение Ь-волны ЭРГ. Кроме того, для пациентов с болезнью Коатса не характерны изменения в стекловидном теле, за исключением вторичной воспалительной реакции, наблюдаемой в развитой и далеко зашедшей стадиях болезни.
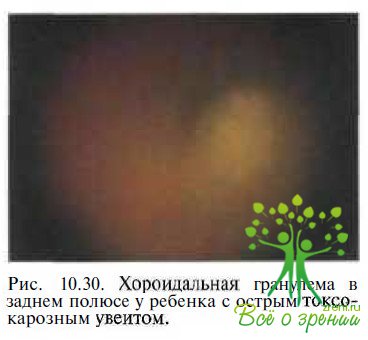
Токсокарозный увеит характеризуется выраженной воспалительной реакцией стекловидного тела и наличием белых или серых масс (хороидальная гранулема) в заднем полюсе или на периферии сетчатки (рис. 10.30).
В дальнейшем формируются грубые витреоретинальные тяжи и мембраны, тракционная деформация диска зрительного нерва, гетеротопия сетчатки. Как в острой стадии заболевания, так и в периоде ремиссии возможна отслойка сетчатки. Заболевание, как правило, одностороннее и развивается преимущественно у людей в возрасте 2—30 лет.
Дифференциальная диагностика основывается на клинических различиях: при болезни Коатса превалируют сосудистые аномалии, витреадьные изменения незначительны и появляются лишь в развитой стадии болезни. Кроме того, у 60—80 % пациентов с токсокарозом в острой фазе заболевания отмечают различные соматические расстройства: лихорадку, кашель и хрипы в легких, гепатоспленомегалию, судороги, уртикарные высыпания на коже, эозинофилию крови. Позднее при рентгенологическом исследовании органов грудной клетки в легких выявляют рассеянные инфильтративные тени. Информативным является иммунологическое исследование — ферменто подобная иммуносорбентная проба с использованием яиц Toxocara canis в качестве антигена: приблизительно у 45 % пациентов с поражением глаз титр антител превышает 1 : 32. Косвенным подтверждением диагноза при подозрении на острый токсокарозный увеит является выраженный терапевтический эффект в ответ на применение кортикостероидов и диэтилкарбамазина.
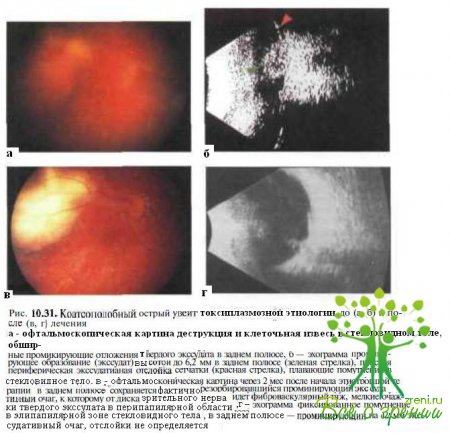
Токсоплазмозный увеит. Заражение Toxoplasma gpndii в постнатальном периоде обычно проходит незамеченным. Хориоретинит встречается приблизительно у 1 % больных с приобретенной формой токсоплазмоза. Заболевание одностороннее. Хориоретинальные поражения сочетаются с витреитом различной тяжести. При тяжело протекающем витреите просвечивающиеся сквозь помутнения в стекловидном теле ретинохороидальные бело-желтые проминирующие очаги создают эффект, образно называемый «фара в тумане» (рис. 10.31, а,б).
В тяжелых случаях воспаление распространяется на передний отрезок, сопровождаясь появлением клеток во влаге передней камеры и преципитатов на эндотелии, а также формированием синехий. В некоторых случаях отмечают явления папиллита, множественные интра- и субретинальные геморрагии, массивную экссудацию, сопровождающуюся развитием экссудативной отслойки сетчатки (см рис 10 31,6)
Дифференциальная диагностика основывается на типичной клинической картине и позитивных результатах иммунологических исследований — реакции с красителем или определения антител с помощью непрямой флюоресценции (lgМ и lgG) В некоторых случаях при остром токсоплазмозе возможные недомогания, лихорадочное состояние, боли в мышцах, пятнисто- папулезная сыпь, лимфаденонатия и увеличение печени Высыпания на коже сохраняются в течение 3—4 дней, остальные симптомы заболевания — в течение нескольких дней или даже недель При назначении этиотропных препаратов и корти костероидов (комбинация пириметамина или клицдамицина с сульфадиазином и дексазоном) у большинства пациентов с приобретенным токсоплазмозом отмечают постепенную регрессию (см рис 10.31, в, г) витреальных и ретинальньк нарушений.
Болезнь Илза — шшопатический периферический ретиноваскулит, сочетающийся с ишемией периферических отделов сетчатки. Приблизительно 80 % пациентов с болезнью Илза — мужчины. Заболевание обычно развивается в возрасте 20—30 лет. Как правило, поражаются оба глаза. У 17— 48 % больных поражения глаз сочетаются с вестибулослуховыми дисфункциями. Другие экстраокулярные нарушения наблюдаются реже и включают главным образом поражения нервной системы: острые и подострые миелопатии, эпилепсию, периферические нейропатии, пара- и гемиплегии, инсульты. Болезнь Илза часто встречается у жителей Ближнего Востока. Некоторое время заболевание может протекать бессимптомно.
Основными причинами снижения зрения являются гемофтальм и макулярный отек. При ФАГ на периферии определяют обширные, четко отграниченные неперфузируемые зоны и признаки васкулита. Вдоль границы аваскулярных зон выявляют микроаневризмы, расширенные вены, артериовенозные шунты, участки отложения твердого экссудата и множественные ватообразные очаги. По мере прогрессирования заболевания развиваются преретинальная и препапиллярная неоваскуляризация, окклюзии ветвей центральной вены сетчатки, витреоретинальный фиброз и рубеоз радужки. Заболевание часто осложняется рецидивирующим гемофтальмом. Тем не менее для пациентов с болезнью Илза характерна высокая острота зрения: в отдаленном периоде у 67 % больных острота зрения 0,5 и выше. Дифференциальная диагностика иногда сопряжена с определенными трудностями, особенно в начальной стадии заболевания. Она основывается на офтальмоскопических различиях, результатах ФАГ и данных нейросоматического обследования больных. Кроме того, практически у всех пациентов с ретинитом Коатса выявляют проминирующие очаги твердого экссудата в заднем полюсе. В то же время такие осложнения, как рецидивирующий гемофтальм и преретинальный фиброз, при болезни Коатса развиваются чрезвычайно редко и обычно являются следствием неадекватного выбора параметров лазерной коагуляции.
Первичное персистирующее стекловидное тело (ППГСТ) — редко наблюдаемая спорадическая врожденная аномалия, обусловленная персистенцией и вторичным фиброзом примитивной гиалоидной сосудистой системы. Поражение, как правило, одностороннее. У пациентов с ППГСТ фиброваскулярный тяж отходит от диска зрительного нерва и прикрепляется к задней капсуле хрусталика, вызывая ее помутнение в месте контакта. Нередко ППГСТ сочетается с микрофтальмом или микрокорнеа.
Дифференциальная диагностика болезни Коатса с остальными патологическими состояниями вызывает сложности лишь в далеко зашедшей стадии и основывается на анализе данных анамнеза, результатах клинического и иммунологического обследований.
Лечение. В 1960 г. G. Meyer-Schwi- ckerath и K.J. Pesch впервые сообщили о положительных результатах использования ксеноновой фотокоагуляции для лечения пациентов с болезнью Коатса и телеангиэктазиями сетчатки, сочетавшимися с вторичной субретинальной экссудацией. Позднее появились публикации, свидетельствующие об эффективности криотерапии и лазерной коагуляции сетчатки при лечении пациентов с болезнью Коатса.
Эффективность реабилитации больных с ретинитом Коатса в частности функциональные результаты, зависит от того, в каком возрасте манифестировала болезнь и в какой стадии заболевания начато лечение. В тех случаях, когда имеются обширные отложения экссудата в заднем полюсе и на периферии, нередко сочетающиеся с экссудативной отслойкой сетчатки, лазерную коагуляцию проводят в основном с органосохранной целью. Лазерная коагуляция сетчатки эффективна в начальной и развитой (1А—НА) стадиях заболевания при поражениях протяженностью до 240°. При поражениях, имеющих большую площадь или локализующихся на крайней периферии, целесообразно сочетать лазерную коагуляцию сетчатки с криотерапией. Во ПБ—1ПА стадиях заболевания криотерапия более эффективна, чем лазерная коагуляция. У детей, особенно в раннем возрасте, ремиссии заболевания, как правило, удается достичь лишь в результате проведения нескольких курсов (2—6) лазерной коагуляции и/или криотерапии. Интервалы между курсами лечения составляют 3—4 мес.
Лазерную коагуляцию заднего сегмента при ретините Коатса проводят с помощью лазерных установок, адаптированных к щелевой лампе или бинокулярному налобному офтальмоскопу. В первом случае для лазерной коагуляции используют различные роговичные контактные линзы. Широко применяют трехзеркальную линзу Гольдманна, четырех - зеркальную линзу Карикхоффа, линзу «Трансэкватор» фирмы -«Volk» и др. При неконтактной периферической коагуляции используют линзы 60, 78 или 90ДПТр. Необходимо помнить, что при использовании этих линз размеры пятнана сетчатке изменяются в 0,92, 1,15 и 1,39 раза соответственно.
Лечение целесообразно начинать с барьерной лазерной коагуляции во¬круг сосудистых аномалий и вдоль границы отслоенной сетчатки, формируя демаркационную линию из 2—3 рядов коагулятов (см. рис. 10.11; рис. 10.32).
Диаметр коагулятов при периферической коагуляции 200—500 мкм, экспозиция 0,1 —0,3 с, мощность 150— 800 мВт. За один сеанс можно наносить до 500—700 коагулятов. Через 5—7 дней проводят повторный сеанс, в ходе которого коагулируют сосудистые мальформации (рис. 10.33).
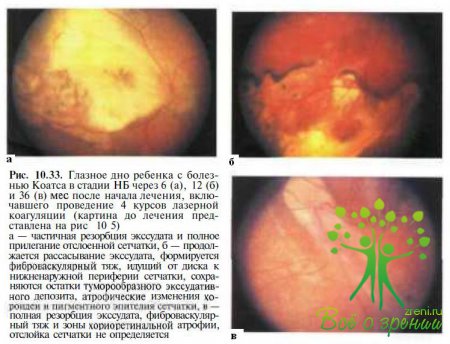
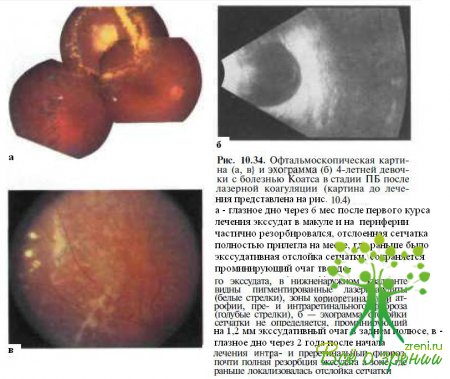
В ряде случаев полезна коагуляция опухолеподобных депозитов субретинального экссудата, что значительно ускоряет их резорбцию (см. рис. 10.5; рис. 10.34),
при этом параметры мощности, экспозиции и диаметра пятна идентичны тем, которые используют при коагуляции зон, граничащих с субретинальными отложениями экссудата. В торпидных случаях возможно комбинированное применение лазерной коагуляции и транссклеральной криотерапии. Деструкция всех сосудистых аномалий — необходимое условие для полного излечения. Первый курс лечения можно считать завершенным лишь после того, как будут коагулированы все сосудистые мальформации, включая мельчайшие телеанги эктазии и микроаневризмы.
При проведении лазерной коагуляции у пациентов с ретинитом Коатса могут возникнуть следующие осложнения:
- кровоизлияния в момент выполнения лазерной коагуляции или в первые дни после нее;
- глиоз макулы;
- макулярные складки или тракции.
Причиной кровоизлияния в момент проведения коагуляции сосуда может быть повреждение сосудистой стенки вследствие неправильного выбора параметров операции (например, при использовании коагулятов слишком малого диаметра или очень большой мощности коагуляции). В послеоперационном периоде кровоизлияние может быть обусловлено некрозом сосудистой стенки.
Макулярный глиоз развивается, как правило, после интенсивной лазерной коагуляции у больных с обширными по площади (не менее двух квадрантов) поражениями. Макулярные складки или тракции образуются крайне редко, в основном после чрезмерной лазерной коагуляции. С целью профилактики указанных осложнений необходимо в каждом случае тщательно подбирать параметры коагуляции (мощность, диаметр пятна и экспозицию), а у пациентов с поражениями, занимающими несколько квадрантов, проводить коагуляцию за несколько сеансов с интервалами между ними в 7—10 дней.
Через некоторое время (приблизительно 2—3 мес) после лазерной коагуляции или криодеструкции сосудистых аномалий происходит частичное рассасывание интра- и субретинальных кровоизлияний и экссудата, включая отложения субретинального экссудата в макуле (см. рис. 10.34). В зонах экссудативной отслойки сетчатки в зависимости от степени резорбции субретинального содержимого отмечается полное или частичное прилегание отслоенной сетчатки (см. рис. 10.34).
По мере рассасывания экссудата и прилегания отслоенной сетчатки могут быть выявлены скрывавшиеся под ними и вследствие этого не диагностированные ранее аневризмы. В связи с этим для предупреждения рецидива заболевания необходимо проводить их коагуляцию или (сриодеструкцию, а также повторно коагулировать крупные сосудистые мальформации, которые не удалось блокировать в ходе проведения первого курса лечения. Число курсов лазерной коагуляции, необходимых для достижения стабилизации в течении заболевания у больных с ретинитом Коатса, обычно колеблется от 1 до 6.
При реабилитации детей раннего возраста с ретинитом Коатса, имею¬щих предметную остроту зрения (0,01 и выше), определенную по таблицам или пороговому ЗВП, наряду с лазерной коагуляцией или криотерапией необходимо проводить плеоптическое лечение пораженного глаза и дозированную окклюзию лучше видящего глаза для профилактики глубокой зрительной депривации.
В тех случаях, когда у пациентов с болезнью Коатса развивается распространенная экссудативная или тракционная отслойка сетчатки (стадии Пб— Ша), показано применение ЭКСТрасклерального пломбирования или циркляжав сочетании с витрэктомией, иссечением пре- и субрстинальных мембран, трансретинальным дренированием экссудата и последующей тампонадой силиконовым маслом или перфторуглеродами. Одновременно необходимы эндодиатермия или эндолазерная коагуляция телеангиэктазий.
Пассивное наблюдение за детьми с болезнью Коатса приводит к развитию слепоты в 94 % случаев, грубым косметическим дефектам, обусловленным потерей глаза вследствие энуклеации, — в 39 %. Своевременное лечение при соблюдении пациентами или, в большей степени, их родителями рекомендуемого режима позволяет сохранить глаз у 97 % детей, предметное зрение — у 88 %. Высокую эффектовность агрессивной фотокоагуляции и/или криотерапии подтверждают также результаты М.Е. Ridley и соавт. (1982), которым удалось достичь стабилизации остроты зрения в отдаленном периоде после проведения лечения у 70 % детей старше 4 лет.
Детей с болезнью Коатса, у которых в результате лечения была достигнута ремиссия, необходимо обследовать не реже 1 раза в 4—6 мес, так как у 40 % из них в среднем через 4,5 года возникают новые зоны сосудистых мальформаций. Во избежание развития экссудативных осложнении' все вновь появляющиеся сосудистые аномалии должны быть коагулированы.
Статья из книги: Зрительные функции и их коррекция у детей | С.Э. Аветисов, Т.П. Кащенко, А.М. Шамшинова.



Комментариев 0